慢病毒载体构建和包装操作手册
- 格式:pdf
- 大小:722.88 KB
- 文档页数:18

过表达慢病毒载体构建和包装手册Version1.0吉凯基因二零一一年五月目录简介 (3)第一部分过表达慢病毒载体的制备实验流程 (4)实验材料 (5)过表达克隆制备 (6)第二部分慢病毒包装与滴度检测实验流程 (17)实验材料 (18)L e n t i v i r u s病毒包装 (21)病毒的收获及浓缩 (22)L e n t i v i r u s滴度测定 (24)参考文献 (33)简介慢病毒(Lentivirus)载体是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,它对分裂细胞和非分裂细胞均具有感染能力,并可以在体内较长期的表达且安全性高。
吉凯基因提供的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。
慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。
但该病毒仍然具有可能的潜在的生物学危险,吉凯基因建议不要使用编码已知或可能会致癌的基因的假型病毒,除非已经完全公认某个基因肯定没有致癌性,否则均不建议采用假型病毒进行生物学实验。
吉凯基因慢病毒载体系统由GV慢病毒载体系列、pHelper 1.0载体和pHelper 2.0载体三质粒组成。
GV慢载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件,例如WRE (woodchuck hepatitis virus posttranscriptional regulatory element)。
通常根据不同的实验目的针对GV载体改造以进行基因功能研究。
pHelper 1.0载体中含有HIV病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。
pHelper 2.0载体中含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白。
吉凯基因过表达慢病毒产品可通过对GV慢病毒载体的改造和病毒包装,获得带有特定基因序列的慢病毒颗粒,以满足不同的实验需求。

慢病毒(过表达)包装步骤秦超1.转染复苏293T细胞,传2-3代进行转染,转染推荐使用合元公司的慢病毒转染试剂。
转染步骤:(以10cm培养皿为例)⑴最好在铺细胞后20h左右进行转染,控制转染前细胞密度70%—90%,保证细胞处于良好的状态,转染前一小时把一半培养基(约5ml)换成新的(含血清,因为此转染试剂不需换液)。
⑵加psin 10ug,pspax2 10ug,pmd2.g 5ug于800ul opti—mem,混匀⑶加40ul慢病毒转染试剂于800ul opti—mem,混匀,室温静置5min⑷将⑶所得的转染试剂稀释液滴加到⑵所得到的质粒稀释液中,边加边轻轻混匀,室温放置20min⑸取出细胞培养皿,将⑷得到的质粒转染试剂复合体加入到细胞培养基中,前后轻轻推摇使混合均匀,放回培养箱。
2.收毒(36—48h)收毒前如果质粒带有荧光标签可先看一下转染效率,一般达到60%即可.⑴将培养皿中的病毒上清液吸出到15cm离心管中,然后2000rpm离心10min,以沉淀细胞碎片。
⑵取上清用0.22um滤清过滤到浓缩管(用蛋白质浓缩管即可)中。
4000rpm离心至所需体积。
⑶浓缩完毕后,吸出浓缩后的病毒液,按每次的接毒量分装,-80℃冻存。
由于反复冻融会降低慢病毒滴度,因此避免反复冻融。
3.接毒接毒前12-20h铺细胞,使接毒时细胞密度约为40%—50%,务必使用生长状态良好的细胞。
将分装好的慢病毒滴加到细胞中,加polybrene使其终浓度为8ug/ml细胞密度60%—70%时可以再接毒一次。
4.检测及培养细胞系(48h)如果带有荧光标签可直接显微镜看一下感染效率,如需用药杀用puromycin杀三天(对照组完全杀死),剩下的即为基因整合进去的细胞。
如需培养成细胞系,可继续培养。
如果剩下的细胞较少可用高浓度血清,待细胞聚团时用胰酶消化一下,使细胞铺匀。

Clontech-Lenti-X™ Lentiviral Expression Systems User ManualProtocol No.PT5135-1慢病毒包装操作说明A.用Lenti-X HTX Packaging System生产慢病毒悬浮物为了获得最高效价的病毒悬液,用Lenti-X 293T细胞系,严格尊守以下说明,尤其尊守(1)培养体系和培养量(2)DNA的量和转染质量(3)无四环素血清(4)孵育时间。
所有的Xfect™转染成份,量和条件最好用Lenti-XVectors,Lenti-XHTX包装混合物,Lenti-X293T细胞。
用10cm组织培养板并确保血清无四环素,四环素污染的血清对表达包装成份是有害的。
所有的实验步骤均在无菌组织培养器血中完成。
包装病毒需要有微生物安全等级2的生物安全柜中进行,注意重组的假性慢病毒包装颗粒能够感染人。
61.转染24小时前,在10cm培养板接种4-5×10个293T细胞,添加10ml的生长培养基。
在37℃,5%CO2℃条件下过夜。
在进行第7步前确保培养血有80-90%的覆盖率。
2.充分混均Xfect Polymer。
3.每个转染样品需准备两个离心管,按顺序添加如下试剂Tube 1(Plasmid DNA) Tube 2(Polymer)557µlXfectReaction Buffer592.5µl Xfect ReactionBuffer36µl Lenti-X HTX Packaging Mix7.5µl Xfect Polymer7µl Lenti-X Vector DNA(1µg/µl)600µl 总量600µl 总量注意:Xfect Polymer不要在室温下搁置长于30min4.充分混均每个管5.把Tube2添加到Tube1中,中速涡旋10秒。

慢病毒包装步骤慢病毒包装步骤慢病毒包装简要步骤:以六孔板中的1孔为例,每个样品需要1×106个293T细胞。
1、取1.5ml灭菌EP管,加入1.5μg包装混合质粒和0.5μg表达质粒以及250μl的无血清培养基。
轻柔混匀,室温孵育5min。
3、将DNA溶液和脂质体溶液轻柔混匀。
室温孵育20min4、用胰酶消化并记数293T细胞。
用含血清的培养基重悬细胞。
5、在六孔板中每孔,加入1ml含血清的生长培养基,再加入DNA-脂质体复合物。
6、将1ml重悬的293T细胞(1×106个细胞/ml)加入到平板中。
37℃CO2孵箱中孵育过夜。
7、转染后48-72h收获含病毒的上清。
3000 rpm 离心20min,去除沉淀。
8、病毒上清-80°C贮存。
包装出来的慢病毒对NIH/3T3细胞达90%以上感染效率。
注意事项1.在慢病毒感染细胞前,为检测病毒上清培养液内病毒的活性,并确定病毒与转染细胞之间的比率,需要确定病毒2. 在慢病毒转染细胞的过程中最重要的一步是融合,只有一些较小的慢病毒载体才能转导进细胞,因此,病毒颗粒的吸附是慢病毒转染的限速步骤。
质粒转染的步骤1、DNA的量:Lipofectamine 2000=1:2~32、细胞密度大约占培养板的80%左右,转染。
3、转染期间不要加抗生素,否则会导致细胞死亡。
步骤如下:以24孔培养板为例1、转染前一天细胞换新的培养基2、制备DNA-Lipofectamine 2000复合物,如下:a、用50ul无血清培养基稀释DNA(0.8g),轻轻混匀;b、Lipofectamine 2000使用前,轻轻混匀,用48ul无血清培养基稀释2ul Lipofectamine 2000,轻轻混匀,室温孵育5分钟;c、将a+b的液体加在一起,轻轻混匀,室温孵育20分钟,使DNA-Lipofectamine 2000复合物形成;3、将100ul DNA-Lipofectamine 2000复合物加入培养板中,轻轻前后摇匀;4、放入37度孵箱中培养24~48h后,1:10传代,加入G418筛选。

一、简介慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达.二、实验流程(大致的简单过程)慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体(自己构建)和包装质粒(购入)同时共转染细胞,在293T 细胞(购入)中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子.大致的实验流程:1. 根据目的基因相关信息(序列,序列号等),构建含有外源基因或siRNA的重组载体;(即质粒构建,已构建好,质粒可以永久保存)2. 对于测序正确的重组质粒,提取和纯化高质量的不含内毒素的重组质粒;3. 使用高效重组载体和病毒包装质粒(购入)共转染293T 细胞[1],进行病毒包装和生产,收集病毒液;4. 浓缩、纯化病毒液;5. 用高质量的病毒液感染细胞(293T细胞);6。
通过定量PCR精确测定病毒滴度(高精确滴定方法)和Western 分析实验结果;7。
用高质量的病毒液感染宿主细胞;检测基因功能或者siRNA的沉默效率以及使用药物进行稳定转染细胞株的筛选,通常状况下,筛选的细胞克隆株具有长期的表达稳定性.病毒液足够用于一般的动物活体实验。
三、重组质粒构建流程1.基因的获得:shRNA寡核苷酸序列的设计和合成(将正确序列克隆入载体中,退火形成双链,PCR扩增)2。
回收A.酶切产物的胶回收:一般做50-100ul 体系,然后跑电泳回收,回收量一般为30ul. B.PCR扩增产物的胶回收原理:首先利用低熔点琼脂糖凝胶电泳DNA片段,分离目的条带DNA,然后紫外光下切割含目的DNA条带的胶块,利用胶回收试剂盒回收纯化DNA片段。

慢病毒包装操作流程一、材料1 细胞培养试剂试剂名称终浓度试剂品牌DMEM/High glucose基础培养基90%Invitrogen胎牛血清10%Invitrogen/Gibco丙酮酸钠1mM Invitrogen2 慢病毒包装试剂试剂名称浓度试剂品牌Lipofectamine 2000InvitrogenPEG6000溶液50%WakoHBSS溶液Invitrogen3 耗材50 mL离心管15 mL离心管10 cm细胞培养皿μm过滤器2 mL EP管二、操作流程1细胞培养1.1293T/293FT细胞的复苏1)将完全培养液从4°C中取出放置到室温预热30 min左右。
在超净台内,用吸管吸取6~7mL完全培养液至15 mL离心管中;2)快速将冻存的细胞从液氮中取出,并迅速用镊子夹住盖子放入37°C 水浴中快速晃动(水不要没到盖子),使其在1~2分钟内完全融化;3)在超净台内,用酒精棉球擦拭冻存管外壁消毒,用吸管吸取所有融化的细胞悬液至装准备好的完全培养液中,轻轻吹打混匀,使冻存液分散开(目的是让DMSO分散,降低恢复室温的DMSO对细胞造成的毒性作用)。
4)在室温条件下,250 g离心4分钟。
5)离心后,在超净台内小心倒去上清,用吸管吸取2 mL新鲜完全培养液重悬细胞至单细胞悬液,再转移已经加好培养基的培养瓶/培养皿中,写上细胞名称、日期,放置37°C、5% CO2饱和湿度培养箱内培养。
(首次复苏细胞时,离心重悬后需取样计数,根据细胞数选择面积合适的培养容器。
)6)复苏翌日,给复苏的293T细胞更换新鲜的完全培养基。
1.2293T/293FT细胞传代1)待细胞长至60%-70%融合度即可传代。
将培养瓶里的所有培养液全部移去,用1×PBS洗涤细胞两次(洗涤速度要快,避免细胞干涸时间过长),以去除残余的培养液和血清(血清含有胰酶的抑制因子);2)加入适当的胰酶溶液,能使其完全浸过细胞即可,室温孵育1-2分钟。

慢病毒使用操作手册:1 慢病毒使用操作2 慢病毒安全使用规范3 悬浮细胞感染方法概要4 相关专业术语(详情可参考公司网站FAQ)5 细胞培养器皿的相关参数1、慢病毒使用操作手册1.1 慢病毒的储存与稀释:1.1.1 病毒的储存:用户收到病毒液后在很短时间内即使用慢病毒进行实验,可以将病毒暂时放置于4 ℃保存;如需长期保存请放置于-80℃(病毒置于冻存管,并使用封口膜封口)A.病毒可以存放于-80℃ 6个月以上;但如果病毒储存时间超过6个月,我们建议在使用前需要重新滴定病毒滴度B.反复冻融会降低病毒滴度:每次冻融会降低病毒滴度10%;因此在病毒使用过程中应仅尽量避免反复冻融,为避免反复冻融我们强烈建议客户收到病毒后按照每次的使用量进行分装。
1.1.2 病毒的稀释:用户需要稀释病毒时,请将病毒取出置于冰浴融解后,使用培养目的细胞用PBS或无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后4℃保存(请尽量在三天内用完) 分装后使用。
1.2 慢病毒用于体外(In Vitro)实验:感染培养原代细胞和建系细胞1.2.1 慢病毒对各种细胞和组织的亲嗜性不同,用户使用Invabio提供的慢病毒之前可以通过查阅相关文献,了解慢病毒对您的目的细胞的亲嗜性,感染复数(MOI 值)以及在体(In Vivo)注射所需要的病毒量。
如果没有相关文献支持,可以通过感染预实验得到合适的感染复数(MOI 值)(使用24孔板检测病毒对目的细胞的亲嗜性)1.2.2 慢病毒感染目的细胞预实验1.2.2.1 慢病毒感染目的细胞预实验注意事项A.测定慢病毒对目的细胞的亲嗜性时,需要同时设置对慢病毒亲嗜性较高的细胞(HEK293T,Hela)作为平行实验的对照细胞。
B.在进行慢病毒感染实验时,可以用完全培养基(培养目的细胞用)稀释;理论上,含有血清,双抗或者其他营养因子的完全培养基不影响慢病毒的感染效率。
C. Invabio提供的病毒单位为TU/ml, 即每毫升中含有具有生物活性的病毒颗粒数。

慢病毒包装体系使用说明本说明书适用于以下产品:名称货号慢病毒包装体系KLV3501慢病毒包装体系(含293V细胞)KLV3502慢病毒包装体系(含转染试剂)KLV3503慢病毒包装体系(含293V细胞、转染试剂)KLV3504北京英茂盛业生物科技有限公司Web site:1北京英茂盛业生物科技有限公司/产品内容KLV3501KLV3502KLV3503KLV3504慢病毒载体(过表达或RNA 干扰载体任选一种) 3333辅助载体pH1 3 3 3 3 辅助载体pH2 3 3 3 3 HEK293V 细胞 3 3 Polyfect-V 转染试剂33载体采用质粒形式发货,请在收到质粒后放-20℃冻存,也可以直接转化大肠杆菌感受态进行质粒扩增。
HEK293V 细胞采用干冰或培养瓶发货。
请在收到细胞后根据附带说明书进行复苏或传代。
慢病毒载体慢病毒载体中含有病毒整合和表达所需原件及表达外源目的基因的元件。
外源基因通过载体中的多克隆位点插入慢病毒载体中进行表达。
pLV-EGFP-C 的载体图谱见下,本公司的其它慢病毒载体结构与之基本相似。
其它载体信息见本公司网站 或本说明书后面的附表。
慢病毒包装载体慢病毒包装载体包括pH1和pH2,表达生产病毒颗粒所需的病毒蛋白。
载体图谱见下:HEK293V细胞包装细胞的状态对病毒包装效果有直接影响。
我公司保存的293V细胞为低次代293V细胞,细胞性状稳定。
在高密度下生长3天仍可保持贴壁状态,持续产生病毒颗粒,因此可多次收获病毒,降低病毒包装实验成本。
Polyfect‐V转染试剂Polyfect-V转染试剂专为293V细胞转染及慢病毒包装研制,可以在细胞铺板同时进行转染,缩短病毒包装时间;无需要求细胞处于生长对数期,细胞转染时密度可以很高;细胞毒性极低;质粒和转染试剂用量是普通转染试剂的1/3到1/2等显著优点;包装病毒时转染效率接近100%,能提高病毒产量3-5倍。
3北京英茂盛业生物科技有限公司/慢病毒包装概述:病毒包装前需制备转染级慢病毒载体及两种包装载体。

慢病毒生产及使用操作手册一、实验流程制备慢病毒穿梭质粒及其辅助包装原件载体质粒,三种质粒载体分别进行高纯度无内毒素抽提,共转染293T细胞,转染后6 h 更换为完全培养基,培养48和72h后,分别收集富含慢病毒颗粒的细胞上清液,病毒上清液通过超离心浓缩病毒。
以下内容由汉恒生物科技(上海)有限公司精心整理总结。
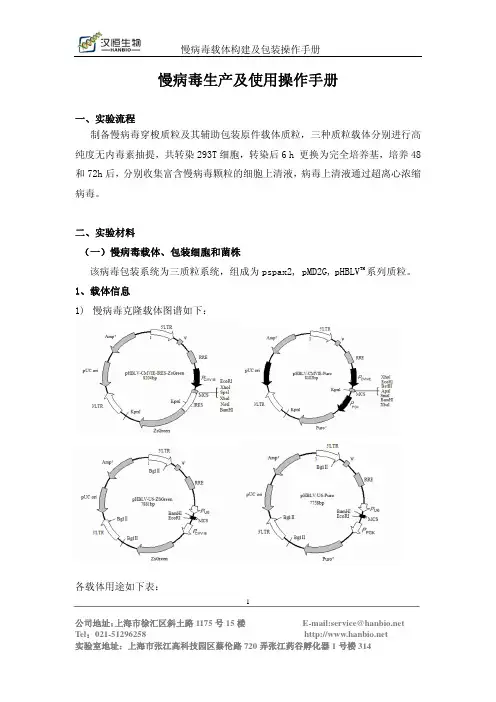
二、实验材料(一)慢病毒载体、包装细胞和菌株该病毒包装系统为三质粒系统,组成为pspax2, pMD2G,pHBLV TM系列质粒。
1、载体信息(见附录)2、细胞株 293T,慢病毒的包装细胞,为贴壁依赖型成上皮样细胞,生长培养基为DMEM(含10% FBS)。
贴壁细胞经培养生长增殖形成单层细胞。
3、菌株大肠杆菌菌株DH5α。
用于扩增慢病毒载体和辅助包装载体质粒。
三、包装细胞293T细胞的培养(一) 293T细胞的冻存随着传代的次数增加,293T细胞会出现生长状态下降、突变等。
为了防止此类现象的出现,我们需要在开始就对细胞进行大量冻存,以保证实验的稳定性和持续性。
在细胞对数生长期进行冻存,增加细胞复苏成活率。
1、去掉上清液,加入PBS洗去残留的培养基;2、加入0.25%的胰酶,消化1~2min后,镜下观察细胞变圆,细胞间间隙加大时,去除胰酶,加入新鲜培养基吹打混匀,移入离心管中。
3、细胞计数,将细胞全部晃下,加入 3mL 37 ℃预热的 10% DMEM,用 10mL 移液管进行吹打,较大力吹打 6~8 次即可,不留死角,之后,将所有细胞吸出,置于15mL 离心管中,取 50ul 混匀后的细胞于 1.5mL eppendorf 管中,加入 450ul 10% DMEM,即为 10 倍稀释,混匀,取 10ul 细胞于计数板中计数。
计数板上共 4 大格,每大格 16 小格。
计数时,4 大格均计数,总数除以 4(得每大格细胞数),再乘以 10(10 倍稀释),即为实际 n万/mL 细胞浓度。
4、细胞离心,1000rpm,5min。

试剂配制:HBS:280 mM NaCl, 10mM KCl, 1.5 mM Na2HPO4, 12 mM Glucose,50 mM HEPES, 0.5mol/LNaOH, pH调至7.05,定容至1L,0.22µm滤膜过滤除菌,分装至50ml离心管-20°C保存。
2.5M CaCl2 溶液,0.22µm滤膜过滤除菌,分装至Ep管-20°C保存。
细胞培养条件:293-T及Huh7均用含10%FBS的DMEM培养液,HepG2用10%FBS的DMEM培养液培养。
HepG2-ATCC培养过程中不铺胶原,种板前铺胶原。
采用四质粒系统phouge ,pMDL,pVSVG ,pREV,表达载体phouge:pCDH- EF1-MCS-T2A-Puro磷酸钙转染法转染293-T细胞。
转染35mm板为例转染前14-16h细胞消化细胞,以汇合度60-70%均匀铺到35mm板中,转染前1h细胞换液,弃掉旧的培养液,换成新鲜无FBS的培养液。
加培养液时要小心,293-T细胞贴壁不牢。
制备磷酸钙-DNA沉淀:配制质粒混合物:phouge 2µg , pMDL 1µg, pVSVG 0.6µg, pREV 0.4µg(质粒体积最好大于0.5ul,如果浓度过高,将质粒稀释)在1.5ml Ep管中加入90µl超纯水,在水中央加入混好的质粒,将10µlCa Cl2 加到底部,沿管壁加入100µl HBS,在HBS与水的分界处用黄枪头吹几个吹散CaCl2,静止20-30min(25min),混匀后均匀滴到细胞中,轻轻摇动,放到37°C培养箱。
8-12h后给细胞换成新鲜的完全培养液,加NEAA(100X)20µl(1µl/1ml培养液)。
注意要观察细胞状态,细胞状态变差,要及时换新鲜培养液。
SHANGHAI GENECHEM CO., LTD.RNAi慢病毒载体构建实验方法Version2.0吉凯基因二零一零年五月目录第一部分RNAi慢病毒载体的制备实验流程 (3)实验材料 (4)s i R N A靶点设计 (6)双链D N A O l i g o制备 (8)克隆制备与鉴定 (9)第二部分RNAi慢病毒包装与滴度检测实验流程 (13)实验材料 (14)L e n t i v i r u s病毒包装 (18)病毒的收获及浓缩 (19)L e n t i v i r u s滴度测定 (21)参考文献 (24)第一部分RNAi慢病毒载体的制备实验流程首先合成含干扰序列的单链DNA oligo,然后退火配对产生双链,再通过其两端所含酶切位点直接连入酶切后的RNAi慢病毒载体上;将连接产物转入制备好的细菌感受态细胞,PCR 鉴定阳性重组子后,送测序验证,测序结果经比对确认正确的克隆即为构建成功的目的基因RNAi 慢病毒载体(构建流程见Fig.1)。
Fig.1 RNAi 慢病毒载体构建流程图实验材料1.试剂试剂名称试剂来源Cat.No. PCR用试剂primer(R&F)上海吉凯基因技术有限公司合成Taq polymerase Takara DR010sdsDNA oligo上海吉凯基因技术有限公司合成QIAGEN Plasmid 大抽KitQIAGEN 12163BSA上海捷倍思基因技术有限公司LB or SOB or SOC ATCC 40423CaCL2上海越俊生化有限公司T4 DNA ligase NEB M0202v T4 DNA ligase buffer NEB M0203vMgSO4上海吴化化工有限公司琼脂糖赛百盛GA4-100250bp DNA ladder Marker 捷瑞DL250+,100Tpositive clone 测序美季ABI3733 Age I NEB R0552V EcoR I NEB R0101V Hpa I NEB R0105V Xho I NEB R0146V2.仪器仪器名称仪器来源Cat.No.稳压电泳仪上海西巴斯DY-A凝胶成像仪天能公司Tanon 2500细菌摇床华利达实验设备公司HI-9211K细菌培养箱上海一恒科学仪器有限公司GHP9080PCR仪Applied Biosystems 2720 thermal cycler高速离心机日立公司TGL-16G-A 一次性平皿湖南长沙天地人生物科技有限公司1L烧瓶金坛市晶玻实验仪器厂1111.1115 50 ml 聚丙烯管上海吴化化工有限公司Gilson移液器吉尔森公司siRNA靶点设计针对目的基因序列,利用公用网站中提供的RNA干扰序列设计原则,设计多个RNA干扰靶点序列,根据吉凯多年的设计经验和设计软件进行评估测定,选择最佳的动力学参数靶点进入后续实验流程;除了自行设计的siRNA靶点序列之外,我们也使用一些RNA干扰实验中公认序列,比如RNAi阴性对照(Negative Control,NC)Scramble序列(TTCTCCGAACGTGTCACGT);同时,siRNA靶点序列亦可由客户提供,我们将根据客户的不同要求将目的序列构建到相应的慢病毒载体上。
Lenti-Pac™HIV慢病毒包装试剂盒使用手册目录1产品概述2试剂盒组成3包装慢病毒颗粒所需的实验材料4慢病毒颗粒转导靶细胞所需的实验材料5实验前的准备6慢病毒颗粒的包装制备原理7制备慢病毒8慢病毒滴度检验9慢病毒感染目的细胞10使用许可与质量保证GeneCopoeia,Inc.广州易锦生物技术有限公司广州高新技术产业开发区广州科学城掬泉路3号广州国际企业孵化器F区8楼邮编:510663电话:4006-020-200邮箱:******************英文网址:中文网址:©2022GeneCopoeia,Inc.HIV(人类免疫缺陷病毒)骨架的慢病毒载体是目前最常用的慢病毒表达载体,它能在体外或体内实验有效介导外源基因转导多种分化或非分化哺乳动物细胞,使外源基因稳定整合靶细胞的基因组,并进行稳定的高水平表达。
GeneCopoeia Lenti-Pac™HIV慢病毒包装系统是安全性较高的第三代慢病毒包装系统,表达载体自身失活,不产生额外的慢病毒复制。
该系统包括:混合包装质粒、EndoFectin™-Lenti转染试剂、可进一步提高滴度的TiterBoost™滴度增强剂、以及eGFP阳性对照质粒。
Lenti-Pac™HIV慢病毒包装系统可将HIV载体的慢病毒表达克隆包装成为具有转导效果的慢病毒颗粒,包装所得的慢病毒颗粒可立即使用,介导目的基因在哺乳动物细胞进行高效表达。
GeneCopoeia提供40000多种人源及小鼠源的慢病毒载体ORF表达克隆,以及针对人源、小鼠源、大鼠源及其他哺乳类动物染色体组靶基因的慢病毒载体shRNA克隆。
除此以外,GeneCopoeia同时提供20000多种人源慢病毒载体miRNA前体表达克隆、miRNA抑制剂表达克隆以及启动子报告克隆,18000种小鼠的慢病毒载体启动子报告克隆。
以上所有克隆均应用HIV骨架,可随时应用于慢病毒包装。
根据疾病控制中心制定的标准,GeneCopoeia第三代HIV慢病毒包装系统满足生物安全第二级别(BSL-2)的要求。
慢病毒使用操作手册简介:慢病毒(Lentivirus)是一种常用于生命科学研究中的病毒载体,其具有较强的基因转染能力和稳定的基因表达特性。
本操作手册旨在向研究者提供一个详细的慢病毒使用指南,帮助他们顺利进行慢病毒基因转染实验并获得准确可靠的研究结果。
一、慢病毒基本原理慢病毒属于反转录病毒,其基因组为单链RNA。
慢病毒在寄主细胞内通过逆转录过程将RNA转录为DNA,随后将DNA插入宿主基因组中。
这使得慢病毒成为将外源基因稳定集成到宿主基因组中的理想工具。
二、慢病毒使用前准备1. 实验室条件准备:确保工作台面干净整洁,并准备好所需的培养物、培养器具和试剂。
2. 慢病毒载体制备:根据实验需要,选择合适的慢病毒载体,并通过慢病毒包装系统将目标基因插入载体中。
三、慢病毒转染实验步骤1. 细胞培养:将目标细胞接种在培养皿中,并选择合适的培养基进行细胞培养。
2. 慢病毒感染:将预制的慢病毒悬液加入培养皿中,控制感染浓度和时间,以实现最佳的感染效果。
3. 筛选标记:根据实验需要,在感染后适当的时间点添加筛选标记物,如抗生素或荧光标记剂。
4. 选择和扩增:将受筛选标记影响的细胞单克隆分离,扩增和保存。
5. 验证表达:使用合适的实验方法,如western blot或PCR等,来确认目标基因的表达情况。
6. 结果分析:对实验结果进行统计学分析,并绘制适当的图表。
四、注意事项和常见问题解决方案1. 实验前应认真阅读文献,了解慢病毒的基本原理和实验操作流程。
2. 制备慢病毒载体时,应仔细验证目标基因的序列和正确插入。
3. 慢病毒感染时应注意控制感染浓度和时间,避免细胞毒性和非特异性感染。
4. 筛选标记物的选择应根据实验需要和细胞类型进行合理选择。
5. 实验过程中,注意严格遵守实验室安全和生物安全操作规范。
6. 常见问题解决方案:如遇到感染效率低或细胞毒性问题,可以尝试优化感染条件或调整细胞培养条件。
如果基因表达不稳定,可以尝试选择合适的筛选标记物或优化基因载体。
如何包装慢病毒如何包装慢病毒⼀、整体实验流程⼆、实验材料(⼀)慢病毒载体、包装细胞和菌株该病毒包装系统为三质粒系统,组成为psPAX2, pMD2.G, pHBLV TM系列质粒。
1、载体信息(见附表1)2、细胞株:我们采⽤293T作为慢病毒的包装细胞。
该细胞系为贴壁依赖型成上⽪样细胞,⽣长培养基为DMEM+10% FBS+双抗。
贴壁细胞经培养⽣长增殖形成单层细胞。
3、菌株:⼤肠杆菌菌株DH5α⽤于扩增辅助包装载体质粒;Stbl3⽤于扩增pHBLV TM 系列质粒,防⽌病毒载体重组。
三、慢病毒包装和浓缩(⼀)质粒扩增构建好的慢病毒载体和辅助质粒需经过⼤量抽提,浓度⼤于1 µg/µl,A260/280在1.7-1.8间⽅可⽤以病毒包装。
推荐使⽤Qiagen⼤抽试剂盒进⾏质粒的⼤量去内毒素抽提(质粒质量会极⼤影响后续转染效率和病毒的滴度)。
(⼆)做脂质体转染转染前⼀天,按照5?106/T75的密度铺下293T细胞。
24h后转染。
转染前请把DMEM和转染试剂LipoFiter TM恢复⾄室温,使⽤前需摇匀。
转染每瓶T75的质粒成分如下:psPAX2 10 µgPMD2.G 10 µgpHBLV TM系列载体10 µg请参考LipoFiter TM转染试剂说明书进⾏转染操作。
转染后6 h换新鲜培养基。
注:LipoFiter TM转染试剂为汉恒⽣物研制的DNA转染试剂产品,使⽤说明请参考LipoFiter TM说明书。
(三)病毒收集和离⼼转染后48h和72h分别两次收集病毒上清(48h收集后置换新鲜培液),收集后以0.45 µm滤器过滤,于40 ml超速离⼼管中,4℃,72000?g离⼼120 min。
(四)病毒重悬和保存500 l 新鲜培养液重悬病毒沉淀,置于-80℃甚⾄液氮保存。
附1:汉恒⽣物慢病毒质粒列表(质粒图谱请登陆汉恒官⽹/doc/dd95f5e0b8d528ea81c758f5f61fb7360a4c2b13.html 查询)载体名称⽤途启动⼦容量抗药标记荧光标记pHBLv-CMV-MCS-EF1-RFP-T2A-puro过表达CMV 2.5kb Puromycin RFP pHBLv-CMV-MCS-EF1-ZsGreen-T2A-puro过表达CMV 2.5kb Puromycin ZsGreen pHBLV-CMV-MCS-EF1-Luc-T2A-Puro过表达CMV 2.0kb Puromycin Luc pHBLV-CMV-MCS-EF1-Puro 过表达CMV 3.0kb Puromycin ⽆pHBLV-CMV-MCS-T2A-Puro 过表达CMV 3.0kb Puromycin ⽆pHBLV-CMV-MCS-T2A-ZsGreen过表达CMV 3.0kb ⽆ZsGreen pCDH-CMV-MCS-EF1-RFP-T2A-Puro过表达CMV 3.0kb Puromycin RFP pCDH-CMV-MCS-EF1-GFP-T2A-Puro过表达CMV 2.5kb Puromycin GFPpHBLV-Tet-on-SV40-puroTet-on过表达TRE3G1.5kb Puromycin ⽆pHBLV-CMV-crRNA-EF1-GFP-T2A-puro 环状RNA过表达CMV 2.5kb ⽆GFPpHBLV-U6-MCS-EF1-mCherry-T2A-puro ⼲扰U6shRNAPuromycin mCherrypHBLV-U6-MCS-CMV-ZsGreen-PGK-Puro ⼲扰U6shRNAPuromycin ZsGreenpHBLV-U6-MCS-EF1-Luc-T2A-Puro ⼲扰U6shRNAPuromycin LucpHBLV-U6-MCS-EF1-ZsGreen-T2A-Luc ⼲扰U6shRNA⽆ZsGreen/LucpHBLV-U6-MCS-EF1-RFP-T2A-Luc ⼲扰U6shRNA⽆RFP/LucpHBLV-U6-MCS-EF1-Luc-T2A-Bla ⼲扰U6shRNABlasticidin LucpHBLV-U6-MCS-CMV-ZsGreen ⼲扰U6shRNA⽆ZsGreen pHBLV-U6-MCS-PGK-puro ⼲扰U6shRNAPuromycin ⽆pHBLV-EF1α-cas9-U6-gRNA-puro Cas9/gRNAEF1α/U6Cas9/gRNAPuromycin ⽆pHBLV-EF1α-cas9-CMV-puro cas9 EF1αCas9 Puromycin ⽆pHBLV-U6-gRNA-EF1a-puro gRNA U6 gRNA Puromycin ⽆。
慢病毒包装试验慢病毒包装试验慢病毒(Lentivirus)载体是以 HIV1 (人类免疫缺陷 1 型病毒)为基础进展起来的基因治疗载体。
慢病毒具有感染谱广泛、可以有效感染分裂期和静止期细胞、长期稳定表达外源基因等优点,因此成为导入外源基因的有力工具。
现在慢病毒系统已经被广泛应用到各种细胞系的基因过表达、RNA 干扰、microRNA 讨论以及活体动物试验中。
一、试验流程图 1、慢病毒包装试验流程图二、试验仪器与试验材料psPAX2 质粒,pMD2.G 质粒,pHBLVTM系列质粒;293T 细胞;wan全培育基;DH5α 菌株;Stbl3 菌株。
三、试验步骤1. 质粒扩增。
将构建好的慢病毒载体和包装质粒使用大抽试剂盒进行质粒的去内毒素抽提,浓度建议不低于 1 μg/μl,A260/280 在 1.71.8 间方可用于病毒包装。
推举使用 Qiagen 大抽试剂盒进行质粒的大量去内毒素抽提(质粒质量会极大影响后续转染效率和病毒的滴度)。
2. 脂质体转染。
转染前一天,在10 cm皿中接种生长状态良好的293T细胞,以第二天汇合度能达到 30% ~ 50% 为宜。
24 h 后转染,转染前需要把 DMEM 和慢病毒包装专用转染试剂 LentiFitTM恢复至室温,使用前需摇匀。
每个皿的质粒成分如下:表 1、慢病毒包装转染体系用于包装的三个质粒摩尔比通常为 1:1:1,可以依据情况稍加调整。
请参考 LentiFitTM转染试剂说明书进行转染操作,转染后46 h 换新鲜培育基。
3. 病毒收集和离心。
转染后 48 h 和 72 h 分别两次收集病毒上清(48 h 收集后置换新鲜培液),将收集的上清用0.45 μm滤器过滤,然后放于超速离心管中,4 ℃,72000 g 离心 120 min。
4. 病毒重悬和保存。
弃上清,500 μl 重悬液重悬病毒沉淀,一周内使用则置于4 ℃ 保存,如需长时间存放需置于80 ℃ 或液氮罐保存。
慢病毒载体构建及包装操作手册目录慢病毒收到后的注意事项一、整体实验流程二、实验材料三、慢病毒包装和浓缩四、感染目的细胞附1. 汉恒生物慢病毒质粒列表附2. 慢病毒滴度测定方法简介附3. 慢病毒MOI感染参数附4. 汉恒生物各病毒载体感染目的细胞比较慢病毒安全使用和注意事项➢慢病毒安全使用注意事项(*非常重要!!!*)1)慢病毒相关实验请在生物安全柜(BL-2级别)内操作。
2)操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
3)操作病毒时特别小心病毒溅出。
如果操作时超净工作台有病毒污染,请立即用70%乙醇加1%的SDS溶液擦拭干净。
接触过病毒的枪头,离心管,培养板,培养液请于84消毒液浸泡后统一处理。
4)如需要离心,应使用密封性好的离心管,如有必要请用封口膜封口后离心。
5)病毒相关的废弃物需要特殊收集,统一经高温灭菌处理。
6)实验完毕用香皂清洗双手。
➢慢病毒收到后的注意事项1)慢病毒的储存用户收到病毒液后在短期内即使用慢病毒进行实验,可以将病毒暂时放置于4 ℃保存(尽量一周内用完);如需长期保存请分装后放置于-80℃。
注:a.反复冻融会降低病毒滴度(每次冻融会降低病毒滴度10%-50%);在病毒使用过程中应尽量避免反复冻融,所以我们前期对病毒进行了分装(200 l/tube),收到后直接放置-80℃保存即可。
b.如果病毒储存时间超过6个月,我们建议在使用前重新测定病毒滴度。
2)慢病毒的稀释用户需要稀释病毒时,请将病毒取出置于冰浴融解后,使用培养目的细胞用PBS或无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后置于4℃保存(请尽量一周内用完)。
一、整体实验流程二、实验材料(一)慢病毒载体、包装细胞和菌株该病毒包装系统为三质粒系统,组成为psPAX2, pMD2.G, pHBLV TM系列质粒。
1、载体信息(见附表1)2、细胞株:我们采用293T作为慢病毒的包装细胞。
该细胞系为贴壁依赖型成上皮样细胞,生长培养基为DMEM+10% FBS+双抗。
贴壁细胞经培养生长增殖形成单层细胞。
3、菌株:大肠杆菌菌株DH5α用于扩增辅助包装载体质粒;Stbl3用于扩增pHBLV TM 系列质粒,防止病毒载体重组。
三、慢病毒包装和浓缩(一)质粒扩增构建好的慢病毒载体和辅助质粒需经过大量抽提,浓度大于1 μg/μl,A260/280在1.7-1.8间方可用以病毒包装。
推荐使用Qiagen大抽试剂盒进行质粒的大量去内毒素抽提(质粒质量会极大影响后续转染效率和病毒的滴度)。
(二)做脂质体转染转染前一天,按照5⨯106/T75的密度铺下293T细胞。
24h后转染。
转染前请把DMEM 和转染试剂LipoFiter TM恢复至室温,使用前需摇匀。
转染每瓶T75的质粒成分如下:psPAX2 10 μgPMD2.G 10 μgpHBLV TM系列载体10 μg请参考LipoFiter TM转染试剂说明书进行转染操作。
转染后6 h换新鲜培养基。
注:LipoFiter TM转染试剂为汉恒生物研制的DNA转染试剂产品,使用说明请参考LipoFiter TM说明书。
(三)病毒收集和离心转染后48h和72h分别两次收集病毒上清(48h收集后置换新鲜培液),收集后以0.45 μm滤器过滤,于40 ml超速离心管中,4℃,72000⨯g离心120 min。
(四)病毒重悬和保存500 μl 新鲜培养液重悬病毒沉淀,置于-80℃甚至液氮保存。
四、感染目的细胞(一)细胞准备将状态良好的目的细胞接种到24孔板,使细胞浓度为1×105/ml细胞,接种细胞数量因细胞的生长速度而略有不同,一般是保证第二天进行病毒感染的时候细胞汇合率介于50%至70%之间。
(二)病毒感染1.Polybrene的选择:Polybrene是带正电的小分子,与细胞表面的阴离子结合,提高慢病毒对细胞的感染效率,通常加入polybrene能提高感染效率2~10倍。
Polybrene有一定的细胞毒性,有的细胞对Polybrene的毒理反应明显,因此细胞感染时是否适合Polybrene需要摸索;不同细胞对Polybrene的敏感度不同,可以用1~10μg/ml的范围筛选合适的浓度,以24h内细胞无明显毒性反应为佳,可参考文献并进行预实验摸索,Polybrene最常用的工作浓度为6~8 μg/ml。
注:1)汉恒生物的自产的Polybrene 产品,用户可用以进行辅助感染。
提供的Polybrene母液保存在-20℃(可保存1年以上),避免反复冻融3次以上,否则活性受影响。
4℃可保存2周。
2)Polybrene预实验请先使用对照病毒进行摸索,部分细胞系MOI及Polybrene 的使用范围请参见附表3。
2.感染细胞最佳MOI的测定MOI(Multiplicity of Infection,感染复数)是指每个细胞感染的病毒数,通常MOI 越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。
对于分裂活跃的细胞,比如Hela、293细胞,MOI=1~3时,80%以上的细胞均表达目的基因。
而对于非分裂细胞,比如原代细胞,感染效率较低。
需要进行MOI梯度摸索实验,选择适合的MOI进行实验。
3.感染步骤按实验需要将细胞铺板(比如12孔板)。
细胞数以第2天密度约50%为宜。
37℃培养过夜。
对于Polybrene可施加的细胞:准备完全培养基和Polybrene混合物,Polybrene 终浓度为摸索得到的最适终浓度。
移去培养基并添加0.5 ml Polybrene/培养基混合物于每孔中(适用于24 孔板,其他孔板请相应调整体积。
)注:对于不适用Polybrene的细胞,以上步骤省略,直接进入下面步骤。
感染前,从冰箱取出并在冰上慢慢融化病毒,吸去细胞原有培养基,加入1/2体积新鲜培养基,再将病毒原液加入细胞中,轻轻混匀。
(具体加入的病毒数可参考附表1)37℃小体积感染4 h,4 h后补齐培养基至正常体积。
(感染时培养基体积表格如下)病毒小培养体积感染表培养皿类型表面积/cm2培养基体积病毒体积96-well 0.3 cm2100 µl 50 µl24-well 2 cm2500 µl250 µl12-well 4 cm2 1 ml 500 µl6-well 10 cm2 2 ml 1 ml 慢病毒感染4 h后补足至培养体积,感染24 h后换液,腺病毒感染4-8 h后直接换液感染后第二天(约24 h),吸去含病毒的培养液,换上新鲜的完全培养液,继续37℃培养。
感染后48 h,对于带GFP报告基因的病毒,可通过荧光显微镜观测GFP表达效率,对于携带Puromycin抗性基因的病毒,换上含适当浓度Puromycin的新鲜完全培养液,筛选稳定转导的细胞株(详见下方)。
注意:融化的病毒置于冰上。
反复冻溶或长时间将病毒颗粒暴露于常温可使病毒效价降低。
4.Puromycin抗性筛选Puromycin标准的施加终浓度范围为1~10 μg/ml,不同细胞puromycin的工作浓度不同,请查找相关文献(部分细胞参考用量见下图),另外请设不感染筛选对照(未经过病毒感染的野生型细胞),加入等量等浓度的Puromycin。
部分细胞Puromycin参考值:Cell line Species Puromycin (µg/ml)293系列Human 3HeLa Human 3B16 Mouse 1-3PC1.0 Hamster 10MC3T3-E1 Mouse 10H9C2 Rat 1MCF-7 Human 1-3 MDA-MB-×××Human 1-3HepG2 Human 2HT1080 Human 1A549 Human 1.5H1299 Human 2Human embroyonic stem cellsHuman 1 (Human ESCs)更多Puromycin使用浓度更新中,详情请参考公司网站.每2-3天更换一次含有Puromycin的完全培养液,直至没有感染病毒的对照组细胞被Puromycin杀光,然后可进行以下两步操作(依照具体实验需要选择)。
1)不挑取单克隆将感染并筛选后的细胞进行传代,并继续施加Puromycin进行维持性筛选培养。
连续筛选并传3代后,冻存保种细胞Mixture(这种Mixture由于各个细胞的不均一性,有时候表型可能不是太好,建议做单克隆挑取)。
2)挑取单克隆将感染并筛选后的细胞挑选至少5个克隆进行细胞扩增,并继续施加Puromycin进行维持性筛选培养。
扩增完毕后Western blot或者qPCR检测目的蛋白或基因的表达。
挑取表达量适中的稳定细胞株,连续筛选并传3代后,冻存保重稳定细胞株。
5.感染悬浮细胞感染悬浮或半悬浮细胞,则需要通过平角离心转染法,即将适量的病毒液加入细胞培养皿后,封好口,放入平角离心机后,低速(200 g)离心1 h,然后放入培养箱中正常培养即可。
若由于实验条件有限,没有平角离心机,可用离心管代替,将细胞吹打吸入离心管中,进行低速离心,去掉大部分上清,然后加入适量的病毒液,室温放置15 min(尽量不要超过30 min),然后将细胞和病毒液同时吸出转入培养皿中继续病毒感染过夜后换液即可。
6.对于极难感染的细胞对于极难感染的细胞,如DC(树突状细胞)等,可采用多次感染的方法,即感染24 h 后,更换新鲜病毒进行二次感染,可显著提升感染效率。
7.传代能力较差的原代细胞对于一些传代能力较差的原代细胞,比如BMSC等,建议采用滴度更高的腺病毒进行感染。
附1:汉恒生物慢病毒质粒列表(质粒图谱请登陆汉恒官网查询)载体名称用途启动子容量抗药标记荧光标记pHBLv-CMV-MCS-EF1-RFP-T2A-puro过表达CMV 2.5kb Puromycin RFP pHBLv-CMV-MCS-EF1-ZsGreen-T2A-puro过表达CMV 2.5kb Puromycin ZsGreen pHBLV-CMV-MCS-EF1-Luc-T2A-Puro过表达CMV 2.0kb Puromycin Luc pHBLV-CMV-MCS-EF1-Puro 过表达CMV 3.0kb Puromycin 无pHBLV-CMV-MCS-T2A-Puro 过表达CMV 3.0kb Puromycin 无pHBLV-CMV-MCS-T2A-ZsGreen过表达CMV 3.0kb 无ZsGreen pCDH-CMV-MCS-EF1-RFP-T2A-Puro过表达CMV 3.0kb Puromycin RFP pCDH-CMV-MCS-EF1-GFP-T2A-Puro过表达CMV 2.5kb Puromycin GFPpHBLV-Tet-on-SV40-puroTet-on过表达TRE3G1.5kb Puromycin 无pHBLV-CMV-crRNA-EF1-GFP-T2A-puro 环状RNA过表达CMV 2.5kb 无GFPpHBLV-U6-MCS-EF1-mCherry-干扰U6 shRN Puromycin mCherryT2A-puro A pHBLV-U6-MCS-CMV-ZsGreen-PGK-Puro 干扰U6shRNAPuromycin ZsGreenpHBLV-U6-MCS-EF1-Luc-T2A-Puro 干扰U6shRNAPuromycin LucpHBLV-U6-MCS-EF1-ZsGreen-T2A-Luc 干扰U6shRNA无ZsGreen/LucpHBLV-U6-MCS-EF1-RFP-T2A-Luc 干扰U6shRNA无RFP/LucpHBLV-U6-MCS-EF1-Luc-T2A-Bla 干扰U6shRNABlasticidin LucpHBLV-U6-MCS-CMV-ZsGreen 干扰U6shRNA无ZsGreen pHBLV-U6-MCS-PGK-puro 干扰U6shRNAPuromycin 无pHBLV-EF1α-cas9-U6-gRNA-puro Cas9/gRNAEF1α/U6Cas9/gRNAPuromycin 无pHBLV-EF1α-cas9-CMV-puro cas9 EF1αCas9 Puromycin 无pHBLV-U6-gRNA-EF1a-puro gRNA U6 gRNA Puromycin 无附2:慢病毒滴度测定方法简介(表达荧光的慢病毒)Day 0:将生长状态良好的293T 细胞消化计数后稀释至1⨯105/ml, 加入96孔板,100 μl/孔(1⨯104个细胞),每种病毒需要6个孔。