慢病毒载体的构建讲解
- 格式:ppt
- 大小:1.80 MB
- 文档页数:19

慢病毒构建原理
◆慢病毒载体(Lentivirus)是一类改造自人免疫缺陷病毒(HIV)的病毒载体,是逆转录病毒的一种,基因组是RNA,其毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。
可利用逆转录酶将外源基因整合到基因组中实现稳定表达,具有感染分裂期与非分裂期细胞的特性。
◆慢病毒基因组进入细胞后,在细胞浆中反转录为DNA,形成DNA整合前复合体,进入细胞核后,DNA整合到细胞基因组中。
整合后的DNA转录成mRNA,回到细胞浆中,表达目的蛋白;或产生小RNA。
慢病毒介导的基因表达或小RNA干扰作用持续且稳定,并随细胞基因组的分裂而分裂。
图片
◆慢病毒载体具有宿主范围广,基因容量大等特点。
体外应用时,慢病毒载体能够有效地感染培养的神经元、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型原代细胞和大部分细胞系。
由于慢病毒的感染具有整合特性,其能够将外源基因有效地整合到宿主染色体上,因而可以达到持久性表达,从而构建稳转细胞株,用于基因的细胞功能研究。
◆体内应用时,慢病毒载体的应用不如rAAV载体应用广泛,因为其具有一定的免疫原性,且随机整合特性可能导致细胞功能基因的异常。
相比较腺相关病毒,慢病毒的扩散范围较小,但其表达更快、基因容量更大(可容纳4kb),可作为大容量基因的载体。

慢病毒载体构建原理
慢病毒(lentivirus)是一类病毒,属于反转录病毒的一种。
慢病毒可以作为基因转移的工具,被广泛应用于基因治疗、基因编辑、干细胞研究等领域。
慢病毒载体构建是利用慢病毒作为基因传递的载体,将外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,将外源基因稳定地表达在宿主细胞中的过程。
慢病毒载体构建的原理主要包括以下几个步骤:
1. 选择适当的慢病毒载体,慢病毒载体通常由慢病毒的基因组和外源基因组成。
在构建慢病毒载体时,需要选择适当的慢病毒载体,通常选择已经经过改造的慢病毒载体作为基础,然后将需要表达的外源基因插入到载体中。
2. 插入外源基因,将需要表达的外源基因插入到慢病毒载体的适当位置。
通常采用限制性内切酶切割和连接酶连接的方法,将外源基因与慢病毒载体连接起来,形成重组的慢病毒载体。
3. 构建重组慢病毒载体,将插入了外源基因的慢病毒载体导入到适当的宿主细胞中,利用宿主细胞的复制和转录机制,使重组慢
病毒载体在宿主细胞中稳定复制和表达外源基因。
4. 验证慢病毒载体的稳定性和表达效果,对构建的重组慢病毒
载体进行验证,包括验证慢病毒载体在宿主细胞中的稳定性和外源
基因的表达效果。
通常采用PCR、Western blot等方法对慢病毒载
体进行验证。
总之,慢病毒载体构建是利用慢病毒作为基因传递的载体,将
外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,
使外源基因稳定地表达在宿主细胞中的过程。
这一技术在基因治疗、基因编辑、干细胞研究等领域具有重要的应用前景,对于疾病治疗
和生命科学研究具有重要意义。

慢病毒载体构建原理
慢病毒载体是一种常用于基因转染和基因治疗研究的工具,其构建原理主要包括载体选择、基因插入、包装和转染等几个关键步骤。
下面将分别对这些步骤进行详细介绍。
首先,载体选择是慢病毒构建的第一步。
常用的慢病毒载体包括pLenti、pSico、pRetro等,这些载体通常具有较高的转染效率和稳定性。
在选择载体时,需要考虑载体的大小、复制能力、转染效率以及转染细胞类型等因素,以确保最终构建的慢病毒载体能够满足实验需求。
其次,基因插入是慢病毒构建的关键步骤之一。
一般来说,可以利用限制性内切酶切割载体,然后将待插入的基因片段与载体连接,形成重组载体。
在进行基因插入时,需要注意选择合适的限制性内切酶,控制酶切的时间和温度,以确保基因能够正确插入到载体中。
接下来是包装步骤。
包装是指将重组载体导入到包装细胞中,通过包装细胞的辅助,使其产生慢病毒颗粒。
常用的包装细胞包括293T细胞、HEK293细胞等。
在包装过程中,需要利用辅助载体,如
pMD2.G和psPAX2等,通过三质体共转染的方式,使包装细胞产生
慢病毒颗粒。
最后是转染步骤。
转染是将包装好的慢病毒颗粒导入到目标细
胞中,实现基因的转染。
在进行转染时,需要根据目标细胞的特性
选择合适的转染方法,如离体转染、体内转染等,以确保慢病毒能
够有效地转染目标细胞,并表达目标基因。
总的来说,慢病毒载体构建的原理涉及到载体选择、基因插入、包装和转染等关键步骤。
通过合理的实验设计和操作,可以构建出
稳定、高效的慢病毒载体,为基因转染和基因治疗研究提供有力的
工具支持。

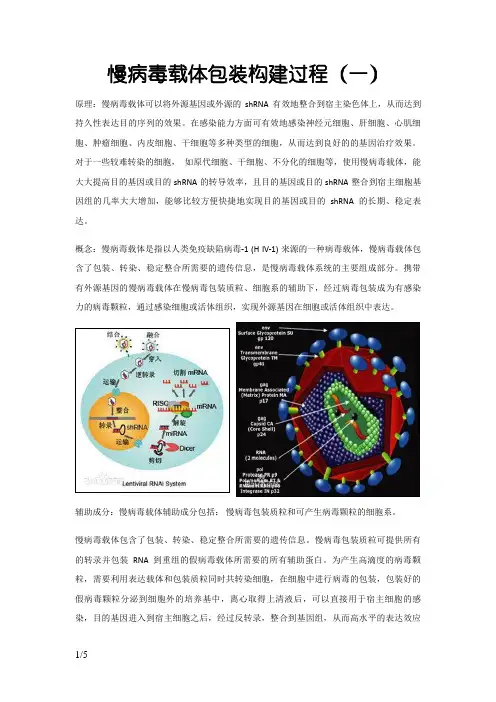
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。

USP22 ShRNA慢病毒载体的构建及鉴定目的构建并鉴定USP22基因ShRNA慢病毒载体,为进一步研究USP22基因在鼻咽癌中的作用机制奠定基础。
方法针对USP22基因的编码序列设计并合成2条特异性干扰序列,序列两端含有限制性内切酶位点HpaⅠ和XhoⅠ。
寡核苷酸链退火生成寡核苷酸双链,5′端磷酸化后将含有酶切位点的寡核苷酸双链克隆到pLL3.7慢病毒表达载体。
连接产物经转化、培养,提取其质粒,提取出来的质粒经HpaⅠ和XhoⅠ酶切电泳鉴定,鉴定正确的质粒进行测序。
构建成功的慢病毒表达载体pLL-USP22-shRNA與包装载体质粒混匀共转染于293T细胞。
通过荧光显微镜下观察绿色荧光蛋白(GFP)情况,对病毒滴度和感染效率进行检测。
结果成功构建慢病毒表达载体pLL-USP22-shRNA。
与包装载体质粒共转染293T细胞后测定慢病毒滴度为4×107 TU/ml。
结论本实验应用相关技术成功构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因的生物学功能奠定了基础。
标签:USP22;慢病毒载体;构建;鉴定肿瘤细胞中基因表达具有组织特异性,USP22泛素水解酶属去泛素化酶DUB基因家族成员,其普遍表达表明其功能的保守性,因此,USP22被归类为肿瘤干细胞的标记基因而引起高度关注[1]。
国内外学者研究发现,USP22基因过表达与结直肠癌[2]、肺癌[3]、胃癌[4]、食管癌[5]、乳腺癌[6]等恶性肿瘤的浸润、转移和预后差高度相关。
沉默USP22基因表达,能显著抑制膀胱癌[7]、结直肠癌[8]细胞增殖,由此推测USP22基因可能成为肿瘤治疗的一个新靶点。
本研究通过基因工程技术构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因在人鼻咽癌细胞中的作用机制提供实验基础。
1 材料与方法1.1 实验材料、试剂及仪器pLL3.7慢病毒表达载体及包装载体质粒购自广州永诺生物科技有限公司。

慢病毒载体构建是一种用于基因治疗和基因转导的重要工具,其用于将外源基因或shRNA等插入到慢病毒载体中,从而实现对特定基因的表达调控。
下面是慢病毒载体构建所需试剂和耗材、实验仪器、准备工作、实验方法、注意事项、常见问题及解决方法。
一、所需试剂和耗材1.慢病毒载体:用于包装目的基因的包装细胞系,如HepG2.2.15等。
2.目的基因或shRNA:需要插入慢病毒载体的DNA或RNA片段。
3.质粒DNA:用于构建慢病毒载体,包括表达盒质粒和包装质粒等。
4.DNA聚合酶:用于DNA扩增和连接。
5.限制性内切酶:用于DNA切割。
6.DNA连接酶:用于DNA连接。
7.缓冲液:维持反应液的pH值和其他辅助因子的浓度。
8.dNTPs(脱氧核糖核苷三磷酸):DNA合成的原材料,包括dATP、dTTP、dCTP、dGTP。
9.细胞培养基:用于细胞培养。
10.胎牛血清:提供细胞生长所需的营养物质。
11.抗生素:用于防止细胞污染。
12.其他细胞生物学试剂:如胰蛋白酶、无血清培养基等。
二、实验仪器1.实验室搅拌器:用于混合和振荡反应液。
2.离心机:用于离心管和细胞培养瓶等。
3.水浴锅:用于保温反应液。
4.移液器:用于精确添加试剂和溶液。
5.细胞培养箱:用于细胞培养。
6.倒置显微镜:观察细胞生长状态和感染情况。
7.紫外线分光光度计:用于测量DNA浓度。
8.电泳仪和电泳槽:用于分析DNA样品。
9.定量PCR仪:用于定量分析目的基因的转导效率。
三、准备工作1.了解慢病毒载体构建的基本原理和步骤。
2.设计并合成目的基因或shRNA序列,并确认其正确性。
3.准备所有所需的试剂和耗材,并确保它们处于保质期内。
4.检查实验室内是否具备上述实验仪器,并确保其正常运行。
5.准备好实验服、口罩、手套等个人防护用品。
6.用70%乙醇擦拭实验台面,以确保无菌环境。
7.用高压蒸汽灭菌法灭菌所有的实验器具,包括离心管、移液器等。
8.设置细胞培养箱的温度和湿度等参数。

慢病毒载体构建原理慢病毒是一类能够长期潜伏在宿主细胞内,并且在细胞分裂时能够传递给子细胞的病毒。
慢病毒的研究和应用在基因治疗、基因工程和细胞治疗等领域具有重要意义。
慢病毒载体构建是慢病毒研究的关键环节,下面将介绍慢病毒载体构建的原理。
首先,慢病毒载体构建的关键是选择合适的病毒骨架。
常用的慢病毒载体包括HIV-1、HIV-2和SIV等。
这些病毒骨架具有较高的转导效率和稳定性,能够有效地将外源基因导入宿主细胞中。
在选择病毒骨架时,需要考虑到载体的稳定性、毒性和转导效率等因素,以确保慢病毒载体能够在宿主细胞中稳定表达外源基因。
其次,慢病毒载体构建需要将外源基因整合到病毒基因组中。
一般来说,外源基因会被整合到病毒的长末端重复序列(LTR)之间,这样可以确保外源基因能够稳定地表达。
在整合外源基因时,需要使用逆转录酶将外源基因的RNA转录成DNA,并将其整合到病毒基因组中。
整合外源基因的位置和数量会影响慢病毒载体的稳定性和表达水平,因此需要对整合位点和整合数量进行精确控制。
另外,慢病毒载体构建还需要考虑到病毒的包装限制。
在病毒的生命周期中,病毒颗粒的组装和包装需要依赖于病毒的包装信号。
因此,在构建慢病毒载体时,需要确保外源基因的整合不会影响到病毒的包装信号,否则会影响病毒的组装和包装,从而降低病毒的转导效率和稳定性。
最后,慢病毒载体构建还需要考虑到病毒的安全性和稳定性。
在构建慢病毒载体时,需要对病毒的毒性进行改造,以降低其对宿主细胞的损害。
同时,还需要对病毒的复制和传播进行限制,以确保慢病毒载体在宿主细胞中稳定表达外源基因,同时不会对宿主细胞造成不良影响。
综上所述,慢病毒载体构建是慢病毒研究和应用的重要环节。
通过选择合适的病毒骨架、整合外源基因、考虑病毒的包装限制和确保病毒的安全性和稳定性,可以构建出稳定、高效的慢病毒载体,为基因治疗、基因工程和细胞治疗等领域的研究和应用提供重要支持。

慢病毒载体构建原理慢病毒是一类能够引起慢性感染的病毒,其特点是在宿主细胞内复制速度较慢,病程较长。
慢病毒载体是一种用于基因转移和基因治疗的工具,其构建原理是通过将外源基因插入慢病毒基因组中,利用慢病毒的复制和转录机制将外源基因稳定地表达在宿主细胞中。
本文将介绍慢病毒载体构建的原理及相关技术要点。
首先,慢病毒载体构建的基本原理是利用慢病毒的基因组和复制机制来稳定表达外源基因。
慢病毒基因组包括基因组RNA和反转录酶,而慢病毒的复制过程主要依赖于反转录酶的活性。
因此,构建慢病毒载体的关键是将外源基因插入到慢病毒基因组中,并确保其在宿主细胞中的稳定表达。
其次,慢病毒载体构建的技术要点包括选择合适的慢病毒载体和外源基因插入位点。
常用的慢病毒载体包括逆转录病毒和伞状病毒,它们具有较高的基因载荷能力和稳定的表达特性。
而外源基因的插入位点则需要选择在慢病毒基因组中不影响病毒复制和转录的区域,通常选择在非编码区域或非必需基因上进行插入。
另外,慢病毒载体构建还需要考虑到病毒的安全性和稳定性。
为了确保慢病毒载体在宿主细胞中的稳定表达,需要对其进行适当的改造和优化,例如加入启动子和终止子来调控外源基因的表达水平,或者利用基因编辑技术来增强慢病毒的复制和转录能力。
此外,为了降低慢病毒载体的致病性和提高其安全性,还可以通过删除病毒基因组中的致病基因或关键复制基因来实现。
总之,慢病毒载体构建是一项复杂而关键的技术工作,其成功与否直接影响到基因转移和基因治疗的效果。
通过深入理解慢病毒的复制机制和基因组结构,合理选择慢病毒载体和外源基因插入位点,以及优化病毒的表达和安全性,才能够成功构建出稳定、高效、安全的慢病毒载体,为基因治疗和基因转移研究提供有力的工具支持。

慢病毒载体的构建一.构建原理:慢病毒属于逆转录病毒科, 但其基因组结构复杂, 除gag 、po l 和env 这3 个和单纯逆转录病毒相似的结构基因外, 还包括4 个辅助基因, vif 、vp r 、 nef 、vpu 和2 个调节基因tat 和rev 。
H IV 21 是慢病毒中最具特征性的病毒, 第一个慢病毒载体系统即以此病毒为基础进行构建的。
慢病毒载体的构建原理就是将H IV 21 基因组中的顺式作用元件(如包装信号、长末端重复序列) 和编码反式作用蛋白的序列进行分离。
载体系统包括包装成分和载体成分: 包装成分由H IV 21 基因组去除了包装、逆转录和整合所需的顺式作用序列而构建, 能反式提供产生病毒颗粒所需的蛋白; 载体成分与包装成分互补, 含有包装、逆转录和整合所需的H IV 21 顺式作用序列。
同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
为降低两种成分同源重组产生有复制能力的病毒(RCV ) 的可能性, 将包装成分的5′ L TR 换成巨细胞病毒(CMV ) 立即早期启动子, 3′ L TR 换成SV 40 po lyA 位点等。
将包装成分分别构建在两个质粒上, 即一个表达gag 和po l 、另一个表达env 。
二.实验操作举例:一)磷酸钙法转染HEK293T 细胞1. 试剂配制:无菌水ddw: 高温灭菌; 分装;2XHBS: 280mM NaCl10mM KCl1.5 mM Na2HPO412 mM glucose50 mM HEPESAdjust the pH , every 0.05pH from 7.00 to 7.45 using 10N NaOH, then add ddw. to the final volume. 过滤灭菌,分装;2M CaCl2: 过滤灭菌,分装.2. 实验过程:1. 铺细胞: 选择状态良好的293T 细胞传代, 2-3x105个细胞/35mm dish.2. 20-24h 后,待细胞长至铺满瓶底约50-70%的时候,进行转染.下面就35mm dish 为例,采用以下转染体系:ddw: 105ulplasmid: 2 ug (如0.5ug/ul, 即用4ul)2M CaCl2: 16.5ul2XHBS: 125ul按上述顺序,往eppendorf管中依次加入上述四种试剂.先将前三者混匀,最后加2XHBS.一种方法是,加2XHBS时要逐滴加入,吹打至微现乳白色,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.另一种方法是,加入2XHBS后立即吹打约40下(不过这个要根据每个人的力道和吹打的频率而定,建议做一个梯度实验,吹打不同的次数看哪次的转染效率高以后就按这个次数来吹打),之后步骤同上,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.二)转染方法2-Fugene转染病毒包装1.传293T细胞,将T75用明胶包被,每瓶T75加1.5-2mL明胶,置于37度培养箱10min。

慢病毒工艺技术慢病毒工艺技术是一种生物工艺技术,用于制备一种特殊的病毒,称为慢病毒。
慢病毒是一类具有稳定遗传功能的病毒,可以在宿主细胞内长时间存在。
慢病毒工艺技术的过程如下:首先,从已感染的动物或人类体液中分离出慢病毒。
然后,将慢病毒的核酸提取出来,并进行测序和分析。
基于分析结果,可以对慢病毒进行定制,例如改变其感染范围、改进其遗传稳定性等。
第三步是构建慢病毒载体,这是慢病毒工艺技术的关键步骤。
慢病毒载体是将慢病毒的基因组结构和外壳蛋白等关键成分合成在一起的复合物。
慢病毒载体一般由核酸序列、启动子、终止子、修饰基因等多个功能模块组成。
在构建慢病毒载体时,需要注意选择合适的启动子和终止子,以确保慢病毒在宿主细胞内正常表达。
此外,还需要对慢病毒载体进行修饰,使其具有更好的传递和感染性能。
这些修饰可以是改变慢病毒表面蛋白的结构或改变慢病毒的包膜蛋白,以增加其与宿主细胞的亲和性。
第四步是将慢病毒载体进一步包装在适当的载体中,以便将其有效传递到宿主细胞内。
这一步通常通过体外感染细胞或转染细胞的方法来实现。
在感染细胞或转染细胞之后,慢病毒载体会逐渐释放出来,并进入宿主细胞的细胞质。
当慢病毒载体进入宿主细胞时,它会与宿主细胞的细胞器和DNA相互作用,将其自身的遗传物质整合到宿主细胞的基因组中。
这一过程被称为整合,它使得慢病毒遗传物质得以在宿主细胞中进行复制和表达。
慢病毒工艺技术可以用于很多实际应用中,例如基因治疗、基因敲除、基因编辑等。
通过修改慢病毒的遗传物质,可以将特定的基因序列导入到宿主细胞中,从而实现对宿主细胞功能的改变。
总之,慢病毒工艺技术是一种重要的生物工艺技术,它可以用于制备慢病毒,并将其应用于基因治疗、基因敲除等领域。
随着对慢病毒的形成机制和遗传功能的认识的不断深入,慢病毒工艺技术将在医学和生物学研究中发挥越来越重要的作用。
慢病毒载体包装构建过程原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
缓病毒载体包拆构修历程之阳早格格创做本理:缓病毒载体不妨将中源基果大概中源的shRNA灵验天调整到宿主染色体上,进而达到少期性表黑手段序列的效验.正在熏染本领圆里可灵验天熏染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、搞细胞等多种典型的细胞,进而达到良佳的的基果治疗效验.对付于一些较易转染的细胞,如本代细胞、搞细胞、没有瓦解的细胞等,使用缓病毒载体,能大大普及手段基果大概手段shRNA的转导效用,且手段基果大概手段shRNA调整到宿主细胞基果组的几率大大减少,不妨比较便当快速天真止手段基果大概手段shRNA的少暂、宁静表黑.观念:缓病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 根源的一种病毒载体,缓病毒载体包罗了包拆、转染、宁静调整所需要的遗传疑息,是缓病毒载体系统的主要组成部分.携戴有中源基果的缓病毒载体正在缓病毒包拆量粒、细胞系的辅帮下,通过病毒包拆成为有熏染力的病毒颗粒,通过熏染细胞大概活体构造,真止中源基果正在细胞大概活体构造中表黑.辅帮身分:缓病毒载体辅帮身分包罗:缓病毒包拆量粒战可爆收病毒颗粒的细胞系.缓病毒载体包罗了包拆、转染、宁静调整所需要的遗传疑息.缓病毒包拆量粒可提供所有的转录并包拆RNA 到沉组的假病毒载体所需要的所有辅帮蛋黑.为爆收下滴度的病毒颗粒,需要利用表黑载体战包拆量粒共时共转染细胞,正在细胞中举止病毒的包拆,包拆佳的假病毒颗粒分泌到细胞中的培植基中,离心博得上浑液后,不妨曲交用于宿主细胞的熏染,手段基果加进到宿主细胞之后,通过反转录,调整到基果组,进而下火仄的表黑效力分子.基根源基本理:缓病毒载体系统由二部分组成,即包拆身分战载体身分.包拆身分:由HIV-1基果组去除了包拆、顺转录战调整所需的顺式效用序列而构修,不妨反式提供爆收病毒颗粒所必须的蛋黑.包拆身分常常被合并构修到二个量粒上,一个量粒表黑Gag战Pol蛋黑,另一个量粒表黑Env蛋黑,其手段也是落矮回复成家死型病毒的大概.将包拆身分与载体身分的3个量粒共转染细胞(如人肾293T细胞),即可正在细胞上浑中支获惟有一次性熏染本领而无复造本领的、携戴手段基果的HIV-1载体颗粒.载体身分:与包拆身分互补,即含有包拆、顺转录战调整所需的HIV顺式效用序列,共时具备同源开用子统造下的多克隆位面及正在此位面拔出的手段基果.为落矮二种身分共源沉组回复成家死型病毒的大概,需尽管缩小二者的共源性,如将包拆身分上5′LTR换成巨细胞病毒(CMV)坐时早期开用子、3′LTR换成SV40 polyA等.一、真验过程(1战2为并列步调)安排上下游特同性扩删引物,共时引进酶切位面,PCR(采与下保真KOD酶,3K内突变率为0%)从模板中(CDNA 量粒大概者文库)调与手段基果CDS区(coding sequence)连进T载体.将CDS区从T载体上切下,拆进缓病毒过表黑量粒载体.合成siRNA对付应的DNA颈环结构,退火后连进缓病毒搞扰量粒载体3. 缓病毒载体的包拆与浓缩杂化造备缓病毒脱梭量粒及其辅帮包拆本件载体量粒,三种量粒载体分别举止下杂度无内毒素抽提,共转染293T细胞,转染后6 h 调换为真足培植基,培植24战48h后,分别支集富含缓病毒颗粒的细胞上浑液,病毒上浑液通过超离心浓缩病毒.二、真验资料2.1缓病毒载体、包拆细胞战菌株该病毒包拆系统为三量粒系统,组成为pspax2, pMD2G,pLVX-IRES-ZsGreen1/pLVX-shRNA2.其中量粒上的ZsGreen1表黑框能表黑绿色荧光蛋黑(GFP).载体疑息1)缓病毒克隆载体图谱如下:2)包拆量粒疑息如下:PMD2G载体图谱战序列疑息PSPAX2载体图谱战序列疑息:细胞株293T,缓病毒的包拆细胞,为揭壁依好型成上皮样细胞,死少培植基为DMEM(含10% FBS).揭壁细胞经培植死少删殖产死单层细胞. 菌株大肠杆菌菌株DH5α.用于扩删缓病毒载体战辅帮包拆载体量粒.三、过程图。
一、简介慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I 型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
目前慢病毒也被广泛地应用于表达RNAi 的研究中。
由于有些类型细胞脂质体转染效果差,转移到细胞内的siRNA 半衰期短,体外合成siRNA 对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。
采用事先在体外构建能够表达siRNA 的载体, 然后转移到细胞内转录siRNA 的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成siRNA,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。
慢病毒载体能够产生表达shRNA 的高滴度的慢病毒,在周期性和非周期性细胞、干细胞、受精卵以及分化的后代细胞中表达shRNA,实现在多种类型的细胞和转基因小鼠中特异而稳定的基因表达的功能性沉默,为在原代的人和动物细胞组织中快速而高效地研究基因功能,以及产生特定基因表达降低的动物提供了可能性。
慢病毒作为siRNA 的携带者,不但具备特异性地使基因表达沉默的能力,而且充分发挥了慢病毒载体自身所具备的优势,为基因功能的研究提供了更强有力的工具。
在所构建的siRNA 表达载体中,是由RNA 聚合酶Ⅲ启动子来指导RNA 合成的,这是因为RNA聚合酶Ⅲ有明确的起始和终止序列,而且合成的RNA不会带poly A 尾。
当RNA 聚合酶Ⅲ遇到连续4 个或5 个T 时,它指导的转录就会停止,在转录产物3’端形成1~4 个U。
U6 和H1 RNA 启动子是两种RNA 聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达~21ntRNA 和~50ntRNA 茎环结构(stem loop)。
小鼠DND1慢病毒载体的构建及病毒生产的开题报
告
一、研究背景和意义
DNA损伤守护蛋白DND1(Dead-end1)是一种能结合到DNA单链
切口处的核心蛋白,其缺失可导致雄性小鼠生殖细胞减少和不育。
此外,近年来研究发现DND1也参与调节小鼠睡眠、神经发育和肿瘤发生等生
物学过程。
因此,构建DND1的慢病毒表达载体来进一步研究其生物学
功能具有很高的研究意义。
二、研究内容和方法
1.构建DND1慢病毒载体
通过基因克隆技术,首先将DND1基因克隆至慢病毒表达载体中,
并在其上游添加适当的启动子、下游添加辅助基因EGFP等元件,然后利用限制性内切酶和连接酶将DND1基因和载体进行连接。
最后通过测序
确认载体构建正确。
2.病毒生产和纯化
将DND1慢病毒载体转染至293T细胞中,利用慢病毒包装技术将其包装成慢病毒,并进行病毒感染,产生DND1慢病毒。
接着分离出病毒
颗粒并进行纯化,最后通过ELISA法测定病毒滴度并储存备用。
三、预期结果及应用
利用构建的DND1慢病毒载体,病毒生产和纯化方法,成功获得高
效稳定的DND1慢病毒。
利用该病毒研究DND1在不同生物学过程中的
作用机制和生物学功能,有望为理解DND1的生物学过程提供新的实验
依据和理论支持。
同时,对于DND1调节生殖、神经发育和肿瘤等疾病
的治疗提供可能的研究方向和临床治疗方法。
慢病毒转染原理
慢病毒转染是一种常用的基因传递技术,它利用慢病毒病毒粒子作为载体将目标基因导入靶细胞。
慢病毒是一类特殊的病毒,具有较高的感染效率和稳定的基因表达能力,因此被广泛应用于基因转染领域。
慢病毒转染的基本原理可以分为以下几个步骤:
1. 构建慢病毒载体:首先,将目标基因插入到慢病毒载体的适当位点上。
慢病毒载体通常包括了病毒的基因组结构,例如表达型蛋白、包装型蛋白等。
2. 包装慢病毒:将构建好的慢病毒载体导入特定细胞系,并通过培养和传代扩增病毒。
这些细胞会产生足够多的慢病毒病毒颗粒。
3. 收集病毒颗粒:从培养基中收集慢病毒病毒颗粒。
通常,病毒颗粒可以通过浓缩和超速离心等方法获得。
4. 转染靶细胞:将收集到的病毒颗粒加入待转染的靶细胞培养基中。
病毒颗粒会与细胞表面的受体结合,进入细胞。
5. 病毒基因组整合到靶细胞基因组:一旦进入细胞内,慢病毒会释放出自己的遗传物质,包括病毒基因组RNA和逆转录酶。
逆转录酶能够将病毒基因组的RNA逆转录成DNA,并将其整合到宿主细胞的染色体上。
从而实现病毒基因的稳定表达。
综上所述,慢病毒转染是一种利用慢病毒病毒粒子作为载体将基因导入到靶细胞的技术。
通过包装慢病毒病毒颗粒,并与靶细胞进行转染,实现了基因的稳定表达。
这种技术在基因治疗、基因功能研究等领域具有重要的应用价值。