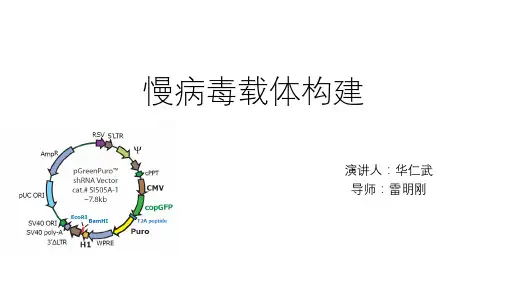
慢病毒载体的构建方法课件
- 格式:ppt
- 大小:769.50 KB
- 文档页数:23



USP22 ShRNA慢病毒载体的构建及鉴定目的构建并鉴定USP22基因ShRNA慢病毒载体,为进一步研究USP22基因在鼻咽癌中的作用机制奠定基础。
方法针对USP22基因的编码序列设计并合成2条特异性干扰序列,序列两端含有限制性内切酶位点HpaⅠ和XhoⅠ。
寡核苷酸链退火生成寡核苷酸双链,5′端磷酸化后将含有酶切位点的寡核苷酸双链克隆到pLL3.7慢病毒表达载体。
连接产物经转化、培养,提取其质粒,提取出来的质粒经HpaⅠ和XhoⅠ酶切电泳鉴定,鉴定正确的质粒进行测序。
构建成功的慢病毒表达载体pLL-USP22-shRNA與包装载体质粒混匀共转染于293T细胞。
通过荧光显微镜下观察绿色荧光蛋白(GFP)情况,对病毒滴度和感染效率进行检测。
结果成功构建慢病毒表达载体pLL-USP22-shRNA。
与包装载体质粒共转染293T细胞后测定慢病毒滴度为4×107 TU/ml。
结论本实验应用相关技术成功构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因的生物学功能奠定了基础。
标签:USP22;慢病毒载体;构建;鉴定肿瘤细胞中基因表达具有组织特异性,USP22泛素水解酶属去泛素化酶DUB基因家族成员,其普遍表达表明其功能的保守性,因此,USP22被归类为肿瘤干细胞的标记基因而引起高度关注[1]。
国内外学者研究发现,USP22基因过表达与结直肠癌[2]、肺癌[3]、胃癌[4]、食管癌[5]、乳腺癌[6]等恶性肿瘤的浸润、转移和预后差高度相关。
沉默USP22基因表达,能显著抑制膀胱癌[7]、结直肠癌[8]细胞增殖,由此推测USP22基因可能成为肿瘤治疗的一个新靶点。
本研究通过基因工程技术构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因在人鼻咽癌细胞中的作用机制提供实验基础。
1 材料与方法1.1 实验材料、试剂及仪器pLL3.7慢病毒表达载体及包装载体质粒购自广州永诺生物科技有限公司。

现今常用的制备慢病毒载体的方法为使用3或者4质粒系统转染293T细胞。
此外,也有使用其它几类慢病毒包装细胞系制备慢病毒载体。
瞬时转染制备慢病毒:细胞:慢病毒包装常用人胚肾细胞(HEK, human embryonic kidney)293T,其含有SV40病毒的大T抗原蛋白编码基因,转染效率极高。
但其贴壁性不好,所以需要使用多聚赖氨酸包被的培养皿增加其吸附性。
多聚赖氨酸培养皿可购买,也可自行制备。
转染前,细胞密度控制在40-70%比较好。
DNA:每10 cm培养皿约含5x106 293T细胞,需用30-40 ug不含内毒素的质粒进行转染。
质粒的纯度对慢病毒载体的包装效率非常关键。
不同的包膜蛋白表达载体,其使用量也不同。
转染:最经济的转染方法是磷酸钙转染法,虽然其溶液配置影响因素多,不易稳定重复得到最佳的转染结果。
其它方法有脂质体法和PEI法。
转染48-60后可以收集上清,通过低速离心,然后滤膜过滤可以去除上清中的细胞碎片。
如果使用VSV-G包膜蛋白的话,可以通过两次超速离心进行浓缩,从而最高可以获得滴度高达1011-1012 IU/ml的慢病毒载体。
之后可以将病毒载体溶解在PBS,HBSS或者DMEM中,并置于-80℃储存。
储存溶液添加血清会帮助提高病毒冻融时的存活率,然而有些病毒在侵染细胞时,血清会有干扰,所以需要依据具体病毒种类考虑是否添加血清。
病毒滴度:含VSV-G的慢病毒载体,其滴度在浓缩前一般为107 IU/ml,浓缩之后可以达到109 -107 IU/ml 。
含有荧光标记或者其它报告基因的病毒载体,可以通过梯度稀释侵染HeLa或者293,NIH3T3细胞来确定其滴度;不含报告基因的可通过测定病毒颗粒中相关病毒蛋白的活性或者含量来确定其滴度,比如使用p24gag的elisa试剂盒。
一般来说,每4-60 x 103个病毒载体含1ng p24 gag。
然而这种方法测出来的滴度并不准确,不同的病毒载体类型,不同的储存方式,都会导致p24 gag和病毒载体颗粒的比值变化较大。



慢病毒(Lentivirus)载体构步骤和方法一、简介慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
二、实验流程(大致的简单过程)慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体(自己构建)和包装质粒(购入)同时共转染细胞,在293T 细胞(购入)中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
大致的实验流程:1. 根据目的基因相关信息(序列,序列号等),构建含有外源基因或siRNA的重组载体;(即质粒构建,已构建好,质粒可以永久保存)2. 对于测序正确的重组质粒,提取和纯化高质量的不含内毒素的重组质粒;3. 使用高效重组载体和病毒包装质粒(购入)共转染293T 细胞[1],进行病毒包装和生产,收集病毒液;4. 浓缩、纯化病毒液;5. 用高质量的病毒液感染细胞(293T细胞);6. 通过定量PCR精确测定病毒滴度(高精确滴定方法)和Western 分析实验结果;7. 用高质量的病毒液感染宿主细胞;检测基因功能或者siRNA的沉默效率以及使用药物进行稳定转染细胞株的筛选,通常状况下,筛选的细胞克隆株具有长期的表达稳定性。
病毒液足够用于一般的动物活体实验。
三、重组质粒构建流程1.基因的获得:shRNA寡核苷酸序列的设计和合成(将正确序列克隆入载体中,退火形成双链,PCR扩增)2.回收A.酶切产物的胶回收:一般做50-100ul 体系,然后跑电泳回收,回收量一般为30ul。

慢病毒载体的构建一.构建原理:慢病毒属于逆转录病毒科, 但其基因组结构复杂, 除gag 、po l 和env 这3 个和单纯逆转录病毒相似的结构基因外, 还包括4 个辅助基因, vif 、vp r 、 nef 、vpu 和2 个调节基因tat 和rev 。
H IV 21 是慢病毒中最具特征性的病毒, 第一个慢病毒载体系统即以此病毒为基础进行构建的。
慢病毒载体的构建原理就是将H IV 21 基因组中的顺式作用元件(如包装信号、长末端重复序列) 和编码反式作用蛋白的序列进行分离。
载体系统包括包装成分和载体成分: 包装成分由H IV 21 基因组去除了包装、逆转录和整合所需的顺式作用序列而构建, 能反式提供产生病毒颗粒所需的蛋白; 载体成分与包装成分互补, 含有包装、逆转录和整合所需的H IV 21 顺式作用序列。
同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
为降低两种成分同源重组产生有复制能力的病毒(RCV ) 的可能性, 将包装成分的5′ L TR 换成巨细胞病毒(CMV ) 立即早期启动子, 3′ L TR 换成SV 40 po lyA 位点等。
将包装成分分别构建在两个质粒上, 即一个表达gag 和po l 、另一个表达env 。
二.实验操作举例:一)磷酸钙法转染HEK293T 细胞1. 试剂配制:无菌水ddw: 高温灭菌; 分装;2XHBS: 280mM NaCl10mM KCl1.5 mM Na2HPO412 mM glucose50 mM HEPESAdjust the pH , every 0.05pH from 7.00 to 7.45 using 10N NaOH, then add ddw. to the final volume. 过滤灭菌,分装;2M CaCl2: 过滤灭菌,分装.2. 实验过程:1. 铺细胞: 选择状态良好的293T 细胞传代, 2-3x105个细胞/35mm dish.2. 20-24h 后,待细胞长至铺满瓶底约50-70%的时候,进行转染.下面就35mm dish 为例,采用以下转染体系:ddw: 105ulplasmid: 2 ug (如0.5ug/ul, 即用4ul)2M CaCl2: 16.5ul2XHBS: 125ul按上述顺序,往eppendorf管中依次加入上述四种试剂.先将前三者混匀,最后加2XHBS.一种方法是,加2XHBS时要逐滴加入,吹打至微现乳白色,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.另一种方法是,加入2XHBS后立即吹打约40下(不过这个要根据每个人的力道和吹打的频率而定,建议做一个梯度实验,吹打不同的次数看哪次的转染效率高以后就按这个次数来吹打),之后步骤同上,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.二)转染方法2-Fugene转染病毒包装1.传293T细胞,将T75用明胶包被,每瓶T75加1.5-2mL明胶,置于37度培养箱10min。
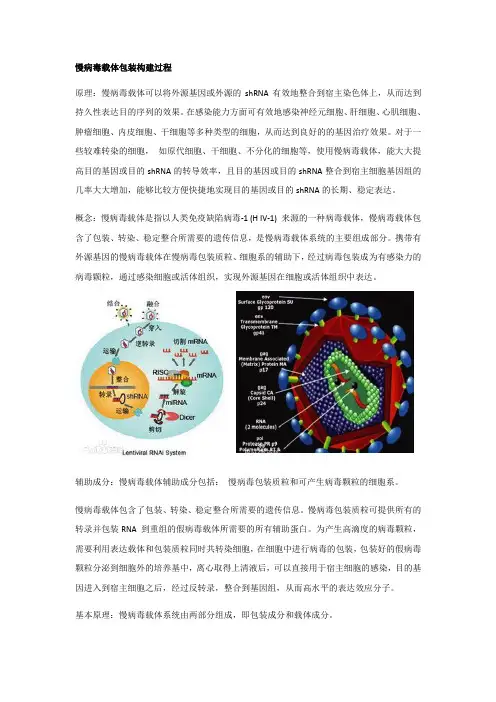
慢病毒载体包装构建过程原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。