诱变育种流程及紫外诱变育种的详细步骤
- 格式:doc
- 大小:75.00 KB
- 文档页数:5

紫外线诱变育种摘要:紫外线诱变操作简单、对实验设备要求低,是目前被广泛运用的一种物理诱变剂,人们利用紫外线诱变得到了大量的优秀菌种。
本文论述了紫外线诱变的原理、操作流程、其适用范围及研究进展。
关键词:紫外线诱变育种微生物目前微生物发酵技术被广泛的应用到许多生产行业,如生产啤酒、白酒、乳制品、酶制剂、抗生素等行业,同时微生物在解决人类的粮食能源、健康、资源和环境保护等问题中正显露出越来越重要且不可替代的独特作用[1]。
但就目前被投入工业化使用的工业菌大多在生长周期、培养基、产率等方面不能满足工业生产的需求。
理想的工业菌种必须具备: 遗传性状稳定、纯净无污染、能产生许多繁殖单位、生长迅速、能于短时间内生产所要的产物、可以长期保存等特性。
诱变是最早在抗生素上应用的一种育种技术, 它通过物理、化学、生物因素作用于抗生菌, 人为的使其遗传物质发生变异, 从中选育高产菌株[2]。
紫外线诱变属于一种物理诱变剂,它是在微生物发酵技术育种中最早使用的一种诱变方法。
紫外线诱变可以用于大量不同的菌种育种中,如芽孢杆菌、链霉菌、镰刀菌等,通过紫外线对微生物进行诱变,得到了大量比较优秀的工业菌种。
由于紫外线诱变育种简便易行、对条件和设备要求较低并能较好地提高代谢产物的产量,故在微生物育种中仍广泛应用[3]。
本文对紫外线诱变的原理、操作流程、其适用范围、研究进展进行了概述。
一、紫外线诱变的原理紫外线属于一种物理诱变剂,它能使被照射的物质的分子或原子中的内层电子提高能级。
主要生化反应:1.DNA链和氢键的断裂 2.DNA分子间(内)的交联 3.嘧啶的水合作用 4.形成胸腺嘧啶二聚体 5.造成碱基对转换 6.修复后造成差错和缺失。
紫外线诱变处理的有效波长为200 - 300×10nm,最适为254nm(此为核酸的吸收高峰)。
DNA和 RNA的嘌呤和嘧啶吸收紫外光后,DNA 分子形成嘧啶二聚体,即两个相邻的嘧啶共价连接,二聚体出现会减弱双键间氢键的作用[4],并引起双链结构扭曲变形,阻碍碱基间的正常配对,从而有可能引起突变或死亡.另外二聚体的形成,会妨碍双链的解开,因而影响DNA 的复制和转录.总之紫外辐射可以引起碱基转换、颠换、移码突变或缺失,即是所谓的诱变[5],从而引起上述的生化反应。

一、实验目的1. 掌握紫外诱变技术的原理和方法。
2. 了解紫外诱变在微生物育种中的应用。
3. 通过实验,筛选出具有较高产酶能力的突变菌株。
二、实验原理紫外诱变技术是利用紫外线照射微生物,使微生物DNA发生突变,从而获得具有优良性状的菌株。
紫外线照射能导致DNA分子中碱基对的改变、缺失或插入,进而影响基因的表达,产生新的遗传性状。
三、实验材料1. 菌种:产淀粉酶枯草芽孢杆菌。
2. 器材:紫外线照射装置、超净工作台、电磁力搅拌器、低速离心机、培养皿、涂布器、10mL离心管、(1、5、10mL)吸管、250mL三角瓶、恒温摇床、培养箱、直尺、棉签、橡皮手套、洗耳球。
3. 培养基和试剂:无菌水、75%酒精、0.5%碘液、碘片1g、碘化钾2g、蒸馏水200mL、可溶性淀粉2g、牛肉膏1g。
四、实验方法1. 菌种活化:将产淀粉酶枯草芽孢杆菌接种于牛肉膏蛋白胨培养基中,37℃培养24小时,得到活化菌种。
2. 菌悬液制备:将活化菌种接种于牛肉膏蛋白胨液体培养基中,37℃、180r/min 振荡培养3小时,制成菌悬液。
3. 紫外诱变:将菌悬液置于紫外照射装置下,距离20~30cm,照射时间分别为1、2、3分钟,设置对照组(未照射)。
4. 细菌复苏:将照射后的菌悬液涂布于牛肉膏蛋白胨培养基平板上,37℃培养24小时,观察菌落生长情况。
5. 初筛:挑选生长速度较快、菌落形态异常的菌落,进行进一步的淀粉酶活性测定。
6. 淀粉酶活性测定:将挑选的突变菌株接种于可溶性淀粉培养基中,37℃培养24小时,用碘液检测淀粉酶活性。
7. 验证与保存:对具有较高淀粉酶活性的突变菌株进行验证,并保存于甘油管中。
五、实验结果1. 紫外线照射时间对菌落生长的影响:照射1分钟时,菌落生长速度明显降低;照射2分钟时,菌落生长速度有所下降;照射3分钟时,菌落生长速度明显下降。
2. 淀粉酶活性测定结果:经过筛选,发现突变菌株A的淀粉酶活性最高,为对照组的1.5倍。

微生物诱变育种的基本过程
一、筛选目的菌株
在开始微生物诱变育种之前,首先要确定育种的目标,并从中筛选出具有潜在优良性状的目的菌株。
这一步通常需要利用各种生理生化实验和分子生物学技术,对大量菌株进行初步的筛选和鉴定。
二、诱变处理
在确定了目的菌株之后,接下来需要进行诱变处理。
诱变处理通常包括化学诱变和物理诱变两种方式。
化学诱变使用化学诱变剂处理菌株,而物理诱变则利用物理因素(如紫外线、X射线、中子等)处理菌株。
这些诱变因素可以引起菌株基因的突变,进而产生新的性状。
三、突变体的筛选
经过诱变处理后,大量菌株中会存在各种突变体。
为了获得具有优良性状的目标突变体,需要进行筛选。
这一步通常采用各种筛选方法,如单菌落挑取法、稀释涂布平板法等,将突变体从大量菌株中分离出来。
同时,需要通过各种生理生化实验和分子生物学技术,对突变体的性状进行鉴定和筛选。
四、遗传稳定性检测
在筛选出目标突变体后,需要对其遗传稳定性进行检测。
遗传稳定性是指突变体在繁殖过程中,是否能够保持其优良性状的稳定性。
这一步通常采用连续繁殖法和稳定性测定法等方法进行检测,以保证突变体的优良性状能够在后代中得到保留。
五、生产能力测定
最后一步是测定突变体的生产能力。
生产能力是指突变体在实际生产过程中,能否产生足够的产物并保持稳定的产量。
这一步通常采用发酵实验和产物分离纯化等方法进行测定,以保证突变体在实际生产中具有实用价值。
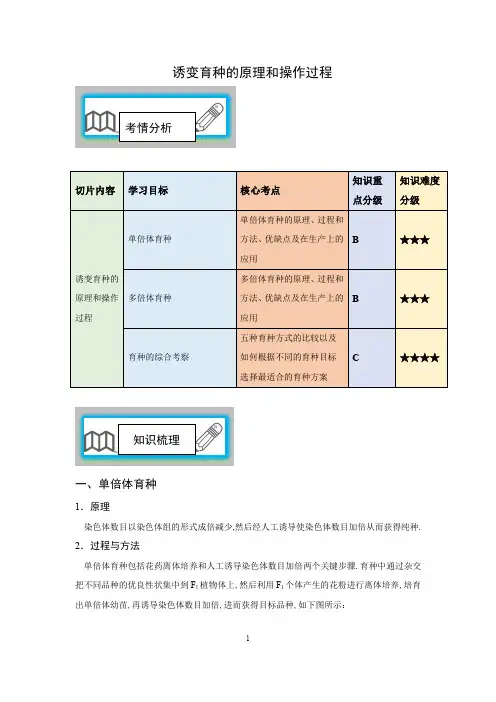
诱变育种的原理和操作过程考情分析知识梳理一、单倍体育种1.原理染色体数目以染色体组的形式成倍减少,然后经人工诱导使染色体数目加倍从而获得纯种. 2.过程与方法单倍体育种包括花药离体培养和人工诱导染色体数目加倍两个关键步骤.育种中通过杂交把不同品种的优良性状集中到F1植物体上,然后利用F1个体产生的花粉进行离体培养,培育出单倍体幼苗,再诱导染色体数目加倍,进而获得目标品种,如下图所示:3.优点与不足(1)优点单倍体育种和杂交育种相比而言,能明显缩短育种年限,一般只需要2年时间,便可以获得纯合新品种.(2)不足技术性较强,并且必须和杂交技术以及诱导染色体加倍技术结合使用.4.实例现有高杆抗病小麦DDTT、矮杆易感病小麦ddtt,欲培育出矮杆抗病小麦ddTT,育种方案如下图:二、多倍体育种1.原理染色体数目以染色体组的形式成倍增加.2.过程与方法多倍体育种目前最常用而且最有效的方法是利用秋水仙素直接处理萌发的种子或幼苗,已获得优良性状的多倍体植株.三倍体无籽西瓜的培育就是一个典型案例,如下图所示:3.优点与不足(1)优点经多倍体育种获得的植株和二倍体相比,茎秆粗壮,叶片、果实和种子都较大,糖类和蛋白质含量都有所增加,有些植物的抗寒性等抗逆能力增强.(2)不足多倍体育种适用于植物,在动物方面难以开展,且多倍体植物往往发育迟缓,结实率低. 三、育种的综合考察1.列表比较几种常见生物育种方式2.有关育种的两点方案(1)根据不同育种目标选择不同育种方案(2)育种技术中的“四最”和“-明显”①最简便的育种技术——杂交育种.②最具预见性的育种技术——转基因技术或细胞工程育种.③最盲目的育种——诱变育种.④最能提高产量的育种——多倍体育种.⑤可明显缩短育种年限的育种——单倍体育种.3.几种育种方式的注意点(1)单倍体育种与多倍体育种的操作对象不同.单倍体育种操作的对象是单倍体幼苗,多倍体育种操作的对象是正常萌发的种子或幼苗.(2)诱变育种:多用于植物和微生物,一般不用于动物的育种.(3)杂交育种:不一定需要连续自交.若选育显性优良纯种,需要连续自交筛选,直至性状不再发生分离;若选育隐性优良纯种,则只要出现该性状个体即可.【易错提醒】(1)单倍体并不一定是一倍体;(2)花药离体培养获得单倍体,虽然是植物组织培养的一种形式,但花粉粒是减数分裂产生的,因此属于有性生殖;(3)单倍体育种获得的一般是纯合子,但当多倍体的花粉经离体培养,秋水仙素处理后,可能产生杂合子;(4)单倍体绝大多数都是不育的,但当细胞内具有相同的染色体组,同源染色体之间可以联会,就是可育的;(4)某些动物虽然体内只有一个染色体组,但也是可育的,如雄峰、雄蚁,孤雌生殖的蚜虫,经特殊减数分裂产生正常的配子,也是可育的;(5)无籽西瓜培育过程中,获得三倍体种子时,一定是四倍体做母本,二倍体做父本,而不能颠倒过来.趣味生物香蕉天生就无籽吗香蕉不像苹果、桔子,果实里看不到一粒的种子,人们就以为香蕉根本就没有种子,其实不是这样的。

实验三紫外线的诱变育种(学时:4)一、目的要求通过实验,观察紫外线对枯草芽孢杆菌的诱变效应,并学习物理因素诱变育种的方法。
二、基本原理紫外线对微生物有诱变作用,主要引起的是DNA分子结构发生改变(同链DNA的相邻嘧啶间形成共价结合的胸腺嘧啶二聚体),从而引起菌体遗传性变异。
三、菌种与仪器菌种:枯草芽孢杆菌;仪器:血球计数板,显微镜,紫外线灯(15W),电磁搅拌器,离心机四、操作步骤1.菌悬液的制备A、取培养48小时的枯草芽孢杆菌的斜面4—5支,用无菌生理盐水将菌苔洗下,并倒入盛有玻璃珠的小三角烧瓶中,振荡30分钟,以打碎菌块。
B、将上述菌液离心(3000r/min,离心15分钟),弃去上清液,将菌体用无菌生理盐水洗涤2—3次,最后制成菌悬液。
C、用显微镜直接计数法计数,调整细胞浓度为每毫升108个。
2.平板制作将淀粉琼脂培养基溶化后,冷至55℃左右时倒平板,凝固后待用。
3.紫外线处理A、将紫外线灯开关打开预热约20分钟。
B、取直径9cm无菌平皿2套,分别加入上述菌悬液5ml,并放入无菌搅拌棒于平皿中。
C、将盛有菌悬液的2平皿置于磁力搅拌器上,在距离为30cm,功率为15W的紫外线灯下分别搅拌照射1分钟及3分钟。
4.稀释在红灯下,将上述经诱变处理的菌悬液以10倍稀释法稀释成10-1-10-6(具体可按估计的存活率进行稀释)。
5.涂平板取10-4、10-5、10-6三个稀释度涂平板,每个稀释度涂平板3只,每只平板加稀释菌液0.1ml,用无菌玻璃刮棒涂匀。
以同样操作,取未经紫外线处理的菌稀释液涂平板作对照。
6.培养将上述涂匀的平板,用黑布(或黑纸)包好,置37℃培养48小时。
注意每个平皿背面要标明处理时间和稀释度。
7.计数将培养48小时后的平板取出进行细菌计数,根据对照平板上菌落数,计算出每毫升菌液中的活菌数。
同样计算出紫外线处理1分钟、3分钟后的存活细胞数及其致死率。
8.观察诱变效应将细胞计数后的平板,分别向菌落数在5—6个左右的平板内加碘液数滴,在菌落周围将出现透明圈。

食品微生物诱变育种的步骤引言:食品微生物诱变育种是一种利用诱变技术改良食品微生物的方法,通过诱发微生物的遗传变异,以获得具有理想特性的菌株。
本文将介绍食品微生物诱变育种的步骤,包括诱变剂的选择、诱变条件的优化、筛选和鉴定等。
一、诱变剂的选择诱变剂是诱发微生物遗传变异的关键因素,不同的诱变剂对微生物的诱变效果有所差异。
在选择诱变剂时,需要考虑到其毒性、稳定性和诱变效果等因素。
常用的诱变剂包括化学诱变剂(如亚硝酸盐、亚硝酸钠)、物理诱变剂(如紫外线、γ射线)和基因工程诱变剂(如转座子)等。
根据具体的需求和实验条件,选择适合的诱变剂进行实验。
二、诱变条件的优化诱变条件的优化对于提高诱变效果至关重要。
诱变条件包括诱变剂的浓度、处理时间和处理温度等。
在进行诱变实验时,需要通过一系列的试验确定最佳的诱变条件。
例如,可以通过改变诱变剂的浓度和处理时间,观察微生物的生长情况和遗传变异率,以确定最佳的诱变条件。
三、诱变实验的进行在确定了诱变剂和诱变条件后,可以进行诱变实验。
诱变实验的步骤包括:将待诱变的微生物培养物接种到含有诱变剂的培养基中,经过一定的处理时间后,将处理后的培养物进行稀释和分装,接种到含有适宜营养物和选择压力的培养基中,培养一定时间后进行筛选。
四、筛选和鉴定筛选是诱变育种中非常重要的一步,通过筛选可以从大量的诱变菌株中筛选出具有理想特性的菌株。
筛选的方法多种多样,可以根据具体的需求选择合适的筛选方法。
常用的筛选方法包括抗性筛选、代谢产物筛选和遗传标记筛选等。
通过筛选后,还需要对筛选出的菌株进行鉴定,确认其遗传变异的性质和稳定性。
结论:食品微生物诱变育种是一种有效的改良微生物的方法,通过诱发微生物的遗传变异,可以获得具有理想特性的菌株。
在进行食品微生物诱变育种时,需要选择适合的诱变剂,优化诱变条件,进行诱变实验,并通过筛选和鉴定确认诱变菌株的特性。
这些步骤的合理操作和科学设计,将为食品微生物的改良和应用提供有力支持。

诱变育种的过程诱变育种是一种利用诱变剂诱发植物基因突变,从而获得具有新性状或改良性状的植物品种的育种方法。
下面是诱变育种的详细过程:1.诱变剂选择:-选择适当的诱变剂,如化学诱变剂(如亚硝基尿、乙烯甲烯磺酰胺等)或物理诱变剂(如辐射,如γ射线、X射线等)。
-选择诱变剂的浓度或剂量,根据目标物种的敏感性和诱变效果进行调整。
2.诱变处理:-将目标植物种子或组织培养物暴露在诱变剂中,以诱发基因突变。
可以通过浸泡、喷雾、渗透、辐射等方式进行处理。
-控制诱变剂的浓度和处理时间,以避免过度损伤或死亡。
3.诱变后代选择:-从诱变处理的植物中收集诱变后代(如种子、离体培养物等)。
-对诱变后代进行初步筛选,筛选出具有感兴趣性状改变的个体。
例如,根据植株形态、生长速度、花器官特征等进行观察和评估。
4.重复诱变和筛选:-重复进行诱变和筛选过程,以获得更多具有目标性状改变的植株。
-可以采用不同的诱变剂浓度、处理时间、处理方法等来增加变异性和选择范围。
5.性状评估和选择:-对诱变后代进行详细的性状评估,以确定具有理想性状的个体。
-可以通过生理性状分析、分子标记检测、遗传分析等方法来评估目标性状的改变和遗传稳定性。
6.繁殖和稳定性选育:-选择具有目标性状稳定遗传的个体进行繁殖,以确保性状的传承。
-通过连续的自交或杂交选择等育种方法,稳定和提高目标性状的表达。
7.品种鉴定和推广:-对最有潜力的诱变品系进行品种鉴定,包括品质、抗病虫害性、适应性等方面的评估。
-将经过鉴定的优良诱变品系进行推广和应用,例如进行大田试验、推广种植或商业化生产。
重要提示:诱变育种过程中需要谨慎选择诱变剂和适当的处理条件,同时进行详细的性状评估和遗传分析,以确保获得稳定和优良的诱变品种。
此外,诱变育种也需要符合法律法规和伦理要求。

实验三紫外线的诱变育种(学时:4)一、目的要求通过实验,观察紫外线对枯草芽孢杆菌的诱变效应,并学习物理因素诱变育种的方法。
二、基本原理紫外线对微生物有诱变作用,主要引起的是DNA分子结构发生改变(同链DNA的相邻嘧啶间形成共价结合的胸腺嘧啶二聚体),从而引起菌体遗传性变异。
三、菌种与仪器菌种:枯草芽孢杆菌;仪器:血球计数板,显微镜,紫外线灯(15W),电磁搅拌器,离心机四、操作步骤1.菌悬液的制备A、取培养48小时的枯草芽孢杆菌的斜面4—5支,用无菌生理盐水将菌苔洗下,并倒入盛有玻璃珠的小三角烧瓶中,振荡30分钟,以打碎菌块。
B、将上述菌液离心(3000r/min,离心15分钟),弃去上清液,将菌体用无菌生理盐水洗涤2—3次,最后制成菌悬液。
C、用显微镜直接计数法计数,调整细胞浓度为每毫升108个。
2.平板制作将淀粉琼脂培养基溶化后,冷至55℃左右时倒平板,凝固后待用。
3.紫外线处理A、将紫外线灯开关打开预热约20分钟。
B、取直径9cm无菌平皿2套,分别加入上述菌悬液5ml,并放入无菌搅拌棒于平皿中。
C、将盛有菌悬液的2平皿置于磁力搅拌器上,在距离为30cm,功率为15W的紫外线灯下分别搅拌照射1分钟及3分钟。
4.稀释在红灯下,将上述经诱变处理的菌悬液以10倍稀释法稀释成10-1-10-6(具体可按估计的存活率进行稀释)。
5.涂平板取10-4、10-5、10-6三个稀释度涂平板,每个稀释度涂平板3只,每只平板加稀释菌液0.1ml,用无菌玻璃刮棒涂匀。
以同样操作,取未经紫外线处理的菌稀释液涂平板作对照。
6.培养将上述涂匀的平板,用黑布(或黑纸)包好,置37℃培养48小时。
注意每个平皿背面要标明处理时间和稀释度。
7.计数将培养48小时后的平板取出进行细菌计数,根据对照平板上菌落数,计算出每毫升菌液中的活菌数。
同样计算出紫外线处理1分钟、3分钟后的存活细胞数及其致死率。
8.观察诱变效应将细胞计数后的平板,分别向菌落数在5—6个左右的平板内加碘液数滴,在菌落周围将出现透明圈。

简述诱变育种的典型流程及步骤一、诱变育种的概述诱变育种是通过人为手段诱导植物基因发生突变,进而筛选出具有理想性状的新品种。
它可以通过物理、化学或生物学方法对植物进行诱变,使植物基因发生突变,产生新的遗传变异。
通过筛选和选择,最终获得具有经济和农艺价值的新品种。
二、诱变育种的典型流程及步骤1. 选择育种材料:选择适合诱变的育种材料是诱变育种的第一步。
通常选择普通品种、自交系或近缘种作为育种材料,以确保诱变后能够产生有用的突变体。
2. 诱变处理:诱变处理是诱变育种的核心步骤。
诱变处理可以采用物理、化学或生物学方法进行。
常见的物理方法包括辐射诱变和离子束诱变,化学方法包括化学诱变剂处理,生物学方法包括基因工程技术等。
3. 突变体筛选:在诱变处理后,需要对诱变体进行筛选,以筛选出具有目标性状的突变体。
通常可以通过形态学、生理学、生物化学等多种方法进行筛选。
例如,通过观察植株生长状况、花期、产量等形态指标,或通过测定植株的生理指标如抗病性、耐逆性等,以及通过分析植物的化学成分等来筛选突变体。
4. 突变体鉴定:在突变体筛选后,需要对突变体进行鉴定。
鉴定的目的是确定突变体的突变类型和突变位点。
常用的鉴定方法包括遗传分析、分子标记和基因组测序等。
通过鉴定突变体的突变类型和突变位点,可以更好地理解突变体的性状变化,为后续的育种工作提供依据。
5. 基因型固定:在鉴定突变体后,需要进行基因型固定。
基因型固定是指将突变体与优良品种进行杂交,通过连续的自交和选择,逐步固定突变体的基因型,同时消除不良性状和杂质基因。
这一步骤是为了确保突变体的稳定性和纯度,为后续的品种选育奠定基础。
6. 品种选育:在基因型固定后,可以进行品种选育。
根据突变体的优良性状,结合农业生产的需求,选择具有经济和农艺价值的突变体进行品种选育。
通过连续的选育和筛选,最终可以获得具有理想性状的新品种。
7. 品种测试:在品种选育后,需要对新品种进行测试。
测试的目的是评估新品种的农艺性状、适应性、产量等。

紫外线诱变育种高产纤维素菌实验方案诱变方案:纤维素酶活力较高菌株→紫外线诱变→初筛→复筛→稳定性试验.实验目的:对有一定能力产纤维素酶的菌种进行紫外线诱变,诱变出高产纤维素酶的菌种。
实验原理:紫外线诱变处理的有效波长为200~300×10nm,最适为254nm(此为核酸的吸收高峰)。
DNA和RNA的嘌呤和嘧啶吸收紫外光后,DNA分子形成嘧啶二聚体,即两个相邻的嘧啶共价连接,二聚体出现会减弱双键间氢键的作用,并引起双链结构扭曲变形,阻碍碱基间的正常配对,从而有可能引起突变或死亡.另外二聚体的形成,会妨碍双链的解开,因而影响DNA的复制和转录.总之紫外辐射可以引起碱基转换、颠换、移码突变或缺失,即是所谓的诱变。
材料和器皿:(1)菌种:木霉单孢子(2)培养基:牛肉膏蛋白胨培养基(液体和固体),生理盐水。
(3)器皿:无菌培养皿,无菌试管,无菌移液管(5ml,1ml),150ml三角瓶(内装有玻璃珠),无菌离心管等。
(4)仪器:紫外灯(装在无菌操作箱内),磁力搅拌器等。
实验步骤:紫外线诱变育种单孢子悬液制备:用生理盐水洗下出发菌株的斜面孢子摇床上震荡分散30min,4 层无菌擦镜纸过滤,制备单孢子悬液。
稀释对照菌液(未照射菌液)将未经照射的菌液稀释成10-1~10-6,然后从10-5,10-6两管中各吸取0.1ml菌液于牛肉膏蛋白胨平板上(每个稀释度做三个皿),用无菌涂布棒土布均匀后,倒置于32度条件下培养过夜,第二天取出,计算菌落数,将记得的结果记录于表格中。
UV 诱变:取单孢子悬液5mL 于直径9cm 的培养皿内,同时放入无菌搅拌子,在磁力搅拌器.....的搅拌下置于15W 紫外线灭菌灯下30cm 处分别处理0s.30s、1min、2min、3min、5min、7min、9min、11min。
在红灯下稀释适当倍数,0.1mL 涂PDA 平板,30℃避光培养过夜。
诱变致死率检测:分别取等量的不同诱变时间的菌液和未诱变菌液涂布于PDA 平板,30℃培养72h。

简述诱变育种的基本流程
诱变育种是指利用诱变剂将植物的DNA或RNA转化为突变体,然后通过基因编辑技术将这些突变体转化为育种目标。
以下是诱变育种的基本流程:
1. 诱变剂选择:选择适当的诱变剂,如放射性同位素、化学物质或病毒,以确保诱变剂能够引起植物的基因突变。
2. 诱变处理:将植物或其他生物暴露在适当的诱变剂中,以诱导基因突变。
通常使用化学诱变剂、辐射诱变剂或病毒来诱导突变。
3. 检测和分析:检测诱变剂引起的突变,并对突变进行分类和评估。
可以使用生物分析技术,如PCR、测序和转录组技术,来分析突变基因和突变类型。
4. 突变基因编辑:利用基因编辑技术,如CRISPR/Cas9,将突变基因转化为
育种目标。
这些技术可以通过精确定位和修改突变基因来创造新的品种。
5. 筛选和育种:通过比较诱变育种目标品种与野生型品种,选择诱变育种目标品种并进行育种。
这可以通过自然选择、遗传变异和人工选择等方法来实现。
诱变育种是一种高效的方式,可以创造新的品种,特别是对于那些无法通过自然选择和遗传变异形成新物种的植物品种。
但是,诱变育种也存在一些潜在的风险,如诱变剂的安全性和环境污染。
因此,在进行诱变育种时,必须小心谨慎,并遵循相关的安全性和环境保护规定。
微生物与酿造工业、食品工业、生物制品工业等的关系非常密切,其菌株的优良与否直接关系到多种工业产品的好坏,甚至影响人们的日常生活质量,所以培育优质、高产的微生物菌株十分必要。
微生物育种的目的就是要把生物合成的代谢途径朝人们所希望的方向加以引导,或者促使细胞内发生基因的重新组合优化遗传性状,人为地使某些代谢产物过量积累,获得所需要的高产、优质和低耗的菌种。
作为途径之一的诱变育种一直被广泛应用。
诱变育种的主要步骤:出发菌株留档资料↑原种(出发菌株)→分离纯化、筛选→斜面→同步培养→离心洗涤→玻璃珠震荡打散→过滤→单细胞或孢子悬浮液→诱变处理→后培养→平板分离→斜面→初筛→复筛→分离、筛选→保藏及扩大试验。
例如,抗霉素生产菌的诱变育种抗霉素产生菌Streptomyces sp.FIM一041 14,经紫外-氯化锂复合处理,筛选得到一株高产菌No.1-095,其抗霉素摇瓶发酵效价为170mg/L,且遗传稳定性良好。
经发酵过程工艺优化,菌株No.1—095摇瓶发酵效价i盘220mg/L,较出发菌株FIM-04114提高T63.O%。
在50L自动发酵罐上发酵,抗霉素效价蔓J206mg/L。
A mutant strain No.1—095 with higher potency(170mg/L)and better hereditary stability was obtained by combination treatment of UV andLiCl from antimycin producing strain FIM-04114.After thefermentation conditions of strain No.1—095 in shake flask were optimized,the antimycin yield of the strain was 220mg/L,which was 63.0%higher than the original strain FIM-04114.The potency ofstrain No.1—095 was 206mg/L in a 50L bioreactor.抗霉素(antimycin)是一族多组分混合物,具有相同的九元环双内酯母核,但侧链结构不同,A3是最主要的组分。
微生物紫外线诱变育种的一般流程微生物紫外线诱变育种啊,这可挺有趣的呢。
一、出发菌株的选择。
这就像是选种子一样,咱们得挑个好的出发菌株。
这个菌株得是那种本身就有点潜力的,比如说它在某些方面已经表现得还不错了,像是生长速度还行啦,或者对环境有一定的适应能力之类的。
要是一开始就选个病恹恹的菌株,那后面再怎么诱变可能都白搭。
就好比你要培养一个运动员,你得先找个身体素质有点基础的人,不能找个整天生病的呀。
二、菌悬液的制备。
把选好的菌株弄成菌悬液,这就像是把种子泡在水里,让它们能均匀地分布。
这个菌悬液的浓度可不能太浓也不能太稀哦。
太浓了呢,紫外线可能照不均匀,就像一群人挤在一起,有些地方晒得到太阳,有些地方晒不到。
太稀了呢,那最后得到的突变体可能就太少了。
一般来说,咱们得根据经验或者查一些资料来确定这个合适的浓度。
在制备菌悬液的时候,还得注意保持菌株的活性,就像照顾小宝贝一样,环境得适宜,营养也不能少,可不能让它们在这个时候就挂掉了。
三、紫外线照射。
这可是关键的一步呢。
就像是给这些微生物来一场刺激的阳光浴,不过这个阳光可是紫外线。
咱们得把菌悬液放在紫外线灯下照射。
这个照射的时间和距离都很有讲究哦。
照射时间太短,可能诱变效果不明显,微生物还是老样子。
照射时间太长呢,那微生物可能就被紫外线给“晒死”啦,就像人在太阳下晒太久会中暑一样。
距离也很重要,离得太近,紫外线强度太大,离得太远,强度又不够。
而且在照射的时候啊,最好能让菌悬液不断地晃动,这样能保证每个微生物都能比较均匀地接受紫外线的洗礼。
四、后培养。
经过紫外线照射后的微生物可都是“受过伤”的小宝贝啦。
这时候要把它们放到合适的培养基里进行后培养。
这个培养基就像是一个温馨的小窝,给它们提供营养,让它们慢慢恢复,并且在这个过程中表现出那些因为诱变而产生的新特性。
在这个阶段,咱们得密切观察微生物的生长情况,看看有没有出现一些特别的变化,比如说生长速度突然变快了,或者对某种物质的代谢能力变强了之类的。
紫外线育种的主要步骤
紫外线育种的主要步骤有:
1. 紫外线照射:将实验材料置于紫外线照射容器中,在规定的时间(如60 min)内充分照射紫外线;
2. 模拟繁殖:将紫外线照射过的实验材料进行模拟繁殖,通过查验和评价,筛选出抗紫外线突变性较强的品种和突变体;
3. 重新繁殖:利用抗紫外线突变性比较强的品种和突变体重新进行大规模的繁殖,逐一测试抗性以及质量指标,选出抗紫外线育种成功后的新品种;
4. 全程检验:对育种成功的新品种和突变体的性状特征、养分含量以及抗病、抗虫等方面进行全面检验;
5. 后续研究:进行更深入的后续研究,为新品种的正式推广和应用奠定基础。
诱变育种流程及紫外诱变育
种的详细步骤
-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
诱变育种的一般步骤:
1.首先是天然菌种的选育:
调查研究及查阅充分的资料
↓
设计实验方案
↓确定采集样品的生态环境
采样
↓确定特定的增殖条件
增殖培养
确定特殊的选择培养基及可能的
定性或半定量快速检出法
平板分离
↓
原种斜面
↓确定发酵培养基础条件
筛选
↓
初筛(1株1瓶)
↓
复筛(1株3~5瓶)
↓结合初步工艺条件摸索
再复筛(1株3~5瓶)
↓
3~5株
↓
单株纯种分离
生产性能试验
→毒性试验
菌种鉴定
2.诱变菌种:
出发菌株----菌种纯化(出发菌株性能测定)----制备斜面孢子----制备单孢子悬液(悬液进行活菌计数)----诱变剂处理(存活菌数的测定并计算存活率)----平板分离(测定变异率)----挑取变异菌落并移植至斜面上----初筛(初筛数据分析,生产性状的粗测)----斜面传代----复筛(复筛数据分析,精确测定生产性状)----变异菌株(菌株参数分析)----小型或中型投产试验----大型投产试验。
诱变育种应把握的主要原则有以下几点:1)选择简便有效的诱变剂。
在选用理化因素作诱变剂时,在同样效果下,应选用最简便的因素;在同样简便的条件下,应选用最高效的因素。
2)挑选优良的出发菌株。
最好采用生产上已发生自变的菌株,选用对诱变剂敏感的菌株,选取有利于进一步研究或应用性状的菌株。
4)处理单细胞或孢子悬液。
单细胞悬液应均匀而分散,孢子、芽孢等应稍加萌发。
5)选用合适的诱变剂量。
一般正变较多出现在低剂量中,负变较多地出现在高剂量中。
6)选用高效的筛选方法。
紫外线诱变育种:
紫外线诱变一般采用15W紫外线杀菌灯,波长为253-
265nm.灯与处理物的距离为30cm,照射时间依菌种而异,一般为几秒至几十分钟。
一般我们常以细胞的死亡率表示,希望照射的剂量死亡率控制在70~80%为宜。
被照射的菌悬液细胞数,细菌为106个/ml左右,霉菌孢子和酵母细胞为106~107个 /ml。
由于紫外线穿透力不强,要求照射液不
要太深,约0.5~1.0cm厚,同时要用电磁搅拌器或手工进行搅拌,使照射均匀。
由于紫外线照射后有光复活效应,所以照射时和照射后的处理应在红灯下进行。
具体操作步骤
1.将细菌培养液以3000r/min离心5min,倾去上清液,将菌体打散加入无菌生理盐水再离心洗涤。
2.将菌悬液放入一已灭菌的,装有玻璃珠的三角瓶内用手摇动,以打散菌体。
将菌液倒入有定性滤纸的漏斗内过滤,单细胞滤液装入试管内,一般处于浑浊态的细胞液含细胞数可达108个/ml 左右,作为待处理菌悬液。
3.取2~4mL制备的菌液加到直径9cm培养皿内,放入一无菌磁力搅拌子,然后置磁力搅拌器上、15W紫外线下30cm处。
在正式照射前,应先开紫外线10min,让紫外灯预热,然后开启皿盖正式在搅拌下照射10~50s。
操作均应在红灯下进行,或用黑纸包住,避免白炽光。
4.取未照射的制备菌液和照射菌液各0.5ml进行稀释分离,计数活菌细胞数。
5.取照射菌液2ml于液体培养基中(300ml三角瓶内装30ml培养液),120r/min振荡培养4~6h。
6.取中间培养液稀释分离、培养。
7.挑取菌落进行筛选。