免疫比浊法检测免疫球蛋白
- 格式:docx
- 大小:52.96 KB
- 文档页数:4




医疗器械产品技术要求编号:免疫球蛋白(IgG、IgA、IgM)检测试剂盒(免疫比浊法)1.产品型号/规格及其划分说明序号规格12×200Tests2R1:2×80ml、R2:2×20ml3R1:2×60ml、R2:2×15ml4R1:2×40ml、R2:2×10ml5R1:2×50ml、R2:1×25ml6校准品(选配):1×1ml2.性能指标2.1外观试剂R1溶液应无色、无颗粒、无杂质、无沉淀和悬浮物;试剂R2溶液应呈淡黄色、无颗粒、无杂质、无沉淀和悬浮物;校准品为米白色至浅黄色冻干粉末。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度应为≤0.4,IgA、用蒸馏水作为样品加入试剂测试,IgG试剂空白吸光度A570nm应为≤0.4。
IgM试剂空白吸光度A340nm2.4分析灵敏度测试IgG:4.85g/L、IgA:0.94g/L、IgM:0.47g/L被测物时,吸光度差值(△A)IgG应不小于0.20、IgA应不小于0.20、IgM应不小于0.05。
2.5线性范围IgG:在(0~35.0)g/L范围内,其线性相关系数r≥0.990;浓度≥5.0g/L 时,相对偏差≤20%;浓度<5.0g/L时,绝对偏差≤1.0g/L。
IgA:在(0~8.0)g/L范围内,其线性相关系数r≥0.990;浓度≥1.3g/L 时,相对偏差≤20%;浓度<1.3g/L时,绝对偏差≤0.4g/L。
IgM:在(0~4.8)g/L范围内,其线性相关系数r≥0.990;浓度≥0.4g/L时,相对偏差≤20%;浓度<0.4g/L时,绝对偏差≤0.2g/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤20.0%。

免疫球蛋白定量的测定方法
免疫球蛋白定量的测定方法,这可真是个超级重要的事儿啊!你知道吗,就好像我们要了解一个神秘宝库里面到底有多少宝贝一样。
先来说说单向免疫扩散法吧,这就像是在一个大平地上,让免疫球蛋白和特定的抗体慢慢扩散开来,然后形成一个个独特的沉淀环,通过测量这些沉淀环的大小,不就能知道免疫球蛋白的量了嘛!是不是很神奇?
还有免疫比浊法,哇哦,这就好像是一场激烈的比赛!让免疫球蛋白和抗体在特殊的环境里“较量”一番,然后通过观察溶液的浑浊程度来判断免疫球蛋白的多少,这多有意思呀!
还有呢,酶联免疫吸附测定法,这简直就是一个精心设计的实验舞台呀!把免疫球蛋白和各种试剂放在一起,通过一系列反应,最后用特殊的方法检测出结果,就像是一场精彩的魔术表演,最后谜底揭晓,我们就知道免疫球蛋白的量啦!
放射免疫测定法也不能落下呀!就如同能看到微观世界的神奇眼睛,利用放射性物质来精确测量免疫球蛋白的量,这是多么高妙的手段呀!
这些方法各有各的特点,各有各的厉害之处,不是吗?它们就像一群各具本领的超级英雄,为了我们的健康而战斗!我们能不好好了解它们吗?免疫球蛋白定量的测定方法真的是太重要了,它们是医学领域的得力助手,帮助医生们更准确地了解病情,为患者提供更好的治疗方案。
我们应该对这些方法充满敬意和感激,它们是守护我们健康的无声卫士啊!。

免疫球蛋白G测定试剂盒(免疫比浊法) 适用范围:用于体外定量测定人血清中免疫球蛋白G的浓度。
1.1 规格试剂1:1×60mL,试剂2:1×12mL;试剂1:1×60mL,试剂2:1×15mL;试剂1:1×60mL,试剂2:1×20mL;试剂1:3×40mL,试剂2:3×20mL;试剂1:2×50mL,试剂2:2×10mL;试剂1:1×45mL,试剂2:1×9mL;试剂1:1×5L,试剂2:1×1L;试剂1:2×5L,试剂2:1×2L。
1.2 主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1应为无色或浅色液体,试剂2应为无色或浅色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在700nm处测定试剂空白吸光度,应≤1.9。
2.4 分析灵敏度测试10g/L的被测物时,吸光度变化(ΔA)应不低于0.0025。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[0.3,25]g/L区间内,线性相关系数r应不低于0.990;2.7.2 在[0.3,3.0)g/L区间内,绝对偏差不超过±0.36g/L;在[3.0,25]g/L 区间内,相对偏差不超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差≤12%。
2.9 空白限空白限为0.01g/L。
2.10 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7、2.9之规定。



免疫球蛋白GIgG测定免疫比浊法原理分析原理是液相免疫沉淀散射比浊终点测定法。
抗血清用缓冲液稀释后加到一份病人血清中,经过孵育后可以测定抗原抗体复合物产生的散射光。
散射光结果和血清中的IgG浓度成正比。
2.标本采集:标本采集前病人准备:受检者空腹。
标本种类:血清或血浆。
标本要求:取被检者静脉血2ml,室温放置不超过4小时,分离血清备用。
3.标本储存:待测标本在2-8℃存放不超过24小时,-20℃不超过三个月,-70℃长期保存。
避免反复冻融。
标本运输:室温运输。
标本拒收标准:细菌污染、溶血、脂血不能作测定。
试剂6.1试剂名称:免疫球蛋白G检测试剂盒6.2试剂生产厂家:芬兰Orion诊断试剂公司6.3包装规格:60Test/kit6.4试剂盒组成:缓冲液30ml空白缓冲液30ml抗血清试剂0.5ml定标液0.5ml磁卡1张仪器设备:7.1仪器名称:OrionTurboxRplus特定蛋白分析仪7.2仪器厂家:芬兰Orion集团公司7.3仪器型号:Turboxplus操作步骤:试剂配制:8.1.1抗血清应用液准备:吸取500ul抗血清加到反应缓冲液中,轻轻混匀,应用液2-8℃可保存12个星期。
8.1.2空白缓冲液:液体待用。
8.1.3定标液:用0.9%NaCL进行1:51稀释。
定标液根据IFCC提供的材料CRM470进行标定。
收集与处理样品:样品用0.9%Nacl进行1:51稀释。
为每一份样本测定准备一份样品空白,同样,为定标液另外准备一份定标液空白。
准备两份定标液测定(定标完成后,标准曲线数据存储在磁卡内。
下次检测如使用同批试剂,可以不必做定标而直接使用磁卡上的定标信息)。
如下准备各比色管:轻轻摇动混匀,室温18-25℃放置30±5分钟。
仪器测试步骤:参见TurboxR特定蛋白分析仪作业指导书。
结果计算:仪器直接计算并打印结果。
临床意义:IgG是血清中抗细菌、抗病毒、抗毒素的主要抗体。
巨噬细胞、中性粒细胞表面具有IgGFc受体,可增强对细菌等物质的吞噬能力。

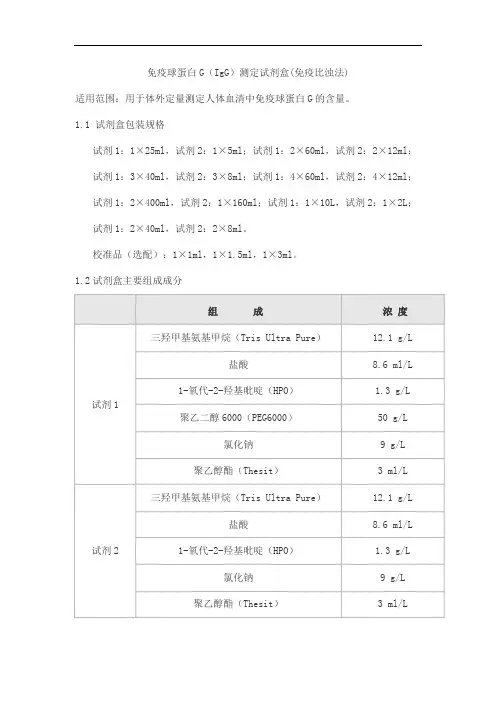
免疫球蛋白G(IgG)测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人体血清中免疫球蛋白G的含量。
1.1 试剂盒包装规格试剂1:1×25ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×12ml;试剂1:3×40ml,试剂2:3×8ml;试剂1:4×60ml,试剂2:4×12ml;试剂1:2×400ml,试剂2:1×160ml;试剂1:1×10L,试剂2:1×2L;试剂1:2×40ml,试剂2:2×8ml。
校准品(选配):1×1ml,1×1.5ml,1×3ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色澄清液体;试剂2浅黄至微红色液体。
校准品:无色至浅黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、405nm波长、1cm光径条件下,试剂空白吸光度应不大于0.2。
2.4 分析灵敏度测定浓度为1g/L样本时,吸光度变化值(ΔA)应在(0.05,0.40)范围内。
2.5 线性范围在(0.5,20.00)g/L线性范围内,线性相关系数r不小于0.995。
在(6.00,20.00)g/L区间内线性相对偏差不大于±10%;(0.5,6.00]g/L区间内线性绝对偏差应不大于±0.60g/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至IRMM生产的有证参考物质(ERM-DA470k)。
免疫球蛋白的定量检测方法免疫球蛋白(Immunoglobulin,Ig)是一类高度特异性的抗体分子,是机体免疫系统中的重要组成部分。
它们能够识别并结合抗原,参与体内外的免疫应答,并发挥抗体介导的免疫效应。
由于免疫球蛋白的重要性,准确地定量测定免疫球蛋白的水平对于诊断和监测许多疾病非常关键。
免疫学原理免疫球蛋白的定量检测方法基于免疫学原理,通过特异性抗体与待测的免疫球蛋白发生特异性结合反应,从而定量测定免疫球蛋白的浓度。
在典型的定量检测方法中,首先要选择特异性的抗体。
对于免疫球蛋白的检测,通常使用与特定免疫球蛋白亚类(例如IgG、IgM、IgA)结合的抗体。
这些抗体会与待测的免疫球蛋白发生特异性结合,而与其他免疫球蛋白亚类没有或有很弱的结合能力。
免疫球蛋白的定量检测方法免疫球蛋白的定量检测方法主要包括免疫比浊法、免疫电泳法和免疫透析法等。
免疫比浊法免疫比浊法是最常用的免疫球蛋白定量方法之一。
它利用免疫反应生成的免疫复合物会导致液体浑浊的特性,通过比较免疫复合物和标准溶液的浑浊程度可以推测出免疫球蛋白的浓度。
利用这个原理,可以通过比色法、比度法或比重法进行免疫比浊定量。
免疫电泳法免疫电泳法是一种将免疫反应与电泳相结合的方法。
在免疫电泳的过程中,将待测的免疫球蛋白与特异性抗体结合,然后经过电泳分离。
通过在凝胶上形成特定的免疫球蛋白带,就能够对免疫球蛋白进行定性和定量分析。
免疫透析法免疫透析法是通过利用半透膜将大分子量的抗原或抗体与待测免疫球蛋白分离的方法。
待测免疫球蛋白通过半透膜与特异性抗体进行反应,然后通过透析膜分离。
通过测定分离后的物质的浓度,可以定量测定免疫球蛋白的浓度。
应用领域免疫球蛋白的定量检测方法在临床医学和科研中具有广泛的应用。
在临床医学中,免疫球蛋白的定量检测方法常用于免疫系统疾病的诊断和治疗监测,例如免疫缺陷病、自身免疫病等。
此外,免疫球蛋白的定量检测也可用于感染病的检测与诊断,例如HIV、COVID-19等。
项目免疫球蛋白G(IgG)方法免疫比浊法目录1.检测原理2.标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3.试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4.仪器5.操作6.计算7.操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8.参考值9.临床意义附录A: 参数1. 检测原理405nm样本中IGG + 试剂中的IGG抗体-----------------大分子免疫复合物在405nm监测生成的复合物的浊度变化,与样本中IGG含量成正比。
2. 标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:不使用抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:R1:PEG4 缓冲液:包含高分子强化剂的磷酸盐缓冲液。
含有0.095%的叠氮化钠。
R2:IgG抗血清,含0.095%的叠氮化钠。
3.2:校准血清使用湖南永和阳光科技有限责任公司提供的多项免疫类标准液。
其中包含免疫球蛋白G的定值。
校准频次:全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:原包装试剂储存在2-8℃至标签所示失效日期。
免疫球蛋白生化检测方法
1. 免疫电泳法,这是一种常见的检测方法,通过将血清样品在
凝胶上电泳分离,然后使用特定的抗体进行染色来检测不同类型的
免疫球蛋白。
这种方法能够快速、准确地检测出各种类型的免疫球
蛋白,但需要专业的设备和操作技术。
2. 免疫荧光法,这种方法利用荧光标记的抗体与特定的免疫球
蛋白结合,然后通过荧光显微镜观察样品中的荧光信号来检测免疫
球蛋白的存在和数量。
这种方法对于多种免疫球蛋白的检测具有高
灵敏度和特异性,但需要昂贵的设备和专业的操作技能。
3. 酶联免疫吸附测定法(ELISA),ELISA是一种常用的免疫
学检测方法,通过将样品中的免疫球蛋白与特定的酶标记抗体结合,然后通过酶的底物来检测免疫球蛋白的存在和浓度。
这种方法操作
简单,且对于大批量样品的检测具有高通量性能。
4. 免疫比浊法,这是一种常规的免疫球蛋白检测方法,通过观
察样品中特定抗体与免疫球蛋白结合后形成的沉淀或浊度变化来判
断免疫球蛋白的存在和浓度。
这种方法简单易行,但对于低浓度的
免疫球蛋白检测灵敏度较低。
总的来说,免疫球蛋白生化检测方法多种多样,每种方法都有其适用的场景和优缺点。
在临床实验室中,通常会根据具体的检测要求和设备条件选择合适的方法进行免疫球蛋白的检测。
免疫比浊法检测免疫球蛋白
免疫比浊法检测免疫球蛋白
一、实验目的
利用免疫比浊法绘制标准曲线,并检测样品中免疫球蛋白的浓度。
(本小组检测的为IgG样品)
二、实验原理
1.抗原抗体反应(Antigen-antibody reaction):抗原与其刺激机体产生的相应抗体在体内或体外发生特异性结合的反应。
反应特点有:特异性、比例性、可逆性、敏感性。
影响因素有:电解质、温度、酸碱度。
2.免疫比浊法:合适比例的抗原抗体形成的免疫复合物,在PEG 作用下形成微粒,使样品浊度发生变化。
当一束光线通过溶液受到光散射和光吸收两个因素的影响而使光的强度减弱,根据光的强度改变可测得微粒浓度。
分类:①透射比浊法(Transmission tubidimetry)当一定波长光线通过浊度发生变化的反应混合物时,由于被不溶性免疫复合物吸收而减弱,故在一定范围内吸光度与免疫复合物量呈正相关。
当抗体浓度固定(过量),样品的浊度与其中所含抗原量成正比。
(特点)透射比浊操作简便,适用于普通的自动生化分析仪和普通的分光光度计,几乎所有的实验室均能开展。
不足的是灵敏度和精密度均不够理想,所需的抗血清量大,检测的时间较长。
②散射比浊法(Nephelometry)光线通过检测溶液时,被其中所含的抗原抗体复合物折射而部分偏转,产生散射光,其强度与复合物的数量和散射夹角成正比,与光的波长成反比。
(特点)优点是灵敏度、精密度均较高,检测快速。
其缺点是需特定的分析仪器,试剂价格高。
本实验采用透射法。
3.聚乙二醇PEG的作用:在免疫反应中,为增强抗原抗体反应常使用增聚剂,3~4%的聚乙二醇,可破坏抗原抗体的水化层,促进抗原抗体靠近反应,但如浓度不适合,会影响其它溶质或产生非特异性
聚集影响结果。
三、实验材料
免疫球蛋白A,G(IgA,IgG)测定试剂(试剂1[PEG],试剂2[羊抗人IgA, IgG])(1管/每组)
免疫球蛋白A, G(IgA,IgG)校准品,蒸馏水,血清样本(1管)
微量加样枪、ep管(1.5mL离心管)
酶标仪、水浴箱
四、实验步骤
1.在7个EP管中各加250μL IgG试剂1(PEG)。
2.7管分别加入蒸馏水、校准品原液、1:2校准品、1:4校准品、1:8校准品、1:16校准品、样本各2μL。
3.混匀后37℃水浴5min。
4.7管各加入85μL IgG试剂2(羊抗人IgG)。
5.混匀后37℃水浴10min。
6.分别吸取200μL至96孔酶标板中,用酶标仪在700nm处读取OD值。
五、实验结果与数据处理
2.标准曲线
3.样本浓度:y=0.604代入x=26.648g/L
由此得稀释之前样本的浓度为79.945g/L
误差:(79.945-34.8)/34.8*100%=129.73%
误差分析:
①抗原抗体反应需要一定孵育时间和温度,而操作中由于加样的速度限制,无法严格控制各管的反应时间;本次制作标准液时量极小,很有可能出现未混匀、挂壁的情况;标准液吸取量小会导致移液枪的误差被放大。
②免疫比浊法的基本原理是基于抗原抗体结合,而这个结合反应有特殊性,只有在一定范围浓度中,两者比例合适时检测结果才准确,否则会产生带现象,已有文章表明,稀释前后检测结果偏差很大(朱爱萍, 郭书云, 赵锐. 免疫比浊法检测异常血清免疫球蛋白的方法学探讨[J]. 现代检验医学杂志, 1999(4):33-34.),所以我认为此样本虽然是由原液稀释三倍所得,但在溶液中IgG抗体的浓度都相同的情况下,两管中抗原抗体比例相差很大,所以检测结果也有偏差是可以理解的。
同时再结合散点图拟合出的标准曲线,可以发现,浓度较高的两管标准液距离拟合曲线的偏差是最大的,由此推断,1:1原液和1:2原液并不适合本次实验中所给的羊抗人抗体浓度(未知)。
所以,误差来源除了以上所说原因之外,还有本次实验提供的抗体浓度,并不适合原液中IgG浓度的检测,而稀释三倍后的样品属比较适合的范围。
所以最大的误差来源是抗体浓度的选择,虽然抗体浓度是保证过量的,但是过量的程度相对每个管来说是不同的,1:1和1:2也许需要更大的浓度。
六、思考
1.本实验采用的免疫比浊法适用于人体内哪几种Ig?
人体血清中含有五类免疫球蛋白,分别为IgG、IgA、IgM、IgD、IgE。
其中前三种含量相对较高,而IgD和IgE含量极低,膜结合型IgD构成BCR,是Bcell成熟的标志,IgE在正常人血清中含量最少,与Ⅰ型超敏反应和寄生虫感染有关。
理论上此五种Ig均可以采用免疫比浊法检测含量,但临床上常只检测前三种含量较高、疾病相关性更强的Ig,在考虑寄生虫感染和变态反应性疾病时还可以检测血清中IgE 的含量。
2.检测血清等体液标本中某种抗原分子的方法?
原理同本实验,采用抗原抗体结合的原理,凝集反应、沉淀反应、
中和反应,以及免疫荧光法和酶联免疫吸附试验等,在使用抗原抗体结合原理时,将抗体加入荧光可以直接检测荧光强度来定量检测抗原含量,而酶联免疫吸附试验还可采用双抗体法以级联放大更易检测。
3.使用免疫比浊法时,抗原抗体的比例应采用哪个区域?
应采用抗体过量的前带,因为所检测的物质是抗原,希望所加样品中的抗原完全与抗体结合形成微粒,所有的微粒均可吸收酶标仪中透过的光线。
因为吸光度OD值与溶液中颗粒的浓度成正比,而计算时默认颗粒的浓度与样品中所含抗原的浓度相当,所以,只有在抗体含量过量时,才能保证所有抗原都能与抗体结合形成微粒,降低因抗原未完全结合抗体所带来的误差。
而且结合本次误差,不同管抗体过量的程度也应该大致相当。
4.为何波长选择700nm?
抗原抗体结合后的吸光度受抗原抗体种类的影响,本次采用的是羊抗人Ig抗体,应该由经验值可知700nm是IgG抗原抗体结合后最大的吸收波长,在最大吸收波长处通过测吸光度来测浓度所得结果的误差最小。