免疫透射比浊法
- 格式:doc
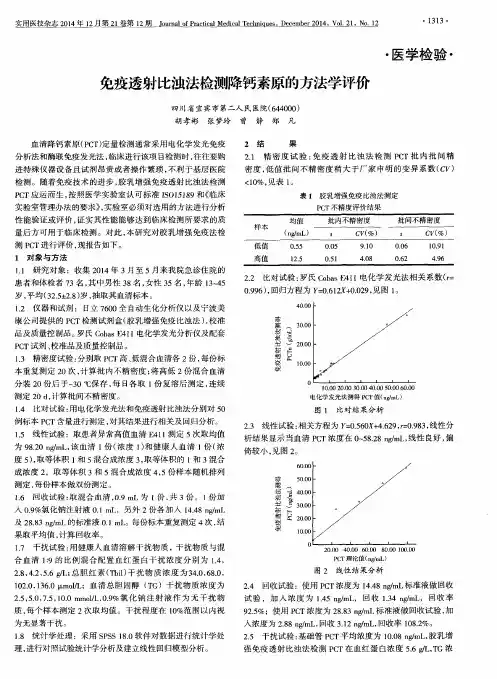
- 大小:204.00 KB
- 文档页数:8

免疫透射比浊法和免疫散射比浊法检测特定蛋白的抗干扰能力比较目的:对免疫透射比浊法与免疫散射比浊法在检测特定蛋白抗干扰能力的效果进行对比。
方法:收集血清样本,且制作浓度不同的特定蛋白混合血清,同时将比例不同的两种干扰物置于混合血清当中,之后再用免疫透射比浊法、免疫散射比浊法对其进行测定,且对干扰率加以计算,以了解两种检测方法的抗干扰能力。
结果:CH在9000与15000时,免疫散射比浊法对IgM进行检测受到干扰;Hb在9.9与29.8浓度时,免疫散射比浊法对高浓度IgM、低浓度CRP检测时受到干扰;采取免疫透射比浊法对三种含有干扰物的特定蛋白进行检测时,未受到任何干扰影响。
结论:在对CH、Hb等干扰物的抗干扰能力方面,免疫透射比浊法比免疫散射比浊法更为优越。
标签:特定蛋白;免疫透射比浊法;免疫散射比浊法在临床上,对于人血清内特定蛋白的检测,一般是采取免疫散射比浊法、免疫透射比浊法进行检测;然而,在检测的过程中,如游离血红蛋白、脂蛋白等会对检测的结果带来一定的干扰,继而影响检测结果的准确性[1]。
对此,为保证血清检测的准确性,笔者对免疫透射比浊法、免疫散射比浊法在特定蛋白抗干扰能力的效果进行探讨,具体报道如下。
1.资料与方法1.1对象本次研究的样本源自于某医院门诊与住院患者当天的新鲜血清,其中排除存在脂血、溶血、浑浊等血清。
同时,事前准备好IgM、CRP等浓度不等的混合血清,具体为IgM低浓度1.0~1.5g/L,高浓度大于2.0g/L;CRP低浓度4~10mg/L,高浓度大于100mg/L。
1.2仪器设备选用Dade Behring BNProSpec特定蛋白测定仪、Roche Modular P全自动生化分析仪,试验所用试剂皆为仪器配套试剂。
同时选取三个干扰物,即FBil(游离胆红素)、CH(乳糜)、Hb(血红蛋白),每种干扰物各准备两瓶试剂盒,一瓶作为空白对照使用,另外,干扰物的浓度具体为FBil3280μmol/L、CH15000FTU、Hb49.6μmol/L[2]。


图18-4 抗原抗体反应曲线在免疫比浊过程中,由于抗原抗体结合的三过程,从而导致光密度与浓度之间不呈线性关系,一般是3次方程曲线关系。
若将抗原与抗体两个变量之间的变动特征恰当地反映出来,需要经过3次方程拟合成近似直线化的曲线方程,再进行运算,免疫比浊中,采用终点法或速率法,用5个或7个不同梯度进行定标,经3次曲线方程求出一条能反映真实情况的浓度与光密度的关系曲线方程,才能作为定量的工作曲线。
二、血清ApoAⅠ(B100)透射比浊测定法脂蛋白抗原在溶液中与相应特异抗体形成抗原抗体复合物的混浊颗粒,分散于溶液介质中,在一定波长下测定其混浊程度,进行ApoAⅠ(B100)的定量测定。
(一)手工操作1.原理血清ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗体复合物→测定光密度2.试剂(伊利康)(1)Apo缓冲液(RⅠ),含4%PEG6000和表面活性剂ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗体复合物→测定吸光光密度2.双试剂单(双)波长法(1)试剂(温州伊利康)RⅠ:Apo缓冲液,含4% PEG6000和表面活性。
RⅡ:羊抗人ApoA(B100)稀释抗血清RⅢ:Apo定值血清(2)各试剂及标本用量如下表:项目血清Apo缓冲液(RⅠ)ApoAⅠ抗血清液(RⅡ)ApoB100抗血清液(RⅡ)ApoAⅠ2~5μl300~350μl80~100μlApoB100 2~5μl300~350μl80-100μl(3)定标:以5点Apo梯度浓度,采用免疫定标法按表18-21参数上机定标,如图18-5所示。
图18-5 ApoAⅠ 五点免疫定标曲线图(以CL-7200仪器为例)(4)上机(终点法或两点法)(5)说明:①Apo测定的光密度从340~700nm范围都可采用,多用340nm;②国内已有的Apo试剂盒均无需处理;③血清标本也无需处理,均可直接检测;④本法适用于多种类型的全自动生化分析仪检测,自动扣除空白,快速准确;⑤效价不同的抗血清,其用量应作适当的调整。




免疫比浊法和免疫投射比浊法1.定义:(1)免疫比浊法:在一定量的抗体中分别加入递增量的抗原,经一定时间后形成抗原抗体复合物,用浊度计测量反应液体的浊度,并由此推算样品中的抗原含量。
(2)免疫投射比浊法:当光线通过一个浑浊介质溶液时,由于溶液中存在混浊颗粒,光线被吸收一部分,吸收的多少与混浊颗粒的量成正比,这种测定光吸收量的方法称为透射比浊法。
一般采用抗体对抗原定量的透射比浊法,称为免疫透射比浊法。
2.原理(1)免疫比浊法是抗原抗体结合动态测定方法。
其基本原理是:当抗原与抗体在特殊稀释系统中反应而且比例合适(一般规定抗体过量)时,形成的可溶性免疫复合物在稀释系统中的促聚剂(聚乙二醇等)的作用下,自液相析出,形成微粒,使反应液出现浊度。
当抗体浓度固定时,形成的免疫复合物的量随着检样中抗原量的增加而增加,反应液的浊度也随之增加。
通过测定反应液的浊度与一系列标准品对照,即可计算出检样中抗原的含量。
(2)免疫透射比浊法是抗原抗体结合后,形成免疫复合物,在一定时间内复合物聚合出现浊度。
当光线通过溶液时,可被免疫复合物吸收。
免疫复合物量越多,光线吸收越多。
光线被吸收的量在一定范围内与免疫复合物的量成正比。
利用比浊计测定光密度值,复合物的含量与光密度值成正比,同样当抗体量一定时,光密度值也与抗原含量成正比。
本法较单向琼脂扩散试验和火箭电泳等一般免疫化学定量方法敏感、快速简便,但要求免疫复合物的数量和分子量达到一定高度,否则就难以测出。
3.关系4.免疫比浊法适用的仪器紫外可见分光光度计全自动生化仪全自动生化仪常见的检测方法终点法连续检测法比浊法均相酶免疫分析。


免疫透射比浊法一、原理当光线通过一个浑浊介质溶液时,由于溶液中存在混浊颗粒,光线被吸收一部分,吸收的多少与混浊颗粒的量成正比,这种测定光吸收量的方法称为透射比浊法。
这一方法早于1959年Schultre和Schuick等报道应用于血浆蛋白与其抗体结合后形成复合物,导致浊度的改变,再进行透射比浊测定,一般采用抗体对抗原定量的透射比浊法,称为免疫透射比浊法。
其原理是,利用抗原和抗体的特异性结合形成复合物,通过测定复合物形成量的多少对抗原或抗体进行定量的方法。
在介质溶液中,抗原与特异性抗体在一定条件下才能形成复合物,一定的条件包括:①对抗体的要求,作为体液或组织中蛋白质种类很多,若要快速特异检测,要求有单价特异抗体才能与抗原形成复合物。
某一种蛋白质,有其特异抗体才能与该抗原结合,形成免疫复合物进行定量,若抗体不纯混杂有另一种或两种少量的抗体,这种免疫复合物就不是单一复合物而是大杂烩,结果偏高;②抗原抗体比例适当,因免疫复合物形成有三个阶段,第一阶段是复合物形成抗原抗体复合物;第二阶段是初步形成抗原抗体复合物,此阶段是复合物交联成大的网格状结构;第三阶段是复合物聚合产生絮状沉淀。
只有在抗原与抗体等价时即无过剩抗体,此时,复合物的结合与解离处于平衡状态,其混浊程度达高峰。
在抗体过量时,随抗原量的增加而复合物形成也增加,其测定只能在反应曲线的左侧进行(见图18-4);③一般要求溶液中有非离子性亲水多聚体促进免疫复合物的形成,如聚二乙醇6000等。
溶液pH为6.5~8.0之间为宜。
载脂蛋白有形成两性螺旋片(amphipathic helix)的特性,对脂质(特别是磷脂)有高度亲和力,与脂质结合后有时会掩盖抗原位点或构象改变,可以部分或完全丧失对抗血清的特异反应。
为此,载脂蛋白检测过程中有必要先暴露抗原位点,所用试剂有表面活性剂,尿素,盐酸胍和吐温等解离蛋白剂,或用四甲基脲脱脂或有机溶剂脱脂等暴露抗原决定簇等方法,血清脂蛋白颗粒中的载脂蛋白,能在短时间内形成抗原抗体复合物进行定量;④抗原不能过量,因为抗原过量,抗原抗体复合物形成不但不增加,反而会减少,光散射或光吸收减少,检测结果反而偏低。

免疫透射比浊法和免疫散射比浊法检测特定蛋白的抗干扰能力比较在临床上,对于人血清内特定蛋白的检测,一般是采取免疫散射比浊法、免疫透射比浊法进行检测;然而,在检测的过程中,如游离血红蛋白、脂蛋白等会对检测的结果带来一定的干扰,继而影响检测结果的准确性[1]。
对此,为保证血清检测的准确性,笔者对免疫透射比浊法、免疫散射比浊法在特定蛋白抗干扰能力的效果进行探讨,具体报道如下。
1.资料与方法1.1对象本次研究的样本源自于某医院门诊与住院患者当天的新鲜血清,其中排除存在脂血、溶血、浑浊等血清。
同时,事前准备好IgM、CRP等浓度不等的混合血清,具体为IgM低浓度1.0~1.5g/L,高浓度大于2.0g/L;CRP低浓度4~10mg/L,高浓度大于100mg/L。
1.2仪器设备选用Dade Behring BNProSpec特定蛋白测定仪、Roche Modular P全自动生化分析仪,试验所用试剂皆为仪器配套试剂。
同时选取三个干扰物,即FBil(游离胆红素)、CH(乳糜)、Hb(血红蛋白),每种干扰物各准备两瓶试剂盒,一瓶作为空白对照使用,另外,干扰物的浓度具体为FBil3280μmol/L、CH15000FTU、Hb49.6μmol/L[2]。
1.3研究方法首先,对混合血清进行制备,之后依据干扰试剂盒上的制备顺序,配制干扰物;将2ml的蒸馏水加入到每一个干扰物与空白对照内,复溶。
然后,按照1:9的比例,把已经准备好的干扰物和混合血清混合在一起,制作成干扰物样本,其中含有干扰物的为样本甲,未加干扰物为样本乙[3]。
把两个样本分别制定浓度不等的若干个样本,具体浓度见下表1所示。
最后采取特定蛋白测定仪与全自动生化分析仪展开特定蛋白的抗干扰试验检测,同时对其干扰率进行计算。
1.4统计学分析本次研究所得全部数据,均采取软件Excel加以分析与处理。
其中,干扰率计算公式为:含有干扰物组的均值减去空白对照组的均值,之后再除以空白对照组的均值。
免疫比浊法原理
免疫比浊法是一种常用于生物化学和免疫学领域的实验方法,它通过测定抗原
与抗体结合后形成的免疫复合物的光学密度来定量分析抗原或抗体的含量。
这种方法具有灵敏度高、特异性强、操作简便等优点,因此在医学诊断、生物学研究等领域得到了广泛应用。
免疫比浊法的原理主要是利用抗原与抗体结合后形成的免疫复合物对光的散射
或吸收产生影响,从而实现对抗原或抗体含量的测定。
具体来说,当抗原与抗体结合形成免疫复合物后,会使溶液中的颗粒浓度增加,导致溶液的浊度增加,从而使溶液对光的散射或吸收增强。
通过测定溶液的光学密度,就可以间接地反映出抗原或抗体的含量。
在进行免疫比浊法实验时,首先需要将待测样品与相应的抗体进行反应,形成
免疫复合物。
然后利用光度计或比色皿等设备,测定样品溶液的光学密度。
通过比较待测样品与标准曲线的关系,就可以计算出样品中抗原或抗体的含量。
免疫比浊法在实际应用中具有广泛的适用性。
例如,在医学诊断中,可以利用
免疫比浊法来检测血清中特定蛋白质的含量,从而辅助诊断各种疾病。
在生物学研究中,可以利用免疫比浊法来分析细胞表面分子的表达情况,研究免疫应答过程等。
此外,免疫比浊法还可以用于药物的药效学研究、环境监测等领域。
总之,免疫比浊法作为一种常用的免疫学实验方法,具有灵敏度高、特异性强、操作简便等优点,适用于各种领域的抗原或抗体含量的定量分析。
通过对免疫复合物对光的散射或吸收进行测定,可以实现对抗原或抗体含量的准确测定,为医学诊断、生物学研究等领域提供了重要的实验手段。
免疫比浊法是抗原抗体结合动态测定方法。
其基本原理是:当抗原与抗体在特殊稀释系统中反应而且比例合适(一般规定抗体过量)时,形成的可溶性免疫复合物在稀释系统中的促聚剂(聚乙二醇等)的作用下,自液相析出,形成微粒,使反应液出现浊度。
当抗体浓度固定时,形成的免疫复合物的量随着检样中抗原量的增加而增加,反应液的浊度也随之增加。
通过测定反应液的浊度与一系列标准品对照,即可计算出检样中抗原的含量。
抗体(Ab)与可溶性抗原(Ag)反应,形成一定结构的免疫复合物,成为悬浮于反应溶液中的微粒。
在沉淀反应中形成的复合物微粒具有特殊的光学性质,可用仪器检测,提高了检测的速度、灵敏度和易操作性。
免疫比浊测定注意事项:1、抗原或抗体量大大过剩,可出现可溶性复合物,造成误差。
2、应维持反应管中抗体蛋白始终过剩。
3、易受到脂血的影响。
分类1.免疫透射比浊法抗原抗体结合后,形成免疫复合物,在一定时间内复合物聚合出现浊度。
当光线通过溶液时,可被免疫复合物吸收。
免疫复合物量越多,光线吸收越多。
光线被吸收的量在一定范围内与免疫复合物的量成正比。
利用比浊计测定光密度值,复合物的含量与光密度值成正比,同样当抗体量一定时,光密度值也与抗原含量成正比。
本法较单向琼脂扩散试验和火箭电泳等一般免疫化学定量方法敏感、快速简便,但要求免疫复合物的数量和分子量达到一定高度,否则就难以测出。
2.免疫散射比浊法一定波长的光沿水平轴照射,通过溶液使遇到抗原抗体复合物粒子,光线被粒子颗粒折射,发生偏转,光线偏转的角度与发射光的波长和抗原抗体复合物颗粒大小和多少密切相关。
散射光的强度与复合物的含量成正比,即待测抗原越多,形成的复合物也越多,散射光也越强。
散射光的强度还与各种物理因素,如加入抗原或抗体的时间、光源的强弱和波长、测量角度等密切相关。
散射比浊法又分为速率散射比浊法和终点散射比浊法。
3.免疫胶乳比浊法胶乳比浊法即是将待测物质相对应的抗体包被在直径为15-60nm的胶乳颗粒上,使抗原抗体结合物的体积增大,光通过之后,透射光和散射光的强度变化更为显著,从而提高试验的敏感性。
【摘要】目的:评估透射免疫比浊法和速率散射比浊法检测C反应蛋白(CRP)的灵敏度和特异性。
方法:用免疫透射比浊法和速率散射比浊法同时检测了80例各种患者血清中CRP 浓度。
结果:两种方法在8—20mg/L、20~40mg/L、40~80mg/L、80~160mg/L、160~300mg/L范围内测定C反应蛋白的相关系数是0.990、0.996、0.995、0.992、0.997.说明两种方法的相关性是良好的,而在低值1~8mg/L的测定中两方法的相关系数为0.928.结论:速率散射免疫比浊法在低值和高值测定中可以得到较为准确的CRP检测结果。
【关键词】透射免疫比浊法散射免疫比浊法C反应蛋白在急性应急性疾病时如大手术、重度创伤、心肌梗死、严重感染、肿瘤等,血浆中某些蛋白浓度可明显增高或降低,这种现象称为急性时相反应,这些蛋白统称为急性时相反应蛋白。
最具有代表性的急性时相蛋白首推C反应蛋白(CRP),CRP是目前临床上最有用的急性时相反应的一个敏感指标。
CRP作为炎症标志物,本身尽管为非特异性的,但对于细菌感染、各种炎症过程及组织坏死与损伤及其恢复期的筛检、监测、病情评估与疗效判断,都具有重要的意义J。
CRP的检测方法目前使用比较多的有胶乳凝集试验、免疫沉淀法、免疫浊度法和标记免疫测定法等,而其中的透射免疫比浊法和速率散射比浊法是目前公认为检测CRP较为精确的两种方法。
为了评估两种方法的灵敏度和特异性,我们收集了80份血清,用免疫透射比浊法和速率散射比浊法分别进行CRP的检测,并作了结果比较。
一、材料与方法1、标本来源样本血清来源于80例本院门诊和住院病人,其中骨折病员21例,确诊的恶性肿瘤病人15例,急性肺炎病员22例,冠心病病人10例,外科手术病员12例。
采集空腹血后及时分离血清,并置-20℃保存备用。
2、仪器日立7170型自动生化分析仪,BeckmanArray 360特定蛋白检测系统。
3、试剂透射免疫比浊法试剂盒及配套的校准品由上海基恩科技有限公司提供,批号为ISEP03。
三、免疫比浊法免疫比浊法是抗原抗体结合动态测定方法。
其基本原理是:当抗原与抗体在特殊稀释系统中反应而又比例合适(一般规定抗体过量)时,形成的可溶性免疫复合物在稀释系统中的促聚剂聚乙二醇等作用下,自液相析出;形成微粒,使反应液出现浊度。
当抗体浓度固定时,形成的免疫复合物的量随着检样中抗原量的增加而增加/反应液的浊度也随之增加。
通过测定反应液的浊度与一系列标准品对照,即可计算出检样申抗原的含量。
免疫比浊法可分为四型,1.透射比浊法;2.散射比浊法;3.免疫胶乳比浊法;4.速率抑制免疫比浊法。
实验六免疫透射比浊法测人血清lgG【原理】抗原抗体结合后,形成免疫复合物,在一定时间内复合物聚合出现浊度。
当光线通过溶液时,可被免疫复合物吸收。
免疫复合物量越多,光线吸收越多。
光线被吸收的量在一定范围内与免疫复合物的量成正比。
利用比浊计测定光密度值,复合物的含量与光密度值成正比,同样当抗体量一定时,光密度值也与抗原含量成正比。
本法较单向琼脂扩散试验和火箭电泳等一般免疫化学定量方法敏感、快速简便,但要求免疫复合物的数量和分子量达到一定高度,否则就难以测出。
【器材与试剂】1.抗原:人血清IgG参考血清和待测血清。
2.抗体,兔抗人IgG3.免疫比浊用缓冲液4.721分光光度计、离心机、吸管、滴管、微量加样器、试管。
【方法】1.抗原稀释,(1)标准抗原:用缓冲液将人血清IgG参考血清稀释成不同浓度,500、900、1300、1700、2100mg/lOOml。
(2)待测血清,用缓冲液作1:40稀释。
2.取小试管24管作好标记,每拌8管,共三排,即每个稀释度均有三个重复管。
1~5管为不同稀释度标准抗原管,第6管为待测血清管;第7管为抗血清对照管,第8管为待测血清对照管。
3.加样:(l)加抗血清:1~7管各加入免抗人IgG 2m1,第8管加缓冲液2ml。
(2)加抗原:每排1~5管分别加入不同稀释度的1出参考血清2Ou1,6管和8管分别加入1:40的待测血清2Oul,第7管加入缓冲液2Oul。
免疫比浊法原理免疫比浊法是一种常用的免疫学实验方法,它通过测定抗原与抗体相互作用后形成的免疫复合物的光学密度来定量测定抗原或抗体的含量。
该方法具有灵敏度高、特异性强、操作简便等优点,被广泛应用于临床诊断、生物医药研究等领域。
本文将详细介绍免疫比浊法的原理及其应用。
免疫比浊法的原理主要是利用抗原与抗体结合后形成的免疫复合物对光的散射作用来定量测定抗原或抗体的含量。
当抗原与抗体结合后,形成的免疫复合物会使溶液的透光性降低,导致溶液的浑浊度增加。
通过测定溶液的光学密度,就可以间接反映出抗原或抗体的含量。
免疫比浊法可以用于测定血清中的抗体含量、细胞表面抗原的表达水平等。
在进行免疫比浊法实验时,首先需要将待测样品与特异性抗体充分混合,使其发生免疫反应。
随后,通过离心等方法将免疫复合物沉淀下来,去除未结合的抗体。
然后,测定上清液的光学密度,利用标准曲线来计算出待测样品中抗原或抗体的含量。
需要注意的是,免疫比浊法在进行实验时需要严格控制实验条件,确保实验结果的准确性。
免疫比浊法具有许多优点,首先,它的灵敏度高,可以检测到极低浓度的抗原或抗体。
其次,该方法的特异性强,可以准确地区分不同的抗原或抗体。
此外,免疫比浊法操作简便,不需要昂贵的仪器设备,适用于大规模样品的检测。
因此,免疫比浊法被广泛应用于临床诊断、生物医药研究等领域。
总之,免疫比浊法是一种重要的免疫学实验方法,它通过测定免疫复合物的光学密度来定量测定抗原或抗体的含量。
该方法具有灵敏度高、特异性强、操作简便等优点,被广泛应用于临床诊断、生物医药研究等领域。
希望本文对免疫比浊法的原理及应用有所帮助,欢迎批评指正。
免疫透射比浊法
一、原理
当光线通过一个浑浊介质溶液时,由于溶液中存在混浊颗粒,光线被吸收一部分,吸收的多少与混浊颗粒的量成正比,这种测定光吸收量的方法称为透射比浊法。
这一方法早于1959年Schultre和Schuick 等报道应用于血浆蛋白与其抗体结合后形成复合物,导致浊度的改变,再进行透射比浊测定,一般采用抗体对抗原定量的透射比浊法,称为免疫透射比浊法。
其原理是,利用抗原和抗体的特异性结合形成复合物,通过测定复合物形成量的多少对抗原或抗体进行定量的方法。
在介质溶液中,抗原与特异性抗体在一定条件下才能形成复合物,一定的条件包括:①对抗体的要求,作为体液或组织中蛋白质种类很多,若要快速特异检测,要求有单价特异抗体才能与抗原形成复合物。
某一种蛋白质,有其特异抗体才能与该抗原结合,形成免疫复合物进行定量,若抗体不纯混杂有另一种或两种少量的抗体,这种免疫复合物就不是单一复合物而是大杂烩,结果偏高;②抗原抗体比例适当,因免疫复合物形成有三个阶段,第一阶段是复合物形成抗原抗体复合物;第二阶段是初步形成抗原抗体复合物,此阶段是复合物交联成大的网格状结构;第三阶段是复合物聚合产生絮状沉淀。
只有在抗原与抗体等价时即无过剩抗体,此时,复合物的结合与解离处于平衡状态,其混浊程度达高峰。
在抗体过量时,随抗原量的增加而复合物形成也增加,其测定只能在反应曲线的左侧进行(见图18-4);③一般要求溶液中有非离子性亲水多聚体促进免疫复合物的形成,如聚二乙醇6000等。
溶液pH为6.5~8.0之间为宜。
载脂蛋白有形成两性螺旋片(amphipathic helix)的特性,对脂质(特别是磷脂)有高度亲和力,与脂质结合后有时会掩盖抗原位点或构象改变,可以部分或完全丧失对抗血清的特异反应。
为此,载脂蛋白检测过程中有必要先暴露抗原位点,所用试剂有表面活性剂,尿素,盐酸胍和吐温等解离蛋白剂,或用四甲基脲脱脂或有机溶剂脱脂等暴露抗原决定簇等方法,血清脂蛋白颗粒中的载脂蛋白,能在短时间内形成抗原抗体复合物进行定量;④抗原不能过量,因为抗原过量,抗原抗体复合物形成不但不增加,反而会减少,光散射或光吸收减少,检测结果反而偏低。
图18-4 抗原抗体反应曲线
在免疫比浊过程中,由于抗原抗体结合的三过程,从而导致光密度与浓度之间不呈线性关系,一般是3次方程曲线关系。
若将抗原与抗体两个变量之间的变动特征恰当地反映出来,需要经过3次方程拟合成近似直线化的曲线方程,再进行运算,免疫比浊中,采用终点法或速率法,用5个或7个不同梯度进行定标,经3次曲线方程求出一条能反映真实情况的浓度与光密度的关系曲线方程,才能作为定量的工作曲线。
二、血清ApoAⅠ(B100)透射比浊测定法
脂蛋白抗原在溶液中与相应特异抗体形成抗原抗体复合物的混浊颗粒,分散于溶液介质中,在一定波长下测定其混浊程度,进行ApoAⅠ(B100)的定量测定。
(一)手工操作
1.原理
血清ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗体复合物→测定光密度
2.试剂(伊利康)
(1)Apo缓冲液(RⅠ),含4%PEG6000和表面活性剂
(2)羊抗人ApoAⅠ(B100)抗体液(RⅡ):监用前取抗血清200μl,加0.9%NaCl液700μl,混匀,待用,置冰箱一周内有效。
(3)ApoAⅠ(B100)参考血清(RⅢ)
3.操作
(1)按ApoAⅠ抗血清液或ApoB100抗血清100μl,加相应的Apo缓冲液0.9ml的比例混合成单一试剂(Apo抗体液)。
最好临用前配制当天用量。
(2)各试剂用量如下表
ApoAⅠApoB100
标准管测定管空白管标准管测定管空白管
参考血清5μl5μl
待测血清5μl5μl
ApoAⅠ抗体液 1.0ml 1.0ml 1.0ml
ApoB100抗体液 1.0ml 1.0ml 1.0ml 混匀各管,37℃保温10min,波长340min,于半自动分析仪上先吸入空白管液,再吸入标准管,仪器根据光密度及参考值得出一换算系数,再吸入测定管,仪器内根据光密度及系数进行运算,打印结果。
(3)定标方法,根据免疫比浊法原理,应取多点(3~9点),按y=a+bx+cx2+dx3的3次方程回归曲线进行定标,制作参考工作曲线。
①校正工作曲线的绘制:
配制抗血清稀释工作液:按RⅠ试剂0.9ml,加RⅡ试剂100μl的比例(Apo抗体液)混匀,待用。
制备5点校正液:取RⅢ(参考血清),用0.9%生理盐水倍比稀释成5个浓度,第5管为原参考血清浓度,其他4管分别为第5管的1/2、1/4、1/8、1/16(或浓度为0即0.9%NaCl)。
表18-20 标准曲线制备的各管(点)浓度
管号 1 2 3 4 5
1号管(0)(μl) 5
2号管(1/8)(μl) 5
3号管(1/4)(μl) 5
4号管(1/2)(μl) 5
5号管(1/1)(μl) 5
Apo抗体液(ml) 1.0 1.0 1.0 1.0 1.0 混匀各管,置37℃水浴保温10min,按程序上机作工作曲线。
②标本测定:吸待测血清(测定管)5μl,加上述稀释抗血清工作液1.0ml,于37℃水浴保温10min,上机读数,打印结果。
③如测定值超过工作曲线上限值,仪器会打印显示“过高”,此时,将待测标本稀释1倍再测。
④每批号的抗血清应作一次多点定标,即测定标本的抗血清应与定标的抗血清是同一批号抗血清。
(二)生化分析仪测定
1.原理
脂蛋白抗原在溶液中与相应特异抗体形成抗原抗体复合物的混浊颗粒分散于溶液介质中,在一定波长下测定其混浊程度,进行ApoAⅠ(B100)的定量测定。
ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗体复合物→测定吸光光密度
2.双试剂单(双)波长法
(1)试剂(温州伊利康)
RⅠ:Apo缓冲液,含4% PEG6000和表面活性。
RⅡ:羊抗人ApoA(B100)稀释抗血清
RⅢ:Apo定值血清
(2)各试剂及标本用量如下表:
项目血清
Apo缓冲液
(RⅠ)ApoAⅠ抗血清液
(RⅡ)
ApoB100抗血清液
(RⅡ)
ApoAⅠ2~5μl300~350μl80~100μl
ApoB1002~5μl300~350μl80-100μl (3)定标:以5点Apo梯度浓度,采用免疫定标法按表18-21参数上机定标,如图18-5所示。
图18-5 ApoAⅠ五点免疫定标曲线图(以CL-7200仪器为例)
(4)上机(终点法或两点法)
(5)说明:①Apo测定的光密度从340~700nm范围都可采用,多用340nm;②国内已有的Apo试剂盒均无需处理;③血清标本也无需处理,均可直接检测;④本法适用于多种类型的全自动生化分析仪检测,自动扣除空白,快速准确;⑤效价不同的抗血清,其用量应作适当的调整。
(5)计算△A=A2-A1,以△A值采用免疫定标自动运算。
3.单一试剂单波长法
(1)试剂同双试剂法
(2)标本及试剂用量:按ApoAⅠ抗血清液或ApoB抗血清液(RⅡ)100μl,加相应的Apo缓冲液(RⅠ)0.3m l的比例混合成单一试剂(Apo抗体液)。
最好临用前配制当天用量,此抗体液置2~8℃保存一周有效。
(3)定标:按五点梯度稀释定值血清(见表18-21),以终点法或两点法进行免疫定标。
(4)按以下步骤操作:
(5)以△A=A2-A1值按免疫定标自动运算。
(6)说明:①该法一般用半自动生化分析仪;②通过设延迟时间以扣除空白;③RⅠ、RⅡ试剂以临用时混合为好,未用完的混合试剂应置于2~8℃冰箱保存,只允许使用一周;④血清标本无需再处理。
4.ApoAⅠ、AⅡ、B、CⅡ、CⅢ和E的全自动生化分析仪检测的有关数据。
(1)上机参数(以CL-7200型为例)如表18-21所示。
表18-21 自动生化分析仪检测Apo有关参数
ApoAⅠAⅡ B CⅡCⅢ E
反应类型终点法
样品量3μl3μl3μl8μl3μl5μl
600nm(第一)数据数据700nm 700nm 700nm
测量波长
700nm(第二)数据数据340nm 340nm 340nm
第一波长5min 数据数据数据数据数据
反应时间
第二波长4.99min 数据数据数据数据数据
试剂Ⅰ350μl290μl350μl300μl290μl350μl
试剂Ⅱ100μl75μl100μl50μl75μl50μl
单位g/L g/L g/L mg/dl mg/dl mg/dl。