第八章 第三节 盐类的水解
- 格式:doc
- 大小:125.00 KB
- 文档页数:8
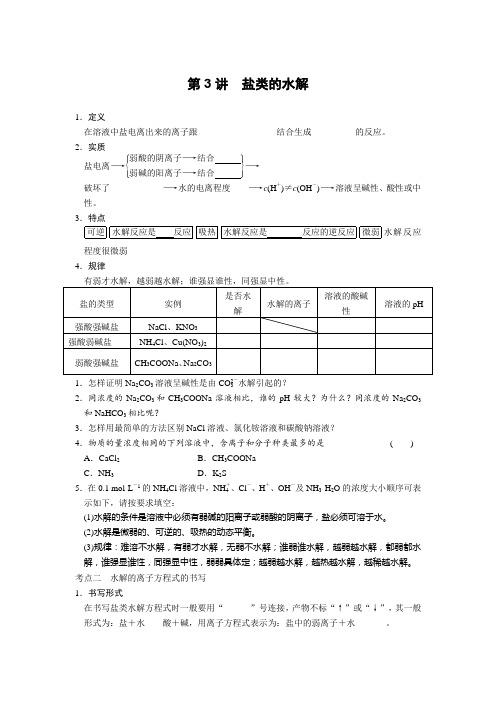
第3讲 盐类的水解1.定义在溶液中盐电离出来的离子跟__________________结合生成__________的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合 弱碱的阳离子―→结合 ―→ 破坏了____________―→水的电离程度____―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性。
3.特点可逆水解反应是 反应吸热水解反应是 反应的逆反应微弱水解反应程度很微弱 4.规律盐的类型 实例 是否水解 水解的离子溶液的酸碱性 溶液的pH强酸强碱盐 NaCl 、KNO 3 强酸弱碱盐 NH 4Cl 、Cu(NO 3)2 弱酸强碱盐CH 3COONa 、Na 2CO 31.怎样证明Na 2CO 3溶液呈碱性是由CO 2-3水解引起的?2.同浓度的Na 2CO 3和CH 3COONa 溶液相比,谁的pH 较大?为什么?同浓度的Na 2CO 3和NaHCO 3相比呢?3.怎样用最简单的方法区别NaCl 溶液、氯化铵溶液和碳酸钠溶液? 4.物质的量浓度相同的下列溶液中,含离子和分子种类最多的是 ( )A .CaCl 2B .CH 3COONaC .NH 3D .K 2S5.在0.1 mol·L -1的NH 4Cl 溶液中,NH +4、Cl -、H +、OH -及NH 3·H 2O 的浓度大小顺序可表示如下,请按要求填空:(1)水解的条件是溶液中必须有弱碱的阳离子或弱酸的阴离子,盐必须可溶于水。
(2)水解是微弱的、可逆的、吸热的动态平衡。
(3)规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。
考点二 水解的离子方程式的书写 1.书写形式在书写盐类水解方程式时一般要用“______”号连接,产物不标“↑”或“↓”,其一般形式为:盐+水酸+碱,用离子方程式表示为:盐中的弱离子+水_____。


《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们要知道,盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
比如说,氯化铵(NH₄Cl)在水溶液中,NH₄⁺会和水电离出的OH⁻结合形成弱电解质一水合氨(NH₃·H₂O),使得溶液中 c(H⁺)> c(OH⁻),溶液呈酸性。
而碳酸钠(Na₂CO₃)在水溶液中,CO₃²⁻会和水电离出的 H⁺结合形成碳酸氢根离子(HCO₃⁻),使得溶液中 c(OH⁻)> c(H⁺),溶液呈碱性。
二、盐类水解的特点1、可逆性盐类的水解反应是可逆的,存在水解平衡。
以醋酸钠(CH₃COONa)为例,CH₃COO⁻与 H₂O 电离出的 H⁺结合生成 CH₃COOH,同时 CH₃COOH 也会电离出 CH₃COO⁻和H⁺,水解和电离是一个动态的平衡过程。
2、吸热性盐类的水解反应是吸热反应,升高温度会促进水解。
这是因为温度升高,水解平衡向正反应方向移动,水解程度增大。
3、微弱性盐类的水解程度一般都比较小。
例如,即使是碳酸钠这样的强碱弱酸盐,其水解产生的氢氧根离子浓度也相对较小,溶液的碱性并不是特别强。
三、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
比如氯化钠(NaCl),钠离子和氯离子对应的酸和碱都是强酸强碱,所以不会水解。
而醋酸铵(CH₃COONH₄),其中的醋酸根离子和铵根离子分别对应的醋酸和一水合氨是弱酸和弱碱,所以会发生水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性弱于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子对应的碱是强碱,阴离子对应的酸是弱酸时,溶液显碱性;反之,溶液显酸性。



第八章 第三节 盐类的水解一、选择题(本题包括10小题,每小题5分,共50分)1.(2009·天津高考)25℃时,浓度均为0.2 mol/L 的NaHCO 3和Na 2CO 3溶液中,下列 判断不.正确的是 ( ) A .均存在电离平衡和水解平衡B .存在的粒子种类相同C .c (OH -)前者大于后者D .分别加入NaOH 固体,恢复到原温度,c (CO 2-3)均增大解析:A 项,两种溶液中均存在着水的电离平衡,NaHCO 3溶液中还存在:HCO -3 H ++CO 2-3及HCO -3+H 2O H 2CO 3+OH -,Na 2CO 3溶液中还存在有CO 2-3+H 2OHCO -3+OH -,故A 正确.B 项,两种溶液中均存在Na +、CO 2-3、HCO -3、H 2CO 3、OH -、H +、H 2O ,B 正确.C 项,浓度相同时,CO 2-3水解程度大于HCO -3,故Na 2CO 3溶液中c (OH -)要大,故C 错.D 项,NaHCO 3溶液中加入NaOH 固体:HCO -3+OH -===H 2O +CO 2-3,c (CO 2-3)增大,Na 2CO 3溶液中加入NaOH ,导致CO 2-3的水解平衡向左移动,c (CO 2-3)增大,故D 正确.答案:C2.下列有关问题,与盐的水解有关的是 ( ) ①NH 4Cl 与ZnCl 2溶液可作焊接金属中的除锈剂②用NaHCO 3与Al 2(SO 4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl 3溶液得到Al(OH)3固体A .①②③B .②③④C .①④⑤D .①②③④⑤解析:①中NH 4Cl 与ZnCl 2溶液水解均显酸性,可除去金属表面的锈;②HCO -3与Al 3+水解相互促进,产生二氧化碳,可作灭火剂;③草木灰的主要成分碳酸钾水解显碱性,而铵态氮肥水解显酸性,因而不能混合施用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏结,因此盛放碳酸钠的试剂瓶应用橡胶塞;⑤AlCl 3溶液中存在水解平衡:AlCl 3+3H 2O Al(OH)3+3HCl ,加热时,HCl 挥发使平衡不断右移,最终得到Al(OH)3固体.答案:D3.用一价离子组成的四种盐溶液:AC、BD、AD、BC,其物质的量浓度分别为1 mol/L,在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则正确的是()解析:强酸强碱盐不水解,溶液呈中性;强酸弱碱盐,溶液呈酸性;强碱弱酸盐,溶液呈碱性;弱酸弱碱盐,溶液可能呈中性、酸性,也可能呈碱性.根据题意,AOH 为强碱,BOH为弱碱;HC为强酸,HD为弱酸.答案:A4.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为() A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大解析:在CH3COONa溶液中存在平衡:CH3COO-+H2OCH3COOH+OH-.加入NH4NO3固体促进了CH3COO-水解,平衡右移,CH3COO-浓度减小;加入Na2SO3抑制了CH3COO-水解,平衡左移,CH3COO-浓度增大;加入FeCl3促进了CH3COO-的水解,平衡右移,CH3COO-浓度减小.答案:A5.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB 混合溶液中,下列排序正确的是() A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)解析:酸越弱,对应的盐的水解程度越大,同浓度的NaA和NaB的溶液中,前者水解程度更大,因此HA的浓度更大一些,D项错误;盐的水解程度很弱,故c(OH-)不可能大于c(A-)和c(B-),故B、C错误.答案:A6.关于氯化铁水解的说法错误的是() A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸解析:增大FeCl3的浓度,平衡正向移动,但水解程度减小,加水稀释,平衡正向移动,水解程度增大,A、B均正确;水解是吸热反应,温度升高,水解程度增大,C错误;Fe3+水解显酸性,增大H+浓度可抑制Fe3+的水解,D正确.答案:C7.(2009·广东高考)下列浓度关系正确的是() A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)D.Na2CO3溶液中:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+)解析:A项,氯水中只有部分Cl2与水作用,生成HCl和HClO,Cl2的浓度与其他粒子浓度的关系无法确定,A错误.B项应为:c(H+)>c(Cl-)>c(ClO-)>c(OH-).C 项,氢氧化钠与醋酸恰好完全中和,生成的醋酸钠水解呈碱性,c(OH-)>c(H+),根据电荷守恒,c(Na+)>c(CH3COO-).答案:D8.下列溶液中有关物质的量浓度关系正确的是() A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(H+)+c(CH3COOH)D.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH -)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C 中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)②,将①×2-②得:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(H+)>c(A2-)>c(H2A).答案:A9.(2009·绍兴质检)能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是() ①将水加热煮沸②向水中投入一小块金属钠③向水中通CO2④向水中加入明矾晶体⑤向水中加NaHCO3固体⑥向水中加NaHSO4固体A.①②④⑤B.①④⑤C.③④⑤D.④解析:将水加热可以促进水的电离,但c(H+)=c(OH-);钠与水反应,溶液中c(OH -)增大,抑制水的电离;向水中通入二氧化碳、加入硫酸氢钠,溶液中的c(H+)增大,抑制水的电离;向水中加入碳酸氢钠,HCO-3与水电离出的氢离子结合,促进水的电离,但c(H+)<c(OH-);加入明矾晶体,铝离子与水电离出的氢氧根离子结合生成氢氧化铝,促进了水的电离,且c(H+)>c(OH-).答案:D10.室温下,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是()A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.在D点:c(CH3COO-)+c(CH3COOH)=0.1 mol/L解析:根据电荷守恒,可知A正确;CH3COOH是弱酸,若使两者反应后的溶液pH=7,则应该使CH3COOH稍过量,B正确;在C点c(H+)>c(OH-),再根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(CH3COO-)>c(Na+),C错误;在D点共加入CH3COOH的物质的量为0.025 L×0.2 mol/L,反应后一部分变为CH3COO-,另一部分依然为CH3COOH分子,溶液体积为0.05 L,故根据物料守恒,可以确定c(CH3COO-)+c(CH3COOH)=0.1 mol/L.答案:C二、非选择题(本题包括4小题,共50分)11.(11分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性).A.固体CH3COOK B.固体CH3COONH4C.气体NH3D.固体NaHCO3(2)若________的解释正确(填“甲”或“乙”),溶液的pH应________(填“增大”“减小”或“不变”).(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:①溶液中共有________种粒子;②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.解析:由题意知,要判断甲、乙两种解释正确与否,可加入一种含有CH3COO-而不显碱性的盐,如CH3COONH4,其溶液呈中性,从水解的角度看对醋酸溶液的pH 变化无影响;但CH3COONH4电离产生的CH3COO-可使醋酸的电离平衡CH3COOHCH3COO-+H+向左移动,c(H+)减小,pH增大.从而说明甲不正确,乙正确.因发生反应CH3COONa+HCl===CH3COOH+NaCl得到0.006 mol CH3COONa,0.004 mol CH3COOH和0.004 mol NaCl的混合溶液,其中含有CH3COO -、Na+、H+、Cl-、OH-、CHCOOH和H2O,共7种粒子.3由物料守恒知n(CH3COO-)+n(CH3COOH)=0.01 mol,由电荷守恒可得n(Na+)+n(H+)=n(CH3COO-)+n(Cl-)+n(OH-),n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.01 mol-0.004 mol=0.006 mol.答案:(1)B(2)乙增大(3)①7②CH3COOH CH3COO-③0.00612.(12分)现有①0.2 mol/L NaOH溶液②0.2 mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-).则:(1)①中由水电离出的c(OH-)________②中由水电离出的c(H+)(填“>”、“=”或“<”).(2)上述混合液中共存在________种粒子.且:c(HX)________c(X-)(填“>”、“=”或“<”,下同).c(HX)+c(X-)________0.1 mol/L(忽略体积变化)请根据电荷守恒写出一个用离子浓度表示的等式:____________________________________________________________________.(3)上述混合液显________性(填“酸”、“碱”或“中”),其原因用离子方程式表示________________________________________________________________________.解析:NaOH溶液与HX溶液等浓度、等体积混合,二者恰好完全中和,所得溶液中c(Na+)>c(X-),说明X-水解,即HX为弱酸.(1)HX溶液中c(H+)对水电离的影响程度小于NaOH溶液中c(OH-)对水电离的影响程度.(2)混合溶液中应存在Na+、X-、H+、OH-、H2O、HX六种粒子.由于水解程度较小,故c(HX)<c(X-),由物料守恒知c(HX)+c(X-)=0.1 mol/L.答案:(1)<(2)6<=c(Na+)+c(H+)=c(OH-)+c(X-)(3)碱X-+H2OX+OH-13.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:请回答:(1)从①组实验分析,HA是强酸还是弱酸________.(2)②组实验表明,c__________0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是__________________.(3)从③组实验结果分析,说明HA的电离程度______________NaA的水解程度(填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________________.(4)①组实验所得混合溶液中由水电离出的c(OH-)=________mol/L.写出该混合溶液中下列算式的精确结果(不能作近似计算).c(Na+)-c(A-)=________ mol/L;c(OH-)-c(HA)=________mol/L.解析:(1)从①组情况分析,等体积等物质的量浓度的HA和NaOH溶液混合后,溶液显碱性,说明生成强碱弱酸盐,即HA是弱酸.(2)②组中NaOH溶液的浓度为0.2 mol/L,混合后溶液显中性,说明HA稍过量,HA 的物质的量浓度应大于0.2 mol/L.根据电荷守恒可得c(Na+)+c(H+)=c(A-)+c(OH-),溶液pH=7,呈中性c(H+)=c(OH-),则c(A-)=c(Na+).(3)第③组实验相当于等体积等物质的量浓度的HA和NaA混合,pH<7说明HA的电离程度大于NaA的水解程度,溶液中离子浓度由大到小的顺序是c(A-)>c(Na +)>c(H+)>c(OH-).(4)①组实验所得混合溶液中的pH=9,则c(OH-)=10-5 mol/L,水电离出的c(H+)=c(OH-)=10-5 mol/L.由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9) mol/L,由A-―→HA,OH-H2O―→H3O+可得质子守恒关系式c(OH-)=c(HA)+c(H+),所以c(OH-)-c(HA)=c(H+)=10-9 mol/L.答案:(1)弱酸(2)大于c(A-)=c(Na+)(3)大于c(A-)>c(Na+)>c(H+)>c(OH-)(4)10-510-5-10-910-914.(13分)Ⅰ.已知盐酸和氨水混合后,其溶液中只存在OH-、H+、NH+4、Cl-四种带电离子,某同学推测其离子浓度大小顺序有以下几种:①c(Cl-)>c(NH+4)>c(H+)>c(OH-)②c(Cl-)>c(NH+4)>c(OH-)>c(H+)③c(NH+4)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH+4)>c(OH-)⑤c(NH+4)=c(Cl-)>c(OH-)=c(H+)则:(1)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为____________(填序号).(2)若关系③正确,则溶液中溶质为________________.(3)25℃时,pH=a的盐酸V a mL与pH=14-a的氨水V b mL混合,若溶液显中性,则V a________V b(填“>”、“<”、“=”或“无法确定”).Ⅱ.(1)氨催化氧化生成NO,NO氧化生成二氧化氮,二氧化氮转化成硝酸的循环氧化总反应为:4NO2+O2+2H2O4HNO3(aq)(正反应放热),工业上为了提高硝酸产量,最适宜采取的措施是________.A.升温B.降温C.增大压强D.充入足量空气E.减小压强(2)在硝酸溶液中缓慢通入氨气,溶液中粒子浓度关系一定错误的是________.A.c(NH+4)+c(H+)=c(OH-)+c(NO-3)B.c(NO-3)>c(NH+4)>c(H+)>c(OH-)C.c(NH+4)>c(NO-3)>c(H+)>c(OH-)D.c(H+)>c(NO-3)>c(OH-)>c(NH+4)E.c(NO-3)=c(NH3)+c(NH3·H2O)+c(NH+4)F.c(NH+4)=c(NO-3)解析:Ⅰ.(1)中,由于水可以电离出H+、OH-,所以溶质为NH4Cl;由于铵根离子的水解而使溶液显酸性,溶液中的氯离子浓度大于铵根离子浓度,故该溶液中离子浓度的大小关系为c(Cl-)>c(NH+4)>c(H+)>c(OH-).(2)中,因为关系③正确,则溶液中除含有NH4Cl外还应含有NH3·H2O.(3)中,pH=a的盐酸中c(H+)=10-a,pH=14-a的氨水中c(OH-)=10-a,若V a=V b则混合前盐酸中H+的物质的量与氨水中OH-的物质的量相等,因为氨水为弱碱不完全电离,故c(HCl)<c(NH3·H2O),混合后溶液显碱性,因此若溶液显中性,必须V a>V b.Ⅱ.(1)工业上最适宜措施是“多、快、省”,省即降低成本,所以应选D,不应选C,增大压强,对设备材料、动力要求高,要提高成本.(2)在硝酸溶液中通入氨气,溶液可能显酸性(HNO3+NH4NO3,NH4NO3)、中性(NH4NO3+较少的NH3·H2O)、碱性(NH4NO3+较多的NH3·H2O).在硝酸溶液中通入氨气,溶液中离子只有四种:NH+4、NO-3、H+、OH-.根据电荷守恒知,A正确;若c(H+)>c(OH-),则c(NO-3)>c(NH+4),B正确,C错误;硝酸溶液中H+与NO-3浓度相等,通入氨气后,中和了H+,H+浓度不可能大于NO-3浓度,所以D错误;当恰好完全反应生成硝酸铵时(NH3与HNO3物质的量之比为1∶1),E正确;当溶液呈中性时F正确.答案:Ⅰ.(1)NH4Cl①(2)NH4Cl和NH3·H2O(3)>Ⅱ.(1)D(2)CD。