第三节盐类的水解
- 格式:doc
- 大小:107.50 KB
- 文档页数:14


第三节 盐类的水解强酸强碱盐;如:KNO 3、NaCl 盐强酸弱碱盐;如:NH 4Cl 、Al 2(SO 4)3强碱弱酸盐;如:CH 3COONa 、Na 2CO 3 弱酸弱碱盐;如:CH 3COONH 4、NH 4ClO我们用pH 试纸检验CH 3COONa 、Na 2CO 3、NH 4Cl 、Al 2(SO 4)3、NaCl 、KNO 3溶液的酸碱性。
可以发现如下结论:强碱弱酸所生成盐的水溶液呈碱性;强酸弱碱所生成盐的水溶液呈酸性;强酸强碱所生成盐的水溶液呈中性。
观念变更:并不是所有的正盐溶液都是呈中性的。
二、盐类水解的概念和实质:⑴盐类水解的定义:在溶液中盐电离出来的离子跟水所电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
⑵盐类水解的本质:盐中的弱离子和水所电离出的H +或OH -结合生成弱电解质,打破了水的电离平衡,从而使溶液呈现出酸性或碱性。
盐类水解后生成酸和碱,所以盐类水解反应可看成是酸碱中和反应的逆反应。
注意:只有弱酸的阴离子或弱碱的阳离子才能与H +或OH -结合生成弱电解质。
三、盐类的水解平衡⑴水解反应和中和反应互为逆反应,当水解反应的速率与中和反应的速率相等时,反应处于平衡状态,这就是盐类的水解平衡。
大多数水解反应相对于中和反应而言程度很小。
如CH 3COONa 溶于水,只有很少一部分CH 3COO —水解。
但也有少部分盐完全水解。
如Al 2S 3溶于水完全水解生成Al(OH)3和H 2S 。
⑵影响盐类水解的条件①温度:因盐的水解是吸热反应,升温可以促进水解,使水解平衡向右移动,水解程度增大。
②盐本身的浓度:稀释盐溶液可以促进水解,平衡向右移动,水解程度增大;如果增大盐的浓度,水解平衡虽然向右移动,但水解程度减小。
③酸碱溶液的影响:酸和碱能促进或抑制盐类的水解。
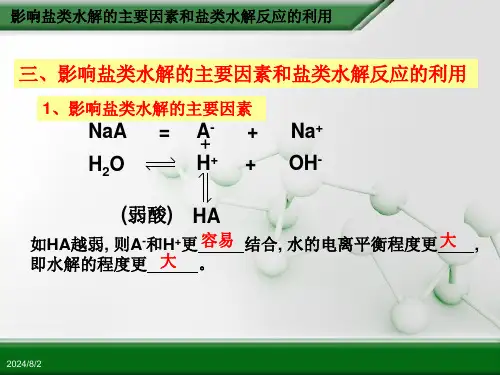
例如:不同条件对FeCl3水解平衡的影响:Fe3+ + 3H2O Fe(OH)3 + 3H+;△H<0(黄褐色)(红褐色)条件移动方向n H+C H+Fe3+水解率现象升温右移增大增大增大颜色变深通HCl 左移增大增大减小颜色变浅加H2O 右移增大减小增大颜色变浅浓缩左移减少增大减小颜色变深FeCl3右移增大增大减小颜色变深加NaOH 右移减少减小增大红褐色沉淀四、盐类水解的反应规律⑴组成盐的弱碱阳离子(M+)能水解显酸性:M+ + H2O MOH + H+组成盐的弱酸阴离子(R—)能水解显碱性:R—+ H2O HR + OH—⑵水解规律:有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。




第三章第三节第一课时盐类的水解一:盐的水解及其规律1.概念在溶液中盐电离出来的离子跟__________________结合生成__________的反应。
2.实质盐电离出的“弱离子”与水电离的H+或者OH-结合生成弱电解质分子,使水的电离平衡正向移动.3.特点①可逆。
盐水解是反应的逆反应。
所有可逆反应最终都是平衡态,水解平衡也有等、动、定、变等特征。
②吸热。
中和放热,所以水解都。
③微弱。
中和反应程度大,所以一般盐水解反应程度都很小。
4.影响盐水解的因素什么样的盐能水解?什么样的盐水解程度大?(1)盐的性质①含有弱酸阴离子或者弱碱阳离子的盐才能水解。
都含有更能水解。
----有弱才水解②盐水解生成的弱电解质分子越难以电离,盐水解程度越大。
---越弱越水解比如:CO2-3可以水解生成HCO-3,HCO-3也可以水解生成H2CO3 分子。
HCO比H2CO3 分子更难电离,所以CO2-3比HCO-3更能水解,水解程度更大。
【思考】同浓度的Na2CO3和CH3COONa溶液相比,谁的pH较大?为什么?同浓度的Na2CO3和NaHCO3相比呢?pH相同的NaHCO3溶液和CH3COONa溶液和NaClO溶液,浓度大小顺序是?③若是弱酸强碱盐,则水解后呈碱性。
弱碱强酸盐,则水解后呈酸性。
---谁强显谁性若是强酸强碱盐,不水解后显中性。
弱碱弱酸盐,显性具体定。
(2)外界条件对水解平衡的影响--【思考】①0.1mol/L的Na2CO3 溶液的碱性比0.01mol/L的Na2CO3 溶液(强/弱)?②0.1mol/L的Na2CO3 溶液的pH假设等于12,0.01mol/L的Na2CO3 溶液的 pH 11.(> < =).③配制氯化亚铁溶液一般加入少量铁粉和稀盐酸,试说明分别为什么?5.盐水解规律小结有弱才水解,越弱越水解;谁强显谁性。
难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。




第三节 盐类的水解一、盐类的水解:CH 3COONa 溶于水之后,完全电离。
(因为CH 3COONa 是强电解质。
)CH 3COONa ═ CH 3COO - + Na +………⑴把CH 3COONa 溶于水之后,溶液中存在哪些电离平衡?H 2O H + + OH -………⑵我们知道,CH 3COOH 是一种弱酸,在溶液中部分电离,溶液中既然存在CH 3COO -和H +,根据,可逆反应,反应物和生成物同时共存,那么就一定有___________。
CH 3COO - + H +CH 3COOH………⑶把⑴⑵⑶式联立,可得到水解方程式:CH 3COONa + H 2O CH 3COOH + NaOH这说明CH 3COONa 溶于水后,反应有NaOH 生成,所以溶液显碱性。
把上述化学方程式改写成离子方程式。
____________________________________盐类水解方程式书写注意点1、盐类水解是可逆反应,写方程式要用“”2、一般盐类水解程度很小,生成的弱酸或弱碱浓度很小,通常生成气体或沉淀也不发生水解,书写时产物不用________和_________。
3、多元弱酸生成的盐水解时,生成弱酸过程应分步表示,以第一步为主。
随着CH 3COONa 的加入,促进了水的电离,可以看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
1、盐类水解定义:在溶液中______电离出来的离子跟_____所电离出来的H + 或 OH -结合生成______电解质的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质弱酸或弱碱,破坏了水的电离平衡,使其平衡向_______移动,引起氢离子或氢氧根离子浓度的变化。
) 酸 + 碱盐 + 水 2、盐类水解的本质:弱酸的阴离子和弱碱的阳离子和水电离出的H +或OH -离子结合生成弱电解质,促进了水的电离。
第三节盐类的水解第一课时知识目标:1、使学生明白得盐类水解的本质及盐类水解对溶液酸、碱性的阻碍及变化规律。
2、盐类水解的离子方程式与化学方程式。
能力目标:1、培养学生分析咨询题的能力,使学生学会透过现象看本质。
2、培养学生归纳思维能力和逻辑推理能力。
3、培养学生的实验技能,对学生进行科学态度和科学方法教育。
美育目标:通过对盐类水解规律的总结,体会自然万物变化的丰富多彩。
教学重点:盐类水解的本质,明白得强酸弱碱盐和强碱弱酸盐的水解的规律。
教学难点:盐类水解方程式的书写和分析。
教学方法:启发式实验引导法教学过程:复习提咨询:当溶液中,c(H+) = c(OH-) 中性,常温下,pH = 7c(H+) < c(OH-) 碱性,常温下,pH > 7c(H+) < c(OH-) 酸性,常温下,pH < 7酸的溶液显酸性,碱的溶液显碱性,那么酸与碱反应生成的盐,溶液显什么性?讲解:同学们,实验是我们探求未知咨询题的好方法,下面我们做一个实验来看看,将盐溶于水后,溶液的酸碱性到底如何呢?实验:①取少量CH3COONa溶于水,滴加几滴酚酞试剂,观看颜色变化。
②取少量NH4Cl溶于水,滴加几滴紫色石蕊试剂,观看颜色变化。
③取少量NaCl,溶于水,找一名同学测一下pH值。
注:关于②能够做一个对比,清水中加几滴紫色石蕊试剂,进行比较。
结论:①CH3COONa 碱性②NH4Cl 酸性③NaCl 中性学生实验:用PH试纸检验Na2CO3、Al2(SO4)3、KNO3溶液的酸碱性。
讨论:由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?小结:盐的组成与盐溶液酸碱性的关系:强碱弱酸盐的水溶液显碱性强酸弱碱盐的水溶液显酸性强酸强碱盐的水溶液显中性讲述:下面我们分不来研究不同类盐的水溶液酸碱性不同的缘故。
同学活动:请同学们讨论一下第一个咨询题,什么缘故CH3COONa水溶液呈碱性呢?醋酸钠、氯化钠差不多上盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,而纯水中[H+]=[OH-],显中性。
而实际上醋酸钠显碱性,即[H+]<[OH-],氯化铵溶液显酸性,即[H+]>[OH-]板书:一、盐类的水解:讲解:CH3COONa溶于水之后,完全电离。
〔因为CH3COONa是强电解质。
〕板书:CH3COONa ═ CH3COO- + Na+………⑴引导:把CH3COONa溶于水之后,溶液中存在哪些电离平稳?板书: H 2O H+ + OH-………⑵讲解:我们明白,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,依照,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
板书:CH 3COO- + H+ CH3COOH………⑶讲解:把⑴⑵⑶式联立,可得到板书:水解方程式:CH 3COONa + H 2O CH 3COOH + NaOH讲解:这讲明CH 3COONa 溶于水后,反应有NaOH 生成,因此溶液显碱性。
学生活动:把上述化学方程式改写成离子方程式。
板书:CH 3COO - + H 2O CH 3COOH + OH -讲明:盐类水解方程式书写注意点1、盐类水解是可逆反应,写方程式要用〝〞2、一样盐类水解程度专门小,生成的弱酸或弱碱浓度专门小,通常生成气体或沉淀也不发生水解,书写时产物不用〝↑〞和〝↓〞。
3、多元弱酸生成的盐水解时,生成弱酸过程应分步表示,以第一步为主。
讲解:随着CH 3COONa 的加入,对水的电离有什么阻碍呢?促进了水的电离,能够看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
板书:1、盐类水解定义:在溶液中盐电离出来的离子跟水所电离出来的H + 或 OH -结合生成弱电解质的反应,叫做盐类的水解。
〔在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质弱酸或弱碱,破坏了水的电离平稳,使其平稳向右移动,引起氢离子或氢氧根离子浓度的变化。
〕酸 + 碱 盐 + 水板书:2、盐类水解的本质:弱酸的阴离子和弱碱的阳离子和水电离出的H +或OH -离子结合生成弱电解质,促进了水的电离。
讲明:1、只有弱酸的阴离子或弱碱的阳离子才能与H + 或 OH -结合生成弱电解质。
2、盐类水解使水的电离平稳发生了移动,并使溶液呈酸性或碱性。
中和水解3、盐类水解反应是酸碱中和反应的逆反应。
练习:试分析NH4Cl水解呈酸性的缘故讲解:CH3COONa能够看作是弱酸CH3COOH和强碱NaOH生成的盐,这种盐叫做强碱弱酸盐。
板书:二、盐类水解的类型1、强碱弱酸盐水解〔CH3COONa〕CO32-,PO43-,S2-,SO32-,ClO-,F-讲解:由强碱和弱酸反应生成的盐,称为强碱弱酸盐,含有以上弱酸根的盐,常会发生水解。
讨论:分析Na2CO3的水解过程,写出有关反应的离子方程式。
板书: Na2CO3的水解第一步: CO 32-+H2O HCO3-+OH-〔要紧〕第二步:HCO 3- +H2O H2CO3 +OH-〔次要〕分析:关于多元弱酸来讲,水解要分步写。
提咨询:该水解反应能放出CO2吗?不能,因为如此的水解程度都专门小。
练习:写出K2S水解的化学方程式和离子方程式。
过渡:下面请同学们讨论一下第二个咨询题。
什么缘故NH4Cl水溶液呈酸性?学生活动:找一名同学回答,并到黑板上写出分析过程。
总结:NH4Cl能够看作是强酸HCl和弱碱NH3·H2O反应生成的盐,我们把这种盐叫做强酸弱碱盐。
类似如此的盐还有Al2(SO4)3、FeCl3、CuSO4等。
板书:2、强酸弱碱盐〔NH4Cl〕Al3+,Fe3+,Cu2+练习:写出Al2(SO4)3水解的离子方程式。
Al3+ + 3H2O Al(OH)3 + 3H+Cu〔NO3〕2 Al2〔SO4〕3〔NH4〕2SO4 AgNO3讨论:以NaCl为例,讲明强碱强酸盐能否水解。
小结:由于NaCl电离出的Na+和Cl-都不能与水电离出来的H+或 OH-结合生成弱电解质,因此强碱强酸盐不能水解,可不能破坏水的电离平稳,因此其溶液显中性。
板书:3、强酸强碱盐、难溶于水的盐不水解板书:4、弱酸弱碱盐〔NH4Ac〕由于一水合氨和醋酸的电离度相近,因此铵离子、醋酸跟离子水解程度相近,从二溶液显中性。
板书:5、混合盐溶液〔酸式盐溶液〕过渡:那么,我们在书写水解离子方程式时,要注意哪些咨询题?讨论:请大伙儿依照我们刚才书写水解方程式的方法,讲讲书写时,要注意哪些咨询题?练习:FeCl3、NaHCO3水解的离子方程式及化学方程式。
投影总结:各类盐水解的比较。
板书:三、阻碍水解的因素:内因:盐类本身的性质这是阻碍盐类水解的内在因素。
组成盐的酸或碱越弱,盐的水解程度越大,其盐溶液的酸性或碱性就越强。
〝无弱不水解,有弱即水解,越弱越水解,谁强显谁性〞外因:1、温度由于盐的水解作用是中和反应的逆反应,因此盐的水解是吸热反应,温度升高,水解程度增大。
2、浓度溶液浓度越小,实际上是增加了水的量,可使平稳相正反应方向移动,使盐的水解程度增大。
〔最好用勒沙特例原理中浓度同时减小的原理来讲明〕3、溶液的酸碱性盐类水解后,溶液会出现不同的酸碱性。
因此,操纵溶液的酸碱性能够促进或抑制盐的水解。
如在配制FeCl3溶液经常加入少量盐酸来抑制FeCl3水解。
盐的离子与水中的氢离子或氢氧根离子结合的能力的大小,组成盐的酸或碱的越弱,盐的水解程度越大。
过渡:水解反应有什么应用呢?引入:大伙儿明白泡沫灭火器的灭火原理吗?它确实是利用Al2(SO4)3和NaHCO3溶液反应,产生二氧化碳来灭火的。
那么Al2(SO4)3和NaHCO3是如何反应?讨论:Al3+ 和HCO3-在水溶液中能大量共存吗?分析:Al3+易结合水电离出的OH-,HCO3-易结合水电离出的H+,两者在水溶液中会发生强烈的双水解,反应进行得专门完全。
Al3++ 3HCO3-= Al(OH)3↓+3CO2↑(反应前有水参加,反应后又有水生成)讲述:在我们的生活中,有时也会碰到一些咨询题或观看到一些现象,你有没有想过要去分析它,找出其中的缘故呢?比如,有一次我在实验室配制FeCl3溶液时,放置一段时刻后溶液难道变浑浊,大伙儿能讲明一下是什么缘故?〔FeCl3发生了水解,生成了Fe(OH)3,使溶液变浑浊了。
〕设疑:那么如何配制FeCl3溶液?如何防止它的水解?〔Fe3+ + 3H2O Fe(OH)3↓+3 H+ ,往配制的溶液中加入少量稀盐酸 ,使平稳向逆进行,能够防止FeCl3的水解〕摸索:如何配制FeCl2溶液?K2CO3和NH4Cl这两种肥料能混合使用?混合使用的成效好吗?板书:四、水解的应用1、离子共存:Al3+ 和HCO3-讲明双水解反应能进行到底。
2、溶液配置:FeCl3的配制3、化肥的使用K2CO3和NH4Cl等例:判定溶液的pH值:1、强酸弱碱盐、强碱弱酸盐等。
2、如何对比NaX、NaY、NaZ的碱性。
;酸性HX»HY»HZ3、如何对比碳酸钠、碳酸氢钠的碱性。
4、氯化铝、偏铝酸钠、氯化铁分不蒸干灼烧后的产物是什么?与盐类水解有关的应用:1、明矾的净水作用2、热碳酸钠溶液的洗涤力强3、制备氢氧化铁胶体4、氯化铵溶液中加入镁粉产生氢气5、蒸发氯化铁溶液,不能得到纯绿化铁6、焊接时可用氯化锌、氯化铵溶液除锈7、配制氯化铁溶液时需加少量盐酸8、泡沐灭火器的反应原理9、比较盐溶液的PH 值大小判定溶液中离子浓度大小例如:相同物质的量浓度、相同体积的醋酸和氢氧化钠中和,所得溶液中离子浓度由大到小的顺序是:1、判定离子是否共存2、酸式盐溶液酸碱性的判定某些肥料不宜混合使用。
〔如:草木灰、碳酸铵、重钙等〕练习:1、判定以下盐溶液的酸碱性,假设该盐能水解,写出其水解反应的离子方程式。
〔1〕KF 〔2〕NH 4NO 3 〔3〕Na 2SO 4 〔4〕CuSO 4例1、浓度为0.1mol/L 的八种溶液:①HNO 3 ②H 2SO 4 ③CH 3COOH ④Ba(OH)2 ⑤NaOH ⑥CH 3COONa ⑦KCl ⑧NH 4Cl ,其pH 值由小到大的顺序为〔②①③⑧⑦⑥⑤④〕。
分析:以上八种溶液浓度相同,因此可按以下顺序进行排列:多元强酸、一元强酸、一元弱酸、水解后显酸性的盐溶液,水解后显中性的盐溶液或不水解的正盐溶液、水解后显碱性的盐溶液、一元弱碱、一元强碱、多元强碱。
例2、室温下pH=9的NaOH 溶液和pH=9的CH 3COONa 溶液中,设由水电离产生的OH -的物质的量溶液分不为Amol/L 和Bmol/L ,那么A 和B 的关系为〔A:B=10-4:1〕。