第三节:盐类的水解
- 格式:ppt
- 大小:914.00 KB
- 文档页数:50



第三节 盐类的水解强酸强碱盐;如:KNO 3、NaCl 盐强酸弱碱盐;如:NH 4Cl 、Al 2(SO 4)3强碱弱酸盐;如:CH 3COONa 、Na 2CO 3 弱酸弱碱盐;如:CH 3COONH 4、NH 4ClO我们用pH 试纸检验CH 3COONa 、Na 2CO 3、NH 4Cl 、Al 2(SO 4)3、NaCl 、KNO 3溶液的酸碱性。
可以发现如下结论:强碱弱酸所生成盐的水溶液呈碱性;强酸弱碱所生成盐的水溶液呈酸性;强酸强碱所生成盐的水溶液呈中性。
观念变更:并不是所有的正盐溶液都是呈中性的。
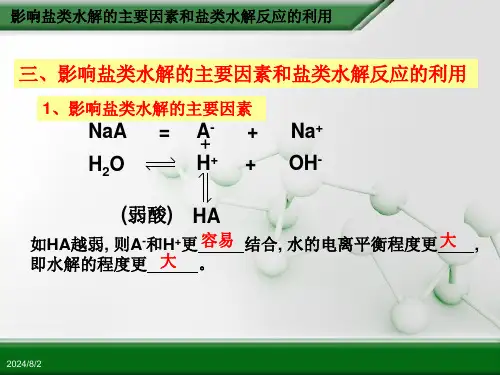
二、盐类水解的概念和实质:⑴盐类水解的定义:在溶液中盐电离出来的离子跟水所电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
⑵盐类水解的本质:盐中的弱离子和水所电离出的H +或OH -结合生成弱电解质,打破了水的电离平衡,从而使溶液呈现出酸性或碱性。
盐类水解后生成酸和碱,所以盐类水解反应可看成是酸碱中和反应的逆反应。
注意:只有弱酸的阴离子或弱碱的阳离子才能与H +或OH -结合生成弱电解质。
三、盐类的水解平衡⑴水解反应和中和反应互为逆反应,当水解反应的速率与中和反应的速率相等时,反应处于平衡状态,这就是盐类的水解平衡。
大多数水解反应相对于中和反应而言程度很小。
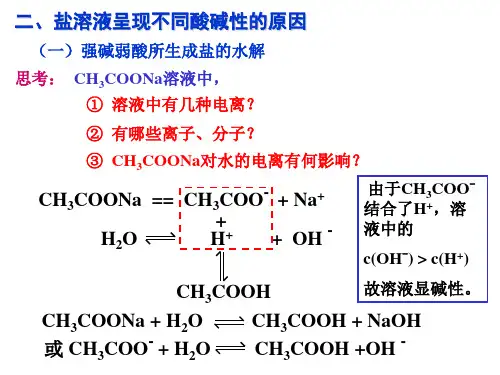
如CH 3COONa 溶于水,只有很少一部分CH 3COO —水解。
但也有少部分盐完全水解。
如Al 2S 3溶于水完全水解生成Al(OH)3和H 2S 。
⑵影响盐类水解的条件①温度:因盐的水解是吸热反应,升温可以促进水解,使水解平衡向右移动,水解程度增大。
②盐本身的浓度:稀释盐溶液可以促进水解,平衡向右移动,水解程度增大;如果增大盐的浓度,水解平衡虽然向右移动,但水解程度减小。
③酸碱溶液的影响:酸和碱能促进或抑制盐类的水解。
例如:不同条件对FeCl3水解平衡的影响:Fe3+ + 3H2O Fe(OH)3 + 3H+;△H<0(黄褐色)(红褐色)条件移动方向n H+C H+Fe3+水解率现象升温右移增大增大增大颜色变深通HCl 左移增大增大减小颜色变浅加H2O 右移增大减小增大颜色变浅浓缩左移减少增大减小颜色变深FeCl3右移增大增大减小颜色变深加NaOH 右移减少减小增大红褐色沉淀四、盐类水解的反应规律⑴组成盐的弱碱阳离子(M+)能水解显酸性:M+ + H2O MOH + H+组成盐的弱酸阴离子(R—)能水解显碱性:R—+ H2O HR + OH—⑵水解规律:有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。



第三章第三节第一课时盐类的水解一:盐的水解及其规律1.概念在溶液中盐电离出来的离子跟__________________结合生成__________的反应。
2.实质盐电离出的“弱离子”与水电离的H+或者OH-结合生成弱电解质分子,使水的电离平衡正向移动.3.特点①可逆。
盐水解是反应的逆反应。
所有可逆反应最终都是平衡态,水解平衡也有等、动、定、变等特征。
②吸热。
中和放热,所以水解都。
③微弱。
中和反应程度大,所以一般盐水解反应程度都很小。
4.影响盐水解的因素什么样的盐能水解?什么样的盐水解程度大?(1)盐的性质①含有弱酸阴离子或者弱碱阳离子的盐才能水解。
都含有更能水解。
----有弱才水解②盐水解生成的弱电解质分子越难以电离,盐水解程度越大。
---越弱越水解比如:CO2-3可以水解生成HCO-3,HCO-3也可以水解生成H2CO3 分子。
HCO比H2CO3 分子更难电离,所以CO2-3比HCO-3更能水解,水解程度更大。
【思考】同浓度的Na2CO3和CH3COONa溶液相比,谁的pH较大?为什么?同浓度的Na2CO3和NaHCO3相比呢?pH相同的NaHCO3溶液和CH3COONa溶液和NaClO溶液,浓度大小顺序是?③若是弱酸强碱盐,则水解后呈碱性。
弱碱强酸盐,则水解后呈酸性。
---谁强显谁性若是强酸强碱盐,不水解后显中性。
弱碱弱酸盐,显性具体定。
(2)外界条件对水解平衡的影响--【思考】①0.1mol/L的Na2CO3 溶液的碱性比0.01mol/L的Na2CO3 溶液(强/弱)?②0.1mol/L的Na2CO3 溶液的pH假设等于12,0.01mol/L的Na2CO3 溶液的 pH 11.(> < =).③配制氯化亚铁溶液一般加入少量铁粉和稀盐酸,试说明分别为什么?5.盐水解规律小结有弱才水解,越弱越水解;谁强显谁性。
难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。


