第三节 盐类的水解
- 格式:doc
- 大小:68.00 KB
- 文档页数:4



第三节 盐类的水解强酸强碱盐;如:KNO 3、NaCl 盐强酸弱碱盐;如:NH 4Cl 、Al 2(SO 4)3强碱弱酸盐;如:CH 3COONa 、Na 2CO 3 弱酸弱碱盐;如:CH 3COONH 4、NH 4ClO我们用pH 试纸检验CH 3COONa 、Na 2CO 3、NH 4Cl 、Al 2(SO 4)3、NaCl 、KNO 3溶液的酸碱性。
可以发现如下结论:强碱弱酸所生成盐的水溶液呈碱性;强酸弱碱所生成盐的水溶液呈酸性;强酸强碱所生成盐的水溶液呈中性。
观念变更:并不是所有的正盐溶液都是呈中性的。
二、盐类水解的概念和实质:⑴盐类水解的定义:在溶液中盐电离出来的离子跟水所电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
⑵盐类水解的本质:盐中的弱离子和水所电离出的H +或OH -结合生成弱电解质,打破了水的电离平衡,从而使溶液呈现出酸性或碱性。
盐类水解后生成酸和碱,所以盐类水解反应可看成是酸碱中和反应的逆反应。
注意:只有弱酸的阴离子或弱碱的阳离子才能与H +或OH -结合生成弱电解质。
三、盐类的水解平衡⑴水解反应和中和反应互为逆反应,当水解反应的速率与中和反应的速率相等时,反应处于平衡状态,这就是盐类的水解平衡。
大多数水解反应相对于中和反应而言程度很小。
如CH 3COONa 溶于水,只有很少一部分CH 3COO —水解。
但也有少部分盐完全水解。
如Al 2S 3溶于水完全水解生成Al(OH)3和H 2S 。
⑵影响盐类水解的条件①温度:因盐的水解是吸热反应,升温可以促进水解,使水解平衡向右移动,水解程度增大。
②盐本身的浓度:稀释盐溶液可以促进水解,平衡向右移动,水解程度增大;如果增大盐的浓度,水解平衡虽然向右移动,但水解程度减小。
③酸碱溶液的影响:酸和碱能促进或抑制盐类的水解。
例如:不同条件对FeCl3水解平衡的影响:Fe3+ + 3H2O Fe(OH)3 + 3H+;△H<0(黄褐色)(红褐色)条件移动方向n H+C H+Fe3+水解率现象升温右移增大增大增大颜色变深通HCl 左移增大增大减小颜色变浅加H2O 右移增大减小增大颜色变浅浓缩左移减少增大减小颜色变深FeCl3右移增大增大减小颜色变深加NaOH 右移减少减小增大红褐色沉淀四、盐类水解的反应规律⑴组成盐的弱碱阳离子(M+)能水解显酸性:M+ + H2O MOH + H+组成盐的弱酸阴离子(R—)能水解显碱性:R—+ H2O HR + OH—⑵水解规律:有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。



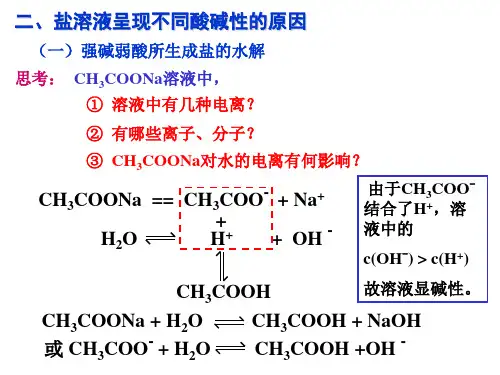
化学选修(xuǎnxiū)4第四章第三节《盐类的水解》知识总结化学(huàxué)选修4第四章第三节《盐类的水解》知识总结化学选修(xuǎnxiū)四第四章第3节《盐类的水解》知识总结一、探究(tànjiū)盐溶液的酸碱性强碱弱酸盐的水溶液,呈碱性(jiǎn xìnɡ);强酸弱碱盐的水溶液,呈酸性;强酸强碱盐的水溶液,呈中性。
二、盐溶液呈现不同酸碱性的原因弱酸强碱盐,水解显碱性a=CH3COO+Na++H2OH++OHa+H2H+NaO+H2H+OH强酸弱碱盐水解NH4Cl=NH4++Cl+H2OOH+H+NH3H2ONH4Cl+H2+HClNH4++H2+H+强酸强碱盐:不水解弱酸弱碱盐:双水解,水解程度增大。
1、盐类水解(hydrolysisofsalts):在溶液中,由于盐的离子与水电离出来的H+或OH-结合生成弱电解质的过程中。
2、盐类水解的实质:是酸碱中和反响的逆反响酸+碱盐+水3、盐类水解破坏了水的电离平衡,促进了水的电离4、盐类水解的类型及规律由强碱和弱酸反响生成的盐,称为强碱弱酸盐,含有以下〔a〕CO32-、PO43-、S2-、SO32-、ClO-、F-,弱酸根的盐,常会发生水解。
NH4Cl可以看作是强酸HCl和弱碱NH3H2O反响生成的盐,我们把这种盐叫做强酸弱碱盐。
类似这样的盐还有Al2(SO4)3、FeCl3、CuSO4等。
由于NaCl电离出的Na+和Cl-都不能与水电离出来的H+或OH-结合生成弱电解质,所以强碱强酸盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。
强酸强碱盐、难溶于水的盐不水解。
对于弱酸弱碱盐〔NH4Ac〕,由于一水合氨和醋酸的电离度相近,因此铵离子、醋酸跟离子水解程度相近,从二溶液显中性。
(1)有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。
(2)组成盐的酸越弱,水解程度越大例如,物质的量浓度相同的两种盐溶液,NaA和NaB,其溶液的pH前者大于后者,那么酸HA和HB的相对强弱为HB>HA,这条规律可用于利用盐的pH值判断酸性的强弱。



第三节盐类的水解上大附中何小龙一、盐类水解1、定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离3、盐类水解的规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na2CO3 >NaHCO3)3、影响盐类水解的外界因素:①温度:温度越高水解程度越大(水解吸热,越热越水解)②②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解促进阳离子水解而抑制阴离子水解)4、水解平衡常数○1对于强碱弱酸盐: =/ (为该温度下水的离子积,为该条件下该弱酸根形成的弱酸的电离平衡常数)○2对于强酸弱碱盐: =/(为该温度下水的离子积,为该条件下该弱碱根形成的弱碱的电离平衡常数)5、双水解反应(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进,水解程度较大,有的甚至水解完全。
使得平衡向右移。
(2)双水解反应特点是相互水解成沉淀或气体。
双水解完全的离子方程式配平依据是两边电荷平衡。
【习题一】(2018春•宾阳县校级月考)下列水解方程式正确的是()A.B.C.D.【考点】盐类水解的原理.【专题】盐类的水解专题.【分析】水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.【解答】解:A、水解是非常微弱的,水解方程式应该用“⇌”,且不能使用沉淀符号,故A错误;B、溴离子是强酸酸根离子不发生水解,故B错误;C、CH3COOH+H2O⇌CH3COO-+H3O+,是醋酸的电离方程式,不是水解离子方程式,故C错误;D、水解是非常微弱的,水解方程式应该用“⇌”,铵根离子水解生成一水合氨和氢离子,书写氢离子为水和氢离子得到离子方程式为NH4++2H2O⇌NH3•H2O+H3O+,故D正确。
