氧化还原反应中表示电子转移的方法.
- 格式:ppt
- 大小:234.00 KB
- 文档页数:10




【高中化学】高中化学知识点:氧化还原反应的表示方法氧化还原反应的表示:显示反应物中原子或离子之间电子转移的方向和数量。
表示方法:(1)双线桥法:该方法不仅能显示电子转移的方向和总数,还能显示元素价态的升降与氧化还原的关系。
双线桥的箭头从反应物中相关元素的原子或离子开始,箭头指向产品中相应元素的原子或离子或原子团,在价格变化后。
例如:注:箭头表示指向;标“得或失”;箭头表示反应前后变化,不表示电子转移方向(2)单线桥法:在氧化还原反应中,存在电子转移(增益/损耗或偏移),即反应物中存在元素电子增益/损耗或偏移。
此时,使用带有箭头的曲线指向电子丢失的元素,并在“桥”上标记转移的电子数。
这种表达方法称为单线桥法。
例如:注:箭头指向;不标“得或失”双线架桥法的步骤:(1)标变价:明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
(2)连接两条线:使用一条直线和一个箭头,将具有标准化合价的同一元素从反应物指向产物(注:箭头的开头和结尾需要元素到元素)(3)标得失:① 标准电子转移数或偏差数:以“增益/损耗中发生氧化还原反应的原子数”×每单位原子的电子数”的格式清楚地标记增益和损耗电子数②标化合价变化:一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等③ 标记元素的反应类型:标记元素的反应,“氧化”或“还原”,其他书写方法不正确④检查得失电子守恒:检查得失电子数是否相等,如不相等则重新分析。
单线桥法步骤:(1)价格状态:明确指出发生氧化还原反应的元素的价态(2)连单线:连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂(3)不要注意增益或损耗:标记转移电子的总数。
没有必要像双线电桥那样直接标记电子总数相关高中化学知识点:氧化还原反应的计算氧化还原反应的计算:(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。


氧化还原反应中电子转移数目的判断1.对于双箭桥表示法电子转移数表示为 :AxBe-形式。
其中A为反应前后化合价变化的原子个数;B=高价态-低价态,A=1 或B=1将1省略。
2.对于单箭桥表示法电子转移数表示为 Me 形式。
M=A×B,当 M=1 时,将1省略,A、B 的意义与双箭桥表示法中的相同。
3.电子守恒法配平原理:发生氧化还原反应时,还原剂失去电子、氧化剂得到电子.因为整个过程的本质好比是还原剂把电子给了氧化剂,在这一失一得之间,电子守恒.故根据还原剂失去电子的数目和氧化剂得到电子的数目相等,结合二者化合价的改变情况,可以分别把氧化剂、还原剂的计量数计算出来,这样整个氧化还原反应就顺利配平了.方法和步骤:①标出发生变化的元素的化合价,并确定氧化还原反应的配平方向.在配平时,需要确定先写方程式那边物质的计量数.有时先写出方程式左边反应物的计量数,有时先写出方程式右边生成物的计量数.一般遵循这样的原则:自身氧化还原反应→先配平生成物的计量数;部分氧化还原反应→先配平生成物的计量数;一般的氧化还原反应→既可先配平生成物的计量数,也可先配平反应物的计量数.②列出化合价升降的变化情况.当升高或降低的元素不止一种时,需要根据不同元素的原子个数比,将化合价变化的数值进行叠加.③根据电子守恒配平化合价变化的物质的计量数.④根据质量守恒配平剩余物质的计量数.最终并根据质量守恒检查配平无误.4.待定系数法配平原理:质量守恒定律告诉我们,在发生化学反应时,反应体系的各个物质的每一种元素的原子在反应前后个数相等.通过设出未知数(如x、y、z等均大于零)把所有物质的计量数配平,再根据每一种元素的原子个数前后相等列出方程式,解方程式(组).计量数有相同的未知数,可以通过约分约掉.方法和步骤:对于氧化还原反应,先把元素化合价变化较多的物质的计量数用未知数表示出来,再利用质量守恒吧其他物质的计量数也配平出来,最终每一个物质的计量数都配平出来后,根据某些元素的守恒,列方程解答.。

化学反应中的氧化还原反应的电子转移方式在化学反应中,氧化还原反应是一种常见的反应类型。
氧化还原反应也被称为氧化-还原反应或电子转移反应,是指发生电子的转移的化学反应。
在氧化还原反应中,物质可以接受或失去电子,从而发生氧化或还原。
本文将对氧化还原反应的电子转移方式进行详细探讨。
1. 氧化(Oxidation)在氧化还原反应中,氧化指的是物质失去电子。
当一个物质失去电子时,其氧化态会增加。
电子的流出被称为氧化过程。
氧化过程中,原子或离子会失去一个或多个电子来形成正离子。
例如,金属原子失去电子时会形成阳离子。
2. 还原(Reduction)还原指的是物质接受电子。
当一个物质接受电子时,其还原态会增加。
电子的流入被称为还原过程。
还原过程中,原子或离子会接受一个或多个电子来形成负离子或中性物质。
例如,非金属原子接受电子时会形成负离子。
3. 氧化剂(Oxidizing Agent)氧化剂是指能够使其他物质氧化的物质。
氧化剂自身发生还原反应,接受其他物质失去的电子。
常见的氧化剂包括氧气、过氧化氢和酸性高锰酸钾溶液等。
例如,在酸性条件下,高锰酸钾溶液可以将二氧化硫氧化为三氧化硫。
4. 还原剂(Reducing Agent)还原剂是指能够使其他物质还原的物质。
还原剂自身发生氧化反应,失去电子给予其他物质。
常见的还原剂包括金属、非金属和酸性亚硫酸溶液等。
例如,金属铁可以将三氧化二铁还原为二氧化铁。
5. 电子转移方式氧化还原反应中的电子转移方式可以分为直接接触和间接接触两种方式。
(1)直接接触:直接接触是指氧化剂和还原剂直接接触,电子从还原剂转移到氧化剂。
这种接触可以是固体与固体、固体与液体、液体与气体之间的接触。
例如,金属钠与氯气发生直接接触的反应,金属钠失去电子,氯气接受电子,形成氯化钠。
(2)间接接触:间接接触是指氧化剂和还原剂通过介质传递电子。
介质可以是溶液或固体。
在溶液中,电子可以通过溶液中的离子传递。
在固体中,电子可以通过导电固体传递。

氧化还原反应中电子的转移与解题方法氧化还原反应是化学反应中常见的一种类型,涉及到电子的转移过程。
在这篇文章中,我们将探讨氧化还原反应中电子转移的原理,并介绍解题方法。
一、氧化还原反应中的电子转移原理氧化还原反应是指在化学反应中,发生电子的转移。
在反应中,某些物质会失去电子(被氧化),而另一些物质会获得电子(被还原)。
这是由于氧化剂和还原剂之间的相互作用引起的。
在氧化还原反应中,电子转移的过程可以通过半反应方程式表示。
半反应方程式是指只考虑被氧化或被还原的物质的反应方程式。
举个例子,考虑以下反应:Cu + 2 Ag+ → Cu2+ + 2 Ag可以将该反应分解为两个半反应方程式:Cu → Cu2+ + 2 e-2 Ag+ + 2 e- → 2 Ag在上面的例子中,铜原子失去了两个电子,被氧化为铜离子,而银离子获得了两个电子,被还原为银原子。
二、氧化还原反应的解题方法解题方法通常与该反应相关的数值计算有关,例如电子的转移数目、物质的摩尔数等。
以下是一些常见的解题方法:1. 确定氧化还原反应的类型:氧化还原反应可以分为直接氧化还原反应和间接氧化还原反应。
直接氧化还原反应是指电子直接从氧化剂转移到还原剂,而间接氧化还原反应是指通过其他物质传递电子的过程。
根据反应类型的不同,选择合适的解题方法。
2. 根据半反应方程式确定电子转移数目:在半反应方程式中,电子的系数表示了电子的转移数目。
通过对半反应方程式进行平衡,可以确定电子转移的数目。
3. 计算氧化还原反应的摩尔数:通过已知物质的摩尔数和化学方程式中物质的系数,可以计算其他物质的摩尔数。
这对于计算反应物质的物质量非常重要。
4. 应用化学计量学的知识求解:根据已知物质的摩尔数,可以利用化学计量学的关系求解其他未知物质的摩尔数。
例如,根据反应方程式中物质的系数比例,可以确定物质的摩尔比。
5. 利用电子转移数目计算电荷数目:根据电子转移的数目,可以计算反应物质的电荷数目。

氧化还原反应电子转移法氧化还原反应是化学反应中常见的一种类型,其中涉及到电子的转移。
在氧化还原反应中,物质的氧化态和还原态发生了变化,同时伴随着电子的转移。
本文将介绍氧化还原反应中电子转移法的原理和应用。
一、原理氧化还原反应是指物质的氧化态和还原态之间发生的转化。
在氧化还原反应中,电子的转移是不可避免的。
电子转移法是描述氧化还原反应中电子转移过程的一种方法。
在氧化还原反应中,氧化剂接受电子,还原剂失去电子。
氧化剂在反应中氧化,还原剂在反应中还原。
电子转移的方向由化学反应中物质的氧化态和还原态决定。
具体而言,氧化剂会捕获还原剂中的电子,以此来实现对还原剂的氧化。
在这个过程中,氧化剂本身发生了还原。
与此相反,还原剂会失去电子,以此来实现对氧化剂的还原。
在这个过程中,还原剂本身发生了氧化。
二、应用1. 工业应用氧化还原反应电子转移法在工业生产中有广泛的应用。
例如,金属的电镀过程中,金属制品作为还原剂,被氧化剂电化(如氧化铁)接受电子,形成金属的还原剂。
这种过程中,电子的转移实现了金属制品的电镀。
另外,电池中的化学反应也是基于电子转移法进行的。
在电池中,正极是氧化剂,负极是还原剂,两极之间通过电解质导电,并伴随着电子的转移。
这种电子转移导致了正负极的氧化还原反应,从而产生电能。
2. 生物化学应用氧化还原反应电子转移法在生物化学中有着重要的应用。
在细胞呼吸过程中,电子转移是产生能量的关键步骤。
通过电子的转移,细胞内的能量分子ATP得以合成,为细胞提供能量。
另外,生物体中的许多酶催化的反应也是基于电子转移法进行的。
酶通过接受或释放电子来催化底物的氧化还原反应,从而促进了生物体内部的代谢过程。
三、总结氧化还原反应中的电子转移法是描述反应过程的重要方法。
在这种反应中,氧化剂接受电子,还原剂失去电子,导致物质的氧化还原状态发生变化。
电子转移法不仅在工业生产中有广泛应用,也在生物化学中发挥着重要作用。
通过电子转移,能够实现金属电镀、电池储能、细胞呼吸以及生物酶催化等多个领域的应用。
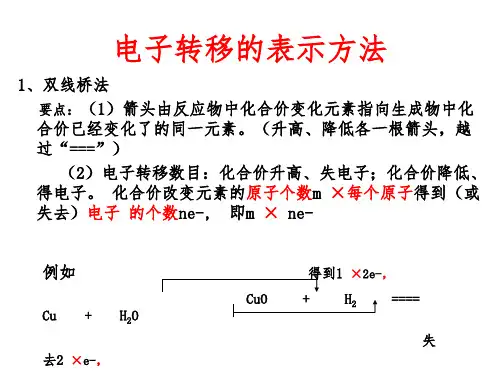

高中化学必背知识点:氧化还原反应一氧化还原反应基本概念1.概念本质:凡有电子得失或共用电子对偏移的一类反应称氧化还原反应,得失电子数相等。
特征:是反应前后有元素化合价发生变化的反应。
2. 氧化还原反应电子转移的表示方法①双线桥法:②单线桥法:3. 重要的氧化剂和还原剂物质在反应中是作氧化剂还是作还原剂,表观上可通过元素的化合价来判断。
一般来说,元素处于最高化合价时,只能作为氧化剂;元素处于最低化合价时,只能作还原剂;元素处于中间化合价时,既可作氧化剂,也可作还原剂。
⑴常见的氧化剂常见氧化剂的氧化性顺序为:Fe3+ >Cu2+>H+ >Fe2+ >Zn2+⑵常见的还原剂有常见还原剂的还原性顺序为:S2-(H2S)>SO32-(SO2、H2SO3)>I- >Fe2+ >Br - >Cl-二氧化性、还原性强弱的判断方法和依据氧化性→得电子性(填“得”或“失”),得到电子越容易→氧化性越强;还原性→失电子性(填“得”或“失”),失去电子越容易→还原性越强。
与得失电子的多少无关。
如:还原性:Na>Mg>Al ,氧化性:浓HNO3>稀HNO31. 根据元素在周期表中的位置同周期元素:从左至右,金属性(还原性)逐渐减弱,非金属性(氧化性)逐渐增强;同主族元素:从上至下,金属性(还原性)逐渐增强,非金属性(氧化性)逐渐减弱。
2. 根据金属活动顺序3. 根据非金属活动顺序非金属的活动顺序一般为:F O Cl Br I S 氧化性逐渐减弱;F—O2—Cl—Br—I—S2—还原性逐渐增强。
4. 依据反应式中的反应物和生成物之间的关系氧化剂的氧化性>氧化产物的氧化性还原剂的还原性>还原产物的还原性5. 氧化性、还原性的强弱与温度、浓度、酸碱性的关系⑴温度:升高温度,氧化剂的氧化性增强,还原剂的还原性也增强。
如:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
若不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)发生反应时,所需温度高低不同,则温度低的氧化性(或还原性)强,反之则弱。
氧化还原反应中电子转移的表示方法1 双线桥法表明反应前后同一元素原子或离子间的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型如:2 单线桥法表明反应前后元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型如:辨析比较双线桥法与单线桥法的比较1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
典例详析例3-16(四川成都七中期中)下列氧化还原反应方程式中所标电子转移方向与数目错误的是()A.B.C.D.解析◆A反应中,铁元素的化合价升高(0→+2),失去2e-;氢元素的化合价降低(+1→0),得到2×e-,电子转移方向和数目均符合反应事实,A项正确。
B反应中,氮元素的化合价升高(+2→+5),失去4×3e-;氧元素的化合价降低(0→-2),得到6×2e-,电子转移方向和数目均符合反应事实,B项正确。
C反应中,氯元素的化合价由Cl2中的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;氯元素的化合价由Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移方向和数目均符合反应事实,C项正确。
D反应中,氯元素的化合价由HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-;氯元素的化合价由KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中电子转移数目不符合反应事实,D项错误。
答案◆D例3-17(河南中原名校期中联考)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为4NH3+5O24NO+6H2O,该反应的氧化剂为________,还原剂为________。
用单线桥法表示该氧化还原反应中电子转移的方向和数目:________________。
氧化还原反应的表示法反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1)单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2)双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目或总数时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到2价的S。
重难点10 氧化还原反应电子转移的表示方法1.双线桥法(1)表示意义:表示反应前后同一元素原子间电子转移情况。
(2)基本步骤:(3)注意事项:①箭头、箭尾必须对应化合价变化的同种元素的原子;②必须注明“得”或“失”;③氧化剂和还原剂得、失电子总数要相等。
2.单线桥法(1)表示意义:表示反应前后不同元素原子间电子转移情况。
(2)基本步骤:(3)注意事项:①单线桥表示反应物中变价元素原子得失电子的情况;②不需标明“得”或“失”,只标明电子转移数目;③箭头标明电子转移的方向;④单线桥箭头从失电子的元素原子指向得电子的元素原子。
【特别提醒】电子转移表示方法的注意事项(1)氧化还原反应中转移电子总数是得到电子数或失去电子数,而不是二者的加和。
(2)双线桥法标电子转移时,电子转移数用a×b e-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a或b等于1时,要省略。
★★★★【重难点考向一】双线桥分析氧化还原反应【例1】用双线桥分析下列氧化还原反应,并指出氧化剂还原剂.Cu+4HNO3(浓)═Cu(NO3)2+2NO2+2H2O【答案】;氧化剂HNO3;还原剂Cu【解析】反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu 元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即;【重难点考向二】单线桥分析氧化还原反应【例2】用单线桥法分析下列氧化还原反应,标出电子转移方向和数目。MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O【答案】【重难点考向三】氧化还原反应的分析【例3】下列化学反应中电子转移的表示方法正确的是( )【答案】 C【解析】A.Si元素化合价由+4价降低为0价,得到电子,C元素失去电子,化合价从0价升高为+2价,最小公倍数为4,转移电子为4e-,故A错误;B.H元素化合价由+1降低为0价,总共降低2价,得到2个电子,Na元素从0价升高为+1价,共失去2个电子,最小公倍数为2,转移电子为2e-,故B错误;C.I元素化合价由-1价升高为0价,失去电子,Mn元素化合价从+7价降低为+2价,得到电子,最小公倍数为10,转移电子10e-,故C正确;D.Cu元素化合价由0价升高为+2价,失去电子,S元素化合价由+6价降低为+4价,得到电子,最小公倍数为2,转移电子2e-,故D 错误;故选C。
氧化还原反应的电子转移方程式在化学领域中,氧化还原反应(又称红ox-反还on-)是指物质中电子的转移过程。
在这种反应中,一个物质会失去电子(被氧化),而另一个物质会获得这些电子(被还原)。
这个电子转移的过程可以用电子转移方程式来表示。
本文将为您介绍氧化还原反应的电子转移方程式。
氧化还原反应的电子转移方程式氧化还原反应中,氧化剂是指能够接受电子的物质,而还原剂则是能够提供电子的物质。
这两个反应物之间的电子转移可以用电子转移方程式来表示。
一般来说,电子转移方程式的表示方式为:物质A + 物质B → 物质C + 物质D在这个方程中,物质A被氧化,失去了电子,成为物质C。
而物质B则被还原,获得了这些电子,成为物质D。
方程中的箭头表示了电子的转移方向。
举例来说,我们来看一下铁和铜之间的氧化还原反应:Fe + Cu2+ → Fe2+ + Cu在这个方程中,铁(Fe)被氧化为铁离子(Fe2+),同时铜离子(Cu2+)被还原为纯铜(Cu)。
电子由铁转移到了铜离子上,完成了氧化还原反应。
还有一种常见的氧化还原反应是金属与非金属之间的反应。
例如,钠(Na)与氯(Cl2)之间的反应可以表示为:2Na + C l2 → 2NaCl在这个方程中,钠原子失去一个电子,形成钠离子(Na+),而氯原子获得了这个电子,形成氯离子(Cl-)。
钠被氧化,氯被还原,形成了氯化钠(NaCl)。
除了简单的单个原子或离子参与的氧化还原反应,复杂的化合物也可能发生氧化还原反应。
这些反应的方程式更加复杂,需要根据具体的化学反应进行推导。
总结氧化还原反应的电子转移方程式是描述氧化剂和还原剂之间电子转移的方式。
通过电子转移方程式,我们可以清晰地了解反应中哪些物质被氧化,哪些物质被还原,以及电子转移的方向。
在化学实验和研究中,使用电子转移方程式可以更好地理解和分析氧化还原反应过程。
通过本文的介绍,相信您对氧化还原反应的电子转移方程式有了更深入的了解。