电子转移表示法
- 格式:ppt
- 大小:341.50 KB
- 文档页数:12



电子转移的表示方法1.双线桥法(1)表示方法写出Cu与稀硝酸反应的化学方程式并用双线桥标出电子转移的方向和数目:(2)注意事项①箭头指向反应前后有元素化合价变化的同种元素的原子,且需注明“得到”或“失去”。
②箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
③失去电子的总数等于得到电子的总数。
2.单线桥法(1)表示方法写出Cu与稀硝酸反应的化学方程式并用单线桥标出电子转移的方向和数目:(2)注意事项①箭头从失电子元素的原子指向得电子元素的原子。
②不标“得到”或“失去”,只标明电子转移的总数。
③线桥只出现在反应物中。
[细练过关]1.下列化学反应中电子转移方向、数目表示正确的是()A.B.C.D.解析:选D A项中转移电子数目错误,应为e-;B项中Zn失电子H得电子;C项中用单线桥表示电子转移时不标“得失”。
2.(1)用双线桥法表示下列反应的电子转移的方向和数目①3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O②3NF3+5H2O===2NO+HNO3+9HF③KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O(2)用单线桥法表示下列反应的电子转移的方向和数目①CaH2+2H2O===Ca(OH)2+2H2↑②FeS2+8HNO3===Fe(NO3)3+2H2SO4+5NO↑+2H2O答案:(1)①②③(2)①②3.(1)对于反应:14CuSO 4+5FeS 2+12H 2O===7Cu 2S +5FeSO 4+12H 2SO 4,当有1 mol FeS 2发生反应,转移电子的物质的量为________。
(2)对于NaNO 2+NH 4Cl===NaCl +N 2↑+2H 2O 反应,生成0.5 mol N 2,转移电子物质的量为________。
解析:(1)根据反应当5 mol FeS 2反应时,CuSO 4→Cu 2S 时得14 mol e -,FeS 2→Cu 2S 时得7 mol e -,共得到21 mol e -,所以当有1 mol FeS 2反应时,转移4.2 mol e -。

第2课时氧化剂和还原剂核心微网络素养新要求1.学会电子转移的表示方法。
2.知道常见的氧化剂和还原剂。
3.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物。
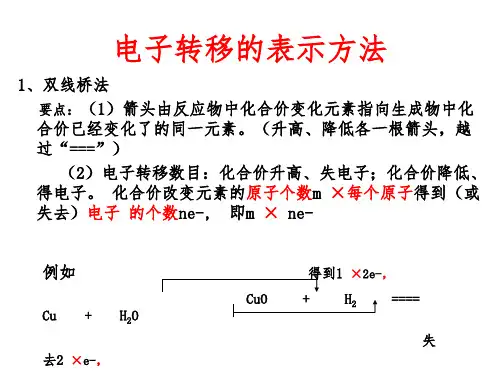
学业基础——自学·思记·尝试一、电子转移的表示方法1.双线桥法表明反应前后同一元素原子的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型(m×n=a×b)(3)注意事项①箭头、箭尾对应化合价变化的同种元素;②必须注明“得到”或“失去”;③还原剂失去的电子总数与氧化剂得到的电子总数相等。
2.单线桥法表明反应前后不同元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型(3)注意事项箭头已标明电子转移的方向,因此不需再标明“得到”或“失去”,只需标明电子转移的数目。
二、氧化剂和还原剂1.基本概念(1)氧化剂和还原剂氧化剂:在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的反应物。
还原剂:在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的反应物。
模型:(2)氧化产物和还原产物氧化产物:还原剂在反应中失去电子(或电子对偏离)后被氧化成的生成物。
还原产物:氧化剂在反应中得到电子(或电子对偏向)后被还原成的生成物。
(3)氧化性和还原性氧化性:物质得到电子的能力。
在氧化还原反应中,氧化剂具有氧化性,得到电子后,化合价降低,被还原。
还原性:物质失去电子的能力。
在氧化还原反应中,还原剂具有还原性,失去电子后,化合价升高,被氧化。
(4)氧化还原反应中基本概念之间的关系2.常见的氧化剂和还原剂3.氧化还原反应的应用(1)积极作用①汽车尾气的处理汽车尾气的主要成分是氮氧化物(NO、NO2)和碳氧化物(CO、CO2)。
在一定条件下,利用氧化还原反应原理,使NO x与CO发生反应,转化成无毒的N2和CO2,从而减少或消除汽车尾气对大气的污染。
2NO+2CO N2+2CO22NO2+4CO N2+4CO22NO x+2x CO N2+2x CO2②从矿石中冶炼金属。

反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。



氧化还原反应中电子转移问题一、【学法导航】解答氧化还原反应概念类型题时关键是:12(1(2)单线桥法——“谁给谁”单线桥法:用一条箭头从失电子元素出发指向得电子的元素,表示电子转移的方向和数目。
注意:①箭号起点为失电子元素,终点为得电子元素;②在线桥上只注明电子转移的总数不标得与失。
3、氧化还原反应方程式配平要依据原理:电子得失守恒和原子守恒。
二、经典例题1.在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中,_______是氧化剂;_______是还原剂;______元素被氧化;_______元素被还原;_______是氧化产物;________是还原产物;电子转移总数为________。
2.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。
当生成1mol硝酸锌时,被还原的硝酸的物质的量为()A.2mol B.1mol C.0.5mol D.0.25mol3.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;ACD4.C.5.ABC6.2 gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol·L-1KMnO4溶液处理,发生反应如下:8-4MnO+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O6-4MnO+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:-4MnO+Fe2++H+Mn2++Fe3++H2O(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500mL0.1mol·L-1Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________g。

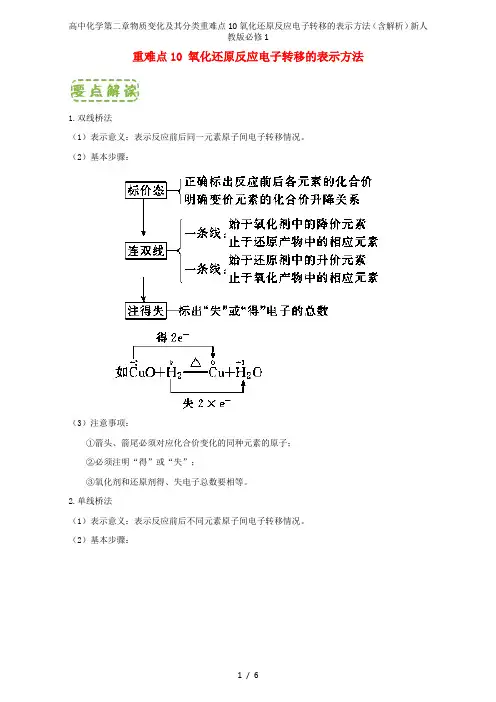
重难点10 氧化还原反应电子转移的表示方法1.双线桥法(1)表示意义:表示反应前后同一元素原子间电子转移情况。
(2)基本步骤:(3)注意事项:①箭头、箭尾必须对应化合价变化的同种元素的原子;②必须注明“得”或“失”;③氧化剂和还原剂得、失电子总数要相等。
2.单线桥法(1)表示意义:表示反应前后不同元素原子间电子转移情况。
(2)基本步骤:(3)注意事项:①单线桥表示反应物中变价元素原子得失电子的情况;②不需标明“得”或“失”,只标明电子转移数目;③箭头标明电子转移的方向;④单线桥箭头从失电子的元素原子指向得电子的元素原子。
【特别提醒】电子转移表示方法的注意事项(1)氧化还原反应中转移电子总数是得到电子数或失去电子数,而不是二者的加和。
(2)双线桥法标电子转移时,电子转移数用a×b e-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a或b等于1时,要省略。
★★★★【重难点考向一】双线桥分析氧化还原反应【例1】用双线桥分析下列氧化还原反应,并指出氧化剂还原剂.Cu+4HNO3(浓)═Cu(NO3)2+2NO2+2H2O【答案】;氧化剂HNO3;还原剂Cu【解析】反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu 元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即;【重难点考向二】单线桥分析氧化还原反应【例2】用单线桥法分析下列氧化还原反应,标出电子转移方向和数目。MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O【答案】【重难点考向三】氧化还原反应的分析【例3】下列化学反应中电子转移的表示方法正确的是( )【答案】 C【解析】A.Si元素化合价由+4价降低为0价,得到电子,C元素失去电子,化合价从0价升高为+2价,最小公倍数为4,转移电子为4e-,故A错误;B.H元素化合价由+1降低为0价,总共降低2价,得到2个电子,Na元素从0价升高为+1价,共失去2个电子,最小公倍数为2,转移电子为2e-,故B错误;C.I元素化合价由-1价升高为0价,失去电子,Mn元素化合价从+7价降低为+2价,得到电子,最小公倍数为10,转移电子10e-,故C正确;D.Cu元素化合价由0价升高为+2价,失去电子,S元素化合价由+6价降低为+4价,得到电子,最小公倍数为2,转移电子2e-,故D 错误;故选C。
氧化还原反应中电子转移的表示方法1 双线桥法表明反应前后同一元素原子或离子间的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型如:2 单线桥法表明反应前后元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型如:辨析比较双线桥法与单线桥法的比较1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
典例详析例3-16(四川成都七中期中)下列氧化还原反应方程式中所标电子转移方向与数目错误的是()A.B.C.D.解析◆A反应中,铁元素的化合价升高(0→+2),失去2e-;氢元素的化合价降低(+1→0),得到2×e-,电子转移方向和数目均符合反应事实,A项正确。
B反应中,氮元素的化合价升高(+2→+5),失去4×3e-;氧元素的化合价降低(0→-2),得到6×2e-,电子转移方向和数目均符合反应事实,B项正确。
C反应中,氯元素的化合价由Cl2中的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;氯元素的化合价由Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移方向和数目均符合反应事实,C项正确。
D反应中,氯元素的化合价由HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-;氯元素的化合价由KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中电子转移数目不符合反应事实,D项错误。
答案◆D例3-17(河南中原名校期中联考)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为4NH3+5O24NO+6H2O,该反应的氧化剂为________,还原剂为________。
用单线桥法表示该氧化还原反应中电子转移的方向和数目:________________。
反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1)单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况).它体现了“谁给谁”.表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2)双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号.在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目.对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好.双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥.因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S.故应如下表示才正确:再如HCl和KClO3反应,如下表示也是错的:因为氧化还原反应有条规律是:只有同一种元素发生的氧化还原反应时,该元素的化合价变化是“只相撞,不相交”。