电子转移的表示方法
- 格式:docx
- 大小:230.41 KB
- 文档页数:7






第2课时氧化剂和还原剂核心微网络素养新要求1.学会电子转移的表示方法。
2.知道常见的氧化剂和还原剂。
3.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物。
学业基础——自学·思记·尝试一、电子转移的表示方法1.双线桥法表明反应前后同一元素原子的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型(m×n=a×b)(3)注意事项①箭头、箭尾对应化合价变化的同种元素;②必须注明“得到”或“失去”;③还原剂失去的电子总数与氧化剂得到的电子总数相等。
2.单线桥法表明反应前后不同元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型(3)注意事项箭头已标明电子转移的方向,因此不需再标明“得到”或“失去”,只需标明电子转移的数目。
二、氧化剂和还原剂1.基本概念(1)氧化剂和还原剂氧化剂:在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的反应物。
还原剂:在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的反应物。
模型:(2)氧化产物和还原产物氧化产物:还原剂在反应中失去电子(或电子对偏离)后被氧化成的生成物。
还原产物:氧化剂在反应中得到电子(或电子对偏向)后被还原成的生成物。
(3)氧化性和还原性氧化性:物质得到电子的能力。
在氧化还原反应中,氧化剂具有氧化性,得到电子后,化合价降低,被还原。
还原性:物质失去电子的能力。
在氧化还原反应中,还原剂具有还原性,失去电子后,化合价升高,被氧化。
(4)氧化还原反应中基本概念之间的关系2.常见的氧化剂和还原剂3.氧化还原反应的应用(1)积极作用①汽车尾气的处理汽车尾气的主要成分是氮氧化物(NO、NO2)和碳氧化物(CO、CO2)。
在一定条件下,利用氧化还原反应原理,使NO x与CO发生反应,转化成无毒的N2和CO2,从而减少或消除汽车尾气对大气的污染。
2NO+2CO N2+2CO22NO2+4CO N2+4CO22NO x+2x CO N2+2x CO2②从矿石中冶炼金属。

反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1)单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况).它体现了“谁给谁”.表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2)双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号.在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目.对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好.双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥.因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S.故应如下表示才正确:再如HCl和KClO3反应,如下表示也是错的:因为氧化还原反应有条规律是:只有同一种元素发生的氧化还原反应时,该元素的化合价变化是“只相撞,不相交”。

反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。

氧化还原反应中电子转移数目的判断1.对于双箭桥表示法电子转移数表示为 :AxBe-形式。
其中A为反应前后化合价变化的原子个数;B=高价态-低价态,A=1 或B=1将1省略。
2.对于单箭桥表示法电子转移数表示为 Me 形式。
M=A×B,当 M=1 时,将1省略,A、B 的意义与双箭桥表示法中的相同。
3.电子守恒法配平原理:发生氧化还原反应时,还原剂失去电子、氧化剂得到电子.因为整个过程的本质好比是还原剂把电子给了氧化剂,在这一失一得之间,电子守恒.故根据还原剂失去电子的数目和氧化剂得到电子的数目相等,结合二者化合价的改变情况,可以分别把氧化剂、还原剂的计量数计算出来,这样整个氧化还原反应就顺利配平了.方法和步骤:①标出发生变化的元素的化合价,并确定氧化还原反应的配平方向.在配平时,需要确定先写方程式那边物质的计量数.有时先写出方程式左边反应物的计量数,有时先写出方程式右边生成物的计量数.一般遵循这样的原则:自身氧化还原反应→先配平生成物的计量数;部分氧化还原反应→先配平生成物的计量数;一般的氧化还原反应→既可先配平生成物的计量数,也可先配平反应物的计量数.②列出化合价升降的变化情况.当升高或降低的元素不止一种时,需要根据不同元素的原子个数比,将化合价变化的数值进行叠加.③根据电子守恒配平化合价变化的物质的计量数.④根据质量守恒配平剩余物质的计量数.最终并根据质量守恒检查配平无误.4.待定系数法配平原理:质量守恒定律告诉我们,在发生化学反应时,反应体系的各个物质的每一种元素的原子在反应前后个数相等.通过设出未知数(如x、y、z等均大于零)把所有物质的计量数配平,再根据每一种元素的原子个数前后相等列出方程式,解方程式(组).计量数有相同的未知数,可以通过约分约掉.方法和步骤:对于氧化还原反应,先把元素化合价变化较多的物质的计量数用未知数表示出来,再利用质量守恒吧其他物质的计量数也配平出来,最终每一个物质的计量数都配平出来后,根据某些元素的守恒,列方程解答.。

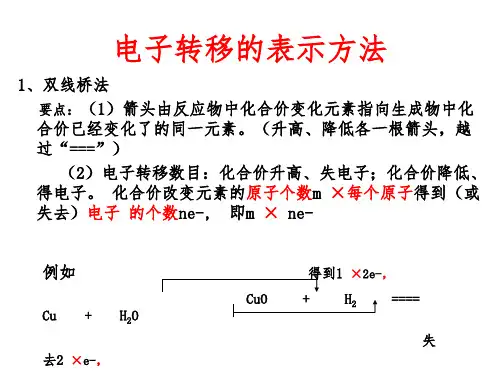
第七节氧化还原反应二一、电子转移的表示方法1.双线桥法表示反应前后同一元素原子间电子的转移情况。
MnO2+4HCl(浓)==△==MnCl2+Cl2↑+2H2O2.单线桥法表示反应前后不同元素原子间电子的转移情况。
CuO+H2==△==Cu+H2O3.特殊举例练习2Na2O2+2H2O=4NaOH+O2↑(单线桥)Cl2+H2O=HCl+HClO(单线桥)3S+6NaOH=2Na2S+Na2SO3+3H2O(单线桥)KClO3+6HCl=KCl+3Cl2↑+3H2O(双线桥)2H2S+SO2=3S↓+2H2O(双线桥)二、氧化还原配平1.配平方法——电子得失守恒一标化合价:标出变价元素化合价二列变化式:根据化合价升降,计算转移电子总数三定:根据最小公倍数确定反应物质计量数四平:用观察法配平其他计量数五查:原子守恒、电荷守恒、得失电子守恒2.不同类型氧化还原的配平方法——附带氧化还原配平练习题(1)全变:例1:C+HNO3——CO2↑+NO2↑+H2O例2:NH3+O2——NO+H2O(2)部分变:例3:Cu+HNO3——Cu(NO3)2+NO↑+H2O例4:KMnO4+HCl——MnCl2+Cl2↑+KCl+H2O(3)歧化:例5:NO2+H2O——HNO3+NO例6:Cl2+NaOH——NaCl+NaClO3+H2O(4)归中:例7:H2S+SO2——S↓+H2O(5)整体配:例8:FeS2+O2——Fe2O3+SO2例9:Cu2S+HNO3——Cu(NO3)2+NO↑+H2SO4+H2O (6)零价法:例10:Fe3C+HNO3——CO2↑+Fe(NO3)3+NO2↑+H2O 练习:三、氧化还原反应的规律1.守恒规律还原剂失电子总数=氧化剂得电子总数氧化剂化合价降低总数=还原剂化合价升高总数转移电子数=氧化剂得电子数=还原剂失电子数2.价态规律最高价元素只有氧化性,最低价元素只有还原性。
中间价态既有氧化性又有还原性。
氧化还原反应中电子转移的表示方法1 双线桥法表明反应前后同一元素原子或离子间的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型如:2 单线桥法表明反应前后元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型如:辨析比较双线桥法与单线桥法的比较1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
典例详析例3-16(四川成都七中期中)下列氧化还原反应方程式中所标电子转移方向与数目错误的是()A.B.C.D.解析◆A反应中,铁元素的化合价升高(0→+2),失去2e-;氢元素的化合价降低(+1→0),得到2×e-,电子转移方向和数目均符合反应事实,A项正确。
B反应中,氮元素的化合价升高(+2→+5),失去4×3e-;氧元素的化合价降低(0→-2),得到6×2e-,电子转移方向和数目均符合反应事实,B项正确。
C反应中,氯元素的化合价由Cl2中的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;氯元素的化合价由Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移方向和数目均符合反应事实,C项正确。
D反应中,氯元素的化合价由HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-;氯元素的化合价由KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中电子转移数目不符合反应事实,D项错误。
答案◆D例3-17(河南中原名校期中联考)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为4NH3+5O24NO+6H2O,该反应的氧化剂为________,还原剂为________。
用单线桥法表示该氧化还原反应中电子转移的方向和数目:________________。
电子转移的表示方法1.双线桥法(1)表示方法写出Cu与稀硝酸反应的化学方程式并用双线桥标出电子转移的方向和数目:(2)注意事项①箭头指向反应前后有元素化合价变化的同种元素的原子,且需注明“得到”或“失去”。
②箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
③失去电子的总数等于得到电子的总数。
2.单线桥法(1)表示方法写出Cu与稀硝酸反应的化学方程式并用单线桥标出电子转移的方向和数目:(2)注意事项①箭头从失电子元素的原子指向得电子元素的原子。
②不标“得到”或“失去”,只标明电子转移的总数。
③线桥只出现在反应物中。
[细练过关]1.下列化学反应中电子转移方向、数目表示正确的是()A.B.C.D.解析:选D A项中转移电子数目错误,应为e-;B项中Zn失电子H得电子;C项中用单线桥表示电子转移时不标“得失”。
2.(1)用双线桥法表示下列反应的电子转移的方向和数目①3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O②3NF3+5H2O===2NO+HNO3+9HF③KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O(2)用单线桥法表示下列反应的电子转移的方向和数目①CaH2+2H2O===Ca(OH)2+2H2↑②FeS2+8HNO3===Fe(NO3)3+2H2SO4+5NO↑+2H2O答案:(1)①②③(2)①②3.(1)对于反应:14CuSO 4+5FeS 2+12H 2O===7Cu 2S +5FeSO 4+12H 2SO 4,当有1 mol FeS 2发生反应,转移电子的物质的量为________。
(2)对于NaNO 2+NH 4Cl===NaCl +N 2↑+2H 2O 反应,生成0.5 mol N 2,转移电子物质的量为________。
解析:(1)根据反应当5 mol FeS 2反应时,CuSO 4→Cu 2S 时得14 mol e -,FeS 2→Cu 2S 时得7 mol e -,共得到21 mol e -,所以当有1 mol FeS 2反应时,转移4.2 mol e -。
(2)此反应电子转移表示为故生成0.5 mol N 2时转移电子0.5 mol ×3=1.5 mol 。
答案:(1)4.2 mol (2)1.5 mol [备考点击]1.转移电子数的计算思路明确元素的变价―→找出所有氧化剂或还原剂的物质的量――――→根据变价数所有氧化剂或还原剂得或失的电子数―→确定转移电子数。
[n (e -)=n (氧化剂)或n (还原剂)×N (变价原子数)×ΔN (化合价变化数)]2.近几年高考中一些特殊物质中元素的化合价[课时跟踪检测]1.(2019·北京高考)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )B NaCl 溶液(MgCl 2)NaOH 溶液、稀HCl C Cl 2(HCl) H 2O 、浓H 2SO 4 DNO(NO 2)H 2O 、无水CaCl 2解析:选B A 错:除杂时发生的反应为Fe +2FeCl 3===3FeCl 2,该反应属于氧化还原反应。
B 对:除杂时发生的反应为MgCl 2+2NaOH===Mg(OH)2↓+2NaCl 、NaOH +HCl===NaCl +H 2O ,上述两个反应均不属于氧化还原反应。
C 错:Cl 2能溶于水且发生反应Cl 2+H 2OHCl +HClO ,不能用水除去Cl 2中的HCl 。
D 错:除杂时发生的反应为3NO 2+H 2O===2HNO 3+NO ,该反应为氧化还原反应。
2.(2019·浙江4月选考)下列属于置换反应的是( ) A .4NH 3+5O 2=====催化剂△4NO +6H 2O B .2Na 2SO 3+O 2===2Na 2SO 4 C .2Na 2O 2+2CO 2===2Na 2CO 3+O 2 D .2KI +Cl 2===2KCl +I 2解析:选D 置换反应是指单质与化合物反应,生成另外一种单质和化合物的化学反应。
D 项中Cl 2与KI 反应生成I 2和KCl ,属于置换反应,其余选项均不是置换反应。
3.实验室利用以下反应制取少量氮气:NaNO 2+NH 4Cl===NaCl +N 2↑+2H 2O 。
下列关于该反应的说法正确的是( ) A .NaNO 2发生氧化反应 B .NH 4Cl 中的氮元素被还原 C .N 2既是氧化产物,又是还原产物D .每生成1 mol N 2时转移电子的物质的量为6 mol解析:选C A 项,由反应前后元素的化合价变化知,NaNO 2为氧化剂,发生还原反应;B 项,NH 4Cl 为还原剂,发生氧化反应,氮元素被氧化;C 项,N 2既是氧化产物,又是还原产物;D 项,每生成1 mol N 2时转移电子的物质的量为3 mol 。
4.(2019·郑州一模)将过量H 2O 2溶液加入含(NH 4)2CrO 4的氨水中,加热后冷却,生成暗棕红色晶体M [化学式为Cr(NH 3)3O 4],发生反应的离子方程式为CrO 2-4+3NH 3+3H 2O 2===M +2H 2O +2OH -+O 2↑,测得M 中有2个过氧键。
下列叙述正确的是( ) A .M 中Cr 的化合价为+3 B .参与反应的H 2O 2全部被氧化C .向FeSO 4溶液中滴加几滴M 的溶液,没有明显现象D .转移0.2 mol 电子时,生成M 的质量为16.7 g解析:选D M 的化学式为Cr(NH 3)3O 4,M 中有2个过氧键,则4个O 均为-1价,而NH 3为中性分子,故Cr 的化合价为+4,A 项错误;根据3H 2O 2~O 2以及M 中有2个过氧键,知参与反应的H 2O 2只有13被氧化,B 项错误;M 中含有过氧键,具有强氧化性,向FeSO 4溶液中滴加几滴M 的溶液,Fe 2+被氧化为Fe 3+,溶液会发生颜色变化,C 项错误;转移0.2 mol 电子生成0.1 mol M ,质量为16.7 g ,D 项正确。
5.(2019·贵阳模拟)已知反应:FeO·Cr 2O 3+Na 2CO 3+NaNO 3――→高温Na 2CrO 4+Fe 2O 3+CO 2↑+NaNO 2(未配平)。
下列说法正确的是( ) A .Na 2CrO 4是还原产物B .该反应中有3种元素的化合价发生变化C .NaNO 3是还原剂D .1 mol FeO·Cr 2O 3参与反应将得到7 mol 电子解析:选B 还原产物是指氧化剂对应的生成物,Na 2CrO 4是氧化产物,A 项错误;该反应中二价铁转化成三价铁,三价铬转化成六价铬,五价氮转化成三价氮,共3种元素的化合价发生变化,B 项正确;FeO·Cr 2O 3是还原剂,NaNO 3是氧化剂,C 项错误;1 mol FeO·Cr 2O 3参与反应将失去7 mol 电子,D 项错误。
6.(2019·石家庄模拟)乙醇与酸性K 2Cr 2O 7溶液混合可发生反应:Cr 2O 2-7+C 2H 5OH +H +―→ Cr 3++CH 3COOH +H 2O(未配平)。
下列叙述不正确的是( ) A .Cr 2O 2-7中Cr 元素的化合价为+6 B .氧化产物为CH 3COOH C .K 2Cr 2O 7溶液常用硫酸酸化D .1 mol C 2H 5OH 发生上述反应转移2 mol e -解析:选D Cr 2O 2-7中Cr 元素的化合价为+6,A 项正确;该反应中C 2H 5OH 作还原剂,发生氧化反应,得到氧化产物CH 3COOH ,B 项正确;Cr 2O 2-7具有氧化性,可与HCl 发生氧化还原反应,HNO 3本身具有强氧化性,会干扰Cr 2O 2-7的反应,故常用硫酸酸化,C 项正确;1 mol C 2H 5OH 发生该反应,转移4 mol 电子,D 项错误。
7.处理含氰(CN -)废水涉及以下反应,其中无毒的OCN -中碳元素为+4价。
CN -+OH -+Cl 2―→OCN -+Cl -+H 2O(未配平) 反应Ⅰ 2OCN -+4OH -+3Cl 2===2CO 2+N 2+6Cl -+2H 2O 反应Ⅱ 下列说法正确的是( ) A .反应Ⅰ中碳元素被还原 B .反应Ⅱ中CO 2为氧化产物C .处理过程中,每产生1 mol N 2,消耗3 mol Cl 2D .反应Ⅰ中CN -与Cl 2按物质的量之比为1∶1进行反应解析:选D CN -中N 为-3价,C 为+2价,OCN -中O 为-2价,N 为-3价,C 为+4价,反应Ⅰ中碳元素化合价升高,被氧化,A 项错误;反应Ⅱ中碳的化合价不变,CO 2不是氧化产物,B 项错误;配平反应Ⅰ为CN -+2OH -+Cl 2===OCN -+2Cl -+H 2O ,D 项正确;根据反应Ⅱ,产生1 mol N 2,需要2 mol OCN -,此时消耗3 mol Cl 2,根据反应Ⅰ,产生2 mol OCN -,需消耗2 mol Cl 2,因此每产生1 mol N 2,消耗5 mol Cl 2,C 项错误。
8.对于反应:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
(1)生成1 mol Cl 2,被氧化的HCl 为________ mol ,转移电子数为________(用N A 表示阿伏加德罗常数的值)。
(2)在此反应中,表现氧化性的物质是________。
(3)此反应中,HCl 表现的性质有________。
(4)用双线桥表示电子转移的方向与数目__________________________________________ ______________________________。
答案:(1)2 2N A (2)MnO 2 (3)酸性、还原性(4)9.氧化还原是一类重要的反应。
(1)已知反应Cu +2Fe 3+===Cu 2++2Fe 2+,反应中还原剂是________,氧化性:Fe 3+________Cu 2+(填“<”或“>”)。
(2)在2Na 2O 2+2CO 2===2Na 2CO 3+O 2反应中,若转移3 mol 电子,则所产生的氧气在标准状况下的体积为______L 。
(3)在x R 2++y H ++O 2===m R 3++n H 2O 的离子方程式中,对系数m 和R 2+、R 3+判断正确的是________。
A .m =y ,R 3+是还原剂 B .m =2y ,R 2+被氧化 C .m =2,R 3+是氧化剂D .m =4,R 2+是还原剂(4)用双线桥标出反应2KMnO 4+16HCl(浓)===2KCl +2MnCl 2+5Cl 2↑+8H 2O 中电子转移的方向和数目。