电子转移步骤动力学
- 格式:ppt
- 大小:2.21 MB
- 文档页数:95

电子转移过程中的分子动力学电子转移是指在一个分子或一个体系中,电子从一个能级跃迁到另一个能级的过程。
这个过程通常涉及到原子、分子、离子等电子、核外电子等粒子的动力学行为。
电子转移过程中的分子动力学研究是化学、物理学和材料科学等领域的重要课题,对于理解化学反应机理、表征材料性能、设计新型材料等具有重要的意义。
本文将从分子动力学的角度,探讨电子转移过程的研究现状和未来发展趋势。
一、电子转移过程的基本机理电子转移过程研究的基本机理是电子的能量转移和动量转移。
在电子转移过程中,电子可通过多种机制发生能量转移,包括电子-电子碰撞、电子-离子碰撞、光激发等。
这些机制可引起电子和分子中其它粒子的激发、电离、解离等反应,进而影响整个系统的性质变化。
动量转移与能量转移密切相关,是指电子和粒子之间的相对运动和碰撞过程中动量的交换。
它能够影响反应的速率、偏振性、选择性和产物分布等因素。
二、分子动力学模拟在电子转移中的应用分子动力学模拟是一种通过数值计算模拟分子的运动和相互作用过程的方法。
它能够对分子和材料的结构、动力学、热力学等性质进行预测和解析,为电子转移过程的研究提供了强有力的工具。
目前,分子动力学模拟在电子转移领域已经取得了重大进展。
其中最具代表性的应用是在材料重整化中的应用。
材料重整化是指通过重组原子和分子结构的方式,改变材料的性质和功能。
这种程序通常需要结合化学反应和物理过程,分析材料结构的变化、能量和动量的交换,以及各种反应变化对材料性质的影响。
分子动力学模拟可通过计算分子的能量、势能面、运动轨迹等信息,预测和解析化学反应机理和过渡态的特性,为新型材料设计提供有力的支持。
除了在材料重整化中的应用,分子动力学模拟还用于研究分子间电子传递的机制、表征光激发过程中的电子动力学变化等。
例如,在光激发分子的过程中,由于分子中的光敏化染料的存在,电子将被迫从LUMO(最低未占据分子轨道)向HOMO (最高占据分子轨道)逆向转移,形成激发态。

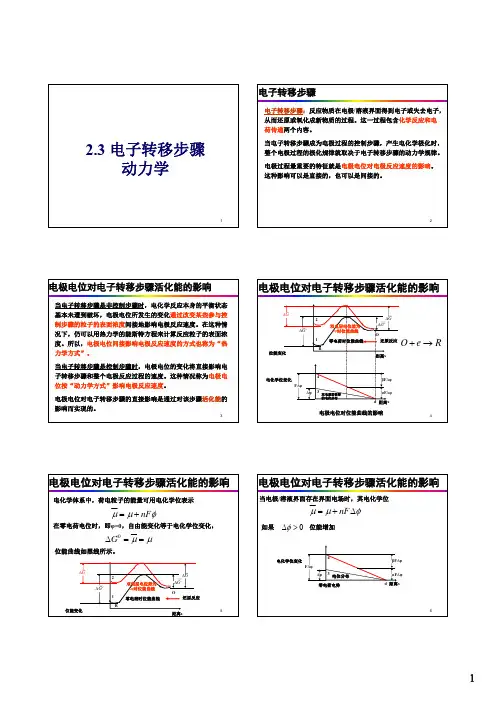
电化学第3章电化学极化讲解第3章电化学极化(电荷转移步骤动⼒学)绪论中曾提到:⼀个电极反应是由若⼲个基本步骤形成的,⼀个反应⾄少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒⼦⾃溶液深处向电极表⾯的扩散——液相传质步骤。
2) 反应粒⼦在界⾯得失电⼦的过程——电化学步骤。
3) 产物⽣成新相,或向溶液深处扩散。
当有外电流通过电极时,?将偏离平衡值,我们就说此时发⽣了极化。
如果传质过程是最慢步骤,则?的偏离是由浓度极化引起的(此时0i s i C C ≠,e ?的计算严格说是⽤s i C 。
⽆浓度极化时0i s i C C =,?的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这⼀步骤平衡特征的Nernst ⽅程仍能使⽤,但须⽤?代e ?,s i C 代0i C ,这属于下⼀章的研究内容。
如果传质等步骤是快步骤,⽽电化学步骤成为控制步骤,则这时?偏离e ?是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是⽐较慢的,反应中电荷在界⾯有积累(数量渐增),?随之变化。
由此引起的?偏离就是电化学极化,这时Nernst ⽅程显然不适⽤了,这时?的改变将直接以所谓“动⼒学⽅式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是⼀种特殊的氧化—还原反应(⼀个电极上既有氧化过程,⼜有还原过程)。
若⼀个电极上有净的氧化反应发⽣,⽽另⼀个电极上有净的还原反应发⽣,则在这两个电极所构成的电化学装置中将有电流通过,⽽这个电流刚好表征了反应速度的⼤⼩,)(nFv i v i =∝[故电化学中总是⽤i 表⽰v ,⼜i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也⽤i 表⽰v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发⽣(反应不可逆了),说明电极发⽣了极化,?偏离了平衡值,偏离的程度⽤η表⽰,极化的⼤⼩与反应速度的⼤⼩有关,这⾥就来研究i ~?⼆者间的关系。


第六章电子转移步骤动力学电子转移是指电子从一个原子或分子向另一个原子或分子的跃迁。
这个转移过程可以通过多种方式发生,比如离子交换、电子传递等。
在化学反应中,电子转移步骤是非常重要的,对反应速率和产物选择性有着显著影响。
因此,研究电子转移步骤动力学是理解和控制化学反应的关键。
电子转移过程中,电子的跃迁通常伴随着原子或分子的几何变化。
这种几何变化可以通过分子轨道理论和能带理论等方法进行描述。
通过这些理论,我们可以计算得到电子转移过程的能垒和反应路径,并进一步分析其动力学特性。
在电子转移步骤的动力学研究中,我们经常使用催化剂来促进转移过程。
催化剂可以提供一个较低的能垒,从而加速反应速率。
催化剂通常通过与反应物形成配位键或中间体来实现对反应的加速作用。
通过研究催化剂的结构和反应机理,我们可以深入理解电子转移步骤的动力学行为。
另一个重要的研究方法是通过动力学实验来研究电子转移步骤。
动力学实验的基本原理是测量反应速率随时间的变化。
通过改变反应条件,如温度、压力和浓度等,我们可以探究电子转移步骤的温度和压力依赖性,以及反应物浓度对反应速率的影响。
通过这些实验数据,我们可以确定反应的速率常数和反应级数,并进一步分析反应机理。
除了实验研究,理论计算也在电子转移步骤动力学研究中发挥了重要作用。
量子力学和分子动力学模拟等计算方法可以提供详细的分子层面的信息,如反应势能面、反应路径和能量障碍等。
通过理论计算,我们可以预测反应速率常数、反应物选择性和反应动力学行为,为实验研究提供重要参考。
总之,电子转移步骤动力学研究是理解和控制化学反应的重要手段。
通过研究电子转移过程的动力学特性,可以揭示反应机理和反应条件对反应速率和产物选择性的影响。
这一领域的研究对于发展新型催化剂、设计高效反应体系以及理解生命现象等具有重要意义。




电荷转移过程的动力学研究电荷转移是物理学中的一个重要研究领域,它主要涉及到电子的传递和移动。
电子是物质的基本组成部分,而电子的传递和移动过程则是物质转化和化学反应的关键步骤。
因此,研究电荷转移过程的动力学非常重要,它不仅对于理解物质的性质和行为具有重要的意义,而且还对于开发新型材料和改进现有材料的性能具有重要的指导作用。
电荷转移过程主要包括两个过程:电子的捐赠和接受。
在电子捐赠过程中,一个原子或分子会将其外层电子捐赠给另一个原子或分子,从而形成正离子和负离子。
在电子接受过程中,正离子和负离子会重新结合,恢复为中性原子或分子。
电子的捐赠和接受过程是非常复杂的,并且涉及到许多因素。
这些因素包括分子的结构、环境的物理和化学特性、化学反应的速率等。
为了研究这些因素对电荷转移过程的影响,科学家们使用了许多不同的技术和方法。
其中,最常用的技术是光电离技术和电子能量损失谱(ELS)技术。
光电离技术通过使用激光脉冲来激发分子中的电子,从而促进电子的捐赠和接受过程。
ELS技术则是利用电子的散射和吸收过程来研究电荷转移过程。
这些技术需要高度精密的仪器和设备,以确保数据的准确性和可靠性。
除了这些基本技术外,科学家们还使用了许多先进的技术和方法来研究电荷转移过程的动力学。
其中,最重要的技术之一是分子动力学模拟。
这种技术会模拟分子内部的运动轨迹和相互作用,从而提供有关分子结构和化学反应的重要信息。
此外,科学家们还利用红外光谱和拉曼光谱等技术来研究电荷转移过程的动力学。
这些技术通过测量分子中振动的频率和强度等参数来提供分子结构和化学反应的信息。
总的来说,电荷转移过程的动力学研究是一个非常复杂的领域,涉及到多种技术和方法。
虽然我们仍然需要进一步完善这些技术和方法,但是已经取得了一些非常重要的研究成果。
可以预见,未来的电荷转移研究将会更加深入和系统化,为我们的生活和工作带来更多的益处和发展。


第五章电荷转移步骤动力学与电化学极化电荷转移步骤动力学与电化学极化是物理学中重要的研究领域之一,在材料科学、化学和电子工程等领域都有广泛的应用。
本文将从电荷转移步骤动力学和电化学极化两个方面进行介绍和讨论。
第五章:电荷转移步骤动力学电荷转移步骤动力学研究的是在化学反应、光电子器件和电池等过程中,电子和离子的传输过程。
这个过程通常包括以下几个步骤:电子从一个分子或物质转移到另一个分子或物质上,并伴随着电荷的重分布,使得系统的总能量发生变化。
这个过程的速率决定了反应动力学和物质传输的效率。
在电子转移步骤中,电荷输运的主要方式有两种:自由扩散和有界扩散。
自由扩散是指电荷无需受到限制地运动,而有界扩散是指电荷移动受到限制,比如在电极表面或界面处。
这两种方式的动力学行为有很大的差异,需要针对不同的应用场景进行研究和优化。
在电化学反应中,电荷转移步骤动力学对于理解反应速率和机制至关重要。
电荷转移反应通常包括电子转移和离子转移两个方面,比如在电化学电池中,电子可以从阴极转移到阳极,离子则在电解质中进行扩散。
这个过程经常涉及电极表面的催化作用和界面扩散效应,需要深入研究以提高电化学反应效率和电池性能。
另外,在光电子器件中,电荷转移步骤动力学也是一个重要的研究方向。
比如在太阳能电池中,光子的能量可以激发电子从价带跃迁到导带,形成电荷分离和传输。
了解光电子转移的动力学过程有助于设计和制备更高效的太阳能电池材料和结构。
电化学极化是指电化学系统中,由于电荷转移和离子扩散引起的极化现象。
在电化学过程中,电子和离子的传输会导致电位和电流的分布不均,进而引发电化学极化。
电化学极化可以分为电势极化、浓度极化和阻抗极化等几种不同类型。
电势极化是指由于电流通过电解质中导致的电位差,在电解质中产生的电场会改变电荷传输的速率。
浓度极化是指由于电极表面处离子浓度不均匀引起的电位差,从而影响电荷转移速率。
阻抗极化是指由于电池内部电阻的存在而影响电流的分布和传输速率。
化学反应中的电子迁移过程电子是化学反应中的重要参与者之一。
在化学反应中,电子的迁移过程起着至关重要的作用。
本文将深入探讨化学反应中的电子迁移过程及其相关机制。
1. 电子迁移的基本概念电子迁移是指电子从一个原子或分子跃迁到另一个原子或分子的过程。
在电子迁移过程中,电子会从高能级跃迁到低能级,或者从一个原子或分子上的轨道跃迁到另一个原子或分子上的轨道。
2. 电子迁移的驱动力在化学反应中,电子迁移的驱动力可以由多种因素产生。
其中,能级差是主要的驱动力之一。
当两个物质的能级存在差异时,电子会通过电子迁移来寻求更低的能态。
此外,电子的电荷和电场也是电子迁移的驱动力,具有不同电荷的物质之间会发生电子迁移。
3. 电子迁移的机制化学反应中的电子迁移可以通过不同的机制进行。
以下是一些常见的电子迁移机制:a. 直接电子转移:发生在两个相邻的原子或分子之间,电子直接从一个轨道转移到另一个轨道。
b. 间接电子转移:发生在电子自由度不同的两个分子之间,一种典型的例子是氧化还原反应中的电子转移。
c. 界面电子转移:电子从一个相界面转移到另一个相界面,例如电化学反应中的电子在电极和电解质之间的转移。
4. 电子迁移的应用电子迁移在化学反应和材料科学领域具有广泛的应用价值。
在化学合成中,电子迁移是许多有机合成反应的关键步骤。
在能源存储和转换中,电子迁移在电池、太阳能电池和燃料电池等设备中发挥着重要的作用。
此外,电子迁移还在电化学分析和催化反应中发挥着重要的作用。
电子迁移的理解和控制有助于开发新的催化剂和改进化学反应的效率。
总结:化学反应中的电子迁移是一种重要的动力学过程,它驱动着不同物质之间的转化和变化。
电子迁移的机制多样,可以通过直接转移、间接转移和界面转移等方式进行。
电子迁移在化学合成、能源存储和转换、电化学分析和催化反应等领域具有广泛的应用。
深入理解电子迁移的机制和应用有助于推动化学科学的发展和技术的进步。
通过对化学反应中的电子迁移过程的研究,我们可以更好地理解和控制化学反应的机理,提高反应的效率,并开发出更高效的催化剂和新型材料。
电化学反应中的电子传输与反应动力学电化学反应是化学反应中较为特殊的一类,它具有显著的电化学性质,因此不仅仅是一个化学反应,还需要考虑电子传输和反应动力学等因素。
本文将详细介绍电化学反应中的电子传输与反应动力学。
一、电子传输在电化学反应中,电子传输是反应进行的核心,也是反应能够发生的原因。
电子传输常见于氧化还原反应,其中电子从电极上转移到溶液中的物质上,从而发生氧化还原反应。
电子传输的速率很快,因为电子具有质量很小、电荷很大、速度很快的特点。
在传导电子的过程中,为了防止电子的散失,电子传输的通路必须是良好的电子导体,如金属电极、导电聚合物等。
在这些导体上,电子通过金属键、离子键等方式进行传输。
电子传输需要遵循一定规律,即按照一定方向传输,否则反应无法进行。
在降低电势的一侧,即负极一侧,电子从电极上释放出来,进入溶液中的物质分子,使其被还原。
而在提高电势的一侧,即正极一侧,溶液分子失去电子,被氧化。
二、反应动力学反应动力学是研究反应速率的学科,也对电化学反应有着重要的影响。
反应动力学告诉我们反应的速率受到哪些因素的影响,如温度、浓度等,从而帮助我们优化反应条件,提高反应效率。
在电化学反应中,反应速率主要受到电极电位、电极材料、溶液浓度、温度等因素的影响。
当这些因素改变时,反应速率也会产生对应的变化。
例如,当电极电位提高时,即提高了反应的斯特恩层数值,反应速率也会提高;当溶液中反应物浓度升高时,反应速率也会随之提高;而随着温度升高,反应速率也会增大,因为高温能够提高反应物的反应能力。
三、应用场景电化学反应具有广泛的应用场景,其中最著名的就是电池。
电池就是一种利用电化学反应,将化学能转化为电能的装置。
电池的原理是将正负两极的电解质或电极材料相隔离,使之电子无法自由传递,使得电子仅能通过外部电路进行传递,从而产生电势差,驱动电器进行工作。
此外,电化学反应还广泛应用于其他领域,如化学分析、电镀、腐蚀防护、电解制氢等。