两种转染试剂转染 C2C12 细胞效率比较分
- 格式:doc
- 大小:66.00 KB
- 文档页数:11

广东转染试剂类型
广东转染试剂类型
广东省作为全国经济重心之一,其科技实力在行业内也是一直走在前列。
转染试剂作为生物科研中不可缺少的试剂之一,在广东制造商也
有相当的生产水平和供应能力。
转染试剂,是指将外来的目的基因(DNA、RNA等)引入到靶细胞内,并使其表达的试剂。
其种类繁多,在广东也有着相应的常规类型。
1. 磷脂体基转染试剂
主要由磷脂体和质粒DNA组成,优点是容易制备和操作,适合于大规模生产。
缺点是转染率相对不高,有一定的毒性。
2. 聚乙烯酰胺转染试剂
聚乙烯酰胺(PEI)是一种化学合成剂,使用时与DNA分子组合形成
复合物,可以将DNA有效转染到细胞内。
优点是转染率高且毒性低,目前在广东科研中得到广泛应用。
3. 蛋白质/肽转染试剂
蛋白质/肽转染试剂通常是根据蛋白质或肽与DNA分子的作用机制设计制备的,可以有效地将目的分子转染到靶细胞内。
优点是转染效率高且无毒性,但缺点是价格昂贵。
4. 常规转染剂
常规转染剂是一类较为通用的转染试剂,主要包括羧甲基纤维素钠(CMC-Na)、聚乙烯醇(PVA)、去离子水等,优点是价格低廉且易于操作,但其转染效率较低,通常适用于一些较为简单的试验。
总体来说,转染试剂在广东科研中扮演着不可或缺的角色,其种类繁多,需根据实验需要选择合适的试剂。
在使用转染试剂时,需注意试剂质量和实验条件,以确保实验结果的准确性和科学性。

提高Lipofectamine2000对PC12细胞转染效率的研究邱烨【摘要】目的探讨提高PC12细胞转染效率的方法.方法细胞培养板用10 μg/mL Ⅰ型牛胶原蛋白包被,通过在转染过程中加入9 μmol/L趋溶酶体试剂氯喹及8μmol/L聚胺类试剂亚精胺,同时调整Lipofectamine2000与DNA用量的比例和转染时间.考察DNA与Lipofectamine2000的比例对PC12细胞转染效率的影响,转染时间对PC12细胞转染效率的影响,氯喹、亚精胺用量对PC12细胞转染效率的影响,氯喹、亚精胺对PC12细胞活性的影响,氯喹、亚精胺对PC12细胞神经轴突生长的影响及与4种常用脂质体转染试剂对PC12细胞转染效率的比较.结果①对PC12细胞转染,DNA:Lipofectamine2000用量比例应控制在1∶4.②当转染时间分别为1、2、4、8、24 h时,PC12细胞转染率分别为35.5%、37.9%、40.5%、40.3%及38.6%,4h达到最大转染效率.③氯喹、亚精胺加入浓度的增加,PC12细胞转染效率随之增加,当氯喹、亚精胺加入终浓度分别增至9μmol/L和8μmol/L时,PC12细胞的转染效率最高,转染效率为40.5%.④加入终浓度为9μmol/L氯喹与8μmol/L亚精胺前、后MTT试验吸光度(590 nm)分别为(0.466±0.042)与(0.451±0.038),差异无统计学意义(P>0.05),对PC12细胞的活性无影响.⑤加入氯喹、亚精胺前、后,PC12细胞的神经轴突生长数量与长度差异无统计学意义(P>0.05).⑥FuGENE、PolyJet、Lipofectamine LTX and Plus、Lipofectamine2000 4种脂质体转染试剂对PC12细胞转染效率分别为10.5%、8.6%、11.8%及15.3%,本法PC12细胞转染率为40.5%,差异有高度统计学意义(P<0.01).结论加入氯喹及亚精胺,实现阳离子脂质体Lipofectamine2000对PC12细胞的高效转染,为PC12细胞进行神经细胞基因功能及开发遗传病治疗方案等生物学研究提供了一种安全、廉价的新方法.【期刊名称】《中国医药导报》【年(卷),期】2014(011)003【总页数】5页(P20-22,26,封3)【关键词】PC12细胞;Lipofectamine2000;阳离子脂质体/DNA复合物;氯喹;亚精胺【作者】邱烨【作者单位】浙江省湖州市南浔区中西医结合医院检验科,浙江湖州313009【正文语种】中文【中图分类】R735.7PC12细胞诱导产生的神经轴突能作为研究神经退行性疾病及脊柱损伤的研究模型[1-2],也是研究神经内分泌试验的模型[3]。

转染试剂的作用原理一、转染试剂的基本概念转染试剂是一种用于将外源基因或其他生物分子转移到目标细胞中的化学物质。
转染试剂可以通过物理或化学方法改变细胞的通透性,使外源物质能够进入细胞内,并达到转染的目的。
转染试剂在基因治疗、基因表达研究和细胞工程等领域广泛应用。
二、转染试剂的分类转染试剂按照机理和性质的不同可分为多种类型,常见的转染试剂包括:1.脂质体(Liposome):脂质体是由磷脂双分子层构成的微小囊泡,可与细胞膜融合,将目标物质转移到细胞中。
2.内源蛋白介导的转染:通过利用特定的蛋白质,如病毒衣壳蛋白或细胞内运输蛋白,将目标物质转移到目标细胞中。
3.阳离子聚合物:阳离子聚合物具有正电荷,能够与负电荷的DNA或RNA结合形成复合物,进而转染入细胞。
4.高分子基质:高分子材料如凝胶、纤维或微球等可用于载体,将目标物质与细胞接触,实现转染。
5.电穿孔:利用电场或离子流导致细胞膜破裂,使目标物质通过细胞膜进入细胞质。
三、脂质体转染试剂的作用原理脂质体是一种常用的转染试剂,其作用原理主要包括以下几个步骤:1.与DNA结合:脂质体通过与目标DNA相互作用,形成脂质体-DNA复合物。
脂质体由于其亲油性能与DNA中的疏水部分相互作用,同时脂质体表面带有正电荷,可以与DNA的负电荷相吸引。
2.细胞摄取:脂质体-DNA复合物与细胞膜结合后,脂质体会在细胞膜上形成微囊泡。
随后,微囊泡与细胞膜融合,释放出脂质体-DNA复合物进入细胞质。
3.脱脂质体:脂质体在细胞质中逐渐失去其亲油性,释放出DNA。
由于脂质体-DNA复合物在细胞膜上的微囊泡中形成的电位差,使得DNA被吸引到细胞核附近。
4.核入:DNA由细胞质进入细胞核,最终与染色体结合或进入细胞核内的胞浆,实现转基因。
四、脂质体转染试剂的优缺点脂质体转染试剂具有一些优点和缺点,需要根据实际应用情况选择使用:优点:1.安全性:脂质体转染试剂大多采用合成非病毒载体,通常比病毒载体更安全,不会引起病毒感染及遗传毒性。

三种非病毒载体转染方法的比较
刘新宇;梁东春;张镜宇
【期刊名称】《天津医科大学学报》
【年(卷),期】2003(009)004
【摘要】目的:对目前广泛使用的磷酸钙转染法、脂质体转染法以及新兴的壳聚糖转染法这三种非病毒转染载体进行比较.方法:以成肌细胞系C2C12为宿主细胞,含氯霉素乙酰转移酶(CAT)报告基因的质粒pcDNA 3.1+CAT为靶DNA,采用3种不同的方法转染细胞,酶联免疫吸附测定(ELISA)细胞裂解液中CAT的相对含量.结果:脂质体法转染的细胞裂解液中CAT含量最高,磷酸钙法所转染的细胞裂解液中CAT 含量最低.结论:经商品化的转染试剂lipofectamine 2000在此三种转染试剂中具有最高的转染效率.作为一种天然材料,壳聚糖亦有较高的转染效率.
【总页数】3页(P456-458)
【作者】刘新宇;梁东春;张镜宇
【作者单位】天津医科大学生化教研室,天津,300070;天津医科大学内分泌研究所;天津医科大学内分泌研究所
【正文语种】中文
【中图分类】Q78
【相关文献】
1.三种不同方法转染THP-1巨噬细胞效果比较 [J], 颜文杰;孙文逵;李培;苏欣;施毅
2.病毒与非病毒载体转染新生大鼠血管纹边缘细胞的比较研究 [J], 杨阳;孔维佳;李
隽;胡钰娟;钟毅;郝亚楠;赵学艳;彭炜
3.三种非病毒载体对神经母瘤细胞进行转染的效果比较 [J], 高聪;李威;梁兵;袁芳;谢富华;林哲聪
4.非病毒载体介导脑源性神经营养因子基因转染骨髓间充质干细胞:脂质体及电穿孔转染法的比较 [J], 陈观贵;刘谦虚;谢鼎华
5.三种方法浓缩慢病毒后绿色荧光蛋白转染效率的比较 [J], 毕冉冉;白睿;刘志强;刘惠亮
因版权原因,仅展示原文概要,查看原文内容请购买。

miR-127-3p对C2C12细胞成肌分化和转录组的影响SONG Tianzeng;LI Jie;MA Jinying;JIANG Jing;WANG Gaofu;FU Lin;ZHOU Peng;MA Youji;REN Hangxing【摘要】前期研究表明,miR-127-3p参与骨骼肌细胞分化的调控,但对于miR-127-3p调控的靶基因及其在成肌分化中的作用还不清楚.应用qRT-PCR与细胞形态学方法研究过表达miR-127-3p对C2C12成肌细胞分化及成肌标志基因MyoD、MyoG和Myosin表达的影响;RNA-Seq分析过表达miR-127-3p对成肌细胞转录组的影响,鉴定差异表达基因并对其功能进行初步研究.结果表明,过表达miR-127-3p显著促进C2C12细胞的成肌分化与MyoD、MyoG和Myosin表达;RNA-Seq分析共鉴定到3个差异基因,均为下调基因,其中包括2个转录因子(Irf7和Ddit3).GO与KEGG分析显示,这些差异基因显著富集于免疫和能量代谢过程/信号通路.生物信息学分析发现,miR-127-3p可与Ddit3基因的CDS区发生碱基互补配对,进而抑制其表达.表明在转录组水平上,miR-127-3p可能通过直接靶向Ddit3基因/转录因子调控免疫与能量代谢类基因的表达,进而调节成肌细胞分化.【期刊名称】《西北农业学报》【年(卷),期】2019(028)001【总页数】9页(P8-16)【关键词】RNA-Seq;microRNA;过表达;C2C12;成肌分化【作者】SONG Tianzeng;LI Jie;MA Jinying;JIANG Jing;WANG Gaofu;FU Lin;ZHOU Peng;MA Youji;REN Hangxing【作者单位】;;;;;;;;【正文语种】中文【中图分类】S826骨骼肌的形成是一个非常复杂的生物学过程,包括成肌决定,成肌细胞增殖,细胞周期的退出,肌肉特异性基因的表达,肌细胞融合形成多核肌管,多核肌管再经过一系列发育变化,最后分化成为具有功能的成熟肌纤维[1-2]。

细胞转染的各种方法比较梭华-Sofast TM基因转染试剂(高效率和细胞毒性低的聚阳离子转染试剂)梭华-Sofast TM是新一代的阳离子聚合物基因转染试剂,梭华-Sofast TM具有高效率转染所必备特征,如浓缩DNA,将DNA运送到细胞内,并使其在细胞核内释放等;梭华-Sofast TM 的细胞毒性很低,这是它的另一个重要特点;而且与其它转染试剂相比,梭华-Sofast TM很稳定,不被血清清除。
以上优点使得基因转染的操作简便易行,重复性好。
梭华-Sofast TM 已被成功应用于很多原代培养细胞和转化细胞株的基因转染。
一. 特点★转染效率高且稳定,比目前常用产品高10%。
★细胞培养基中的血清存在与否,均能获得高效率转染。
★细胞毒性低。
★转染程序简单,转染前后无需更换培养基转染实验可以在半小时内完成。
★价格比进口产品便宜60%。
★完善的技术支持,保证质量,无效退货。
二. 效果比较将梭华转染试剂与其它公司的聚阳离子转染试剂和常用的脂质体转染试剂分别在常用的报告基因如GFP、荧光素酶基因和LacZ基因的转染效率方面作了对比。
实验表明:1. 梭华-Sofast TM具有很高和稳定的转染率,是一种很好的基因转染试剂。
对某些常用的细胞株梭华-Sofast TM 转染率高于某常用阳离子脂质体,对其他多数细胞株的转染效率相近。
2. 需特别指出梭华-Sofast TM在原代培养细胞HUV-EC中有较高的转染效率,而大多数阳离子脂质体对此细胞的转染效率很低。
3. 通过检测转染细胞荧光素酶基因的活性,测定其转染效率。
实验表明梭华转染试剂具有最高的转染率。
4. 通过检测转染GFP基因的细胞所发出的荧光强度来测试转染效率,实验发现梭华转染试剂的转染率比常用的脂质体转染试剂转染率高达5-10%。
三. 适用范围☉适应于众多原代培养细胞和转化细胞株的基因转染。
☉适用于瞬时转染和稳定转染。
☉适应于贴壁细胞和悬浮细胞转染。
四. 各种转染方法的比较(在目前使用的方法中, 阳离子聚合物转染法是最好的转染试剂。
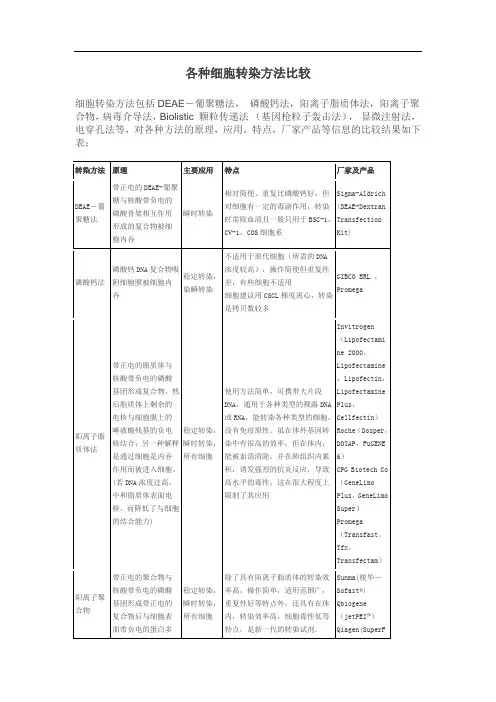
各种细胞转染方法比较细胞转染方法包括DEAE-葡聚糖法,磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic 颗粒传递法(基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表:转染方法原理主要应用特点厂家及产品DEAE-葡聚糖法带正电的DEAE-葡聚糖与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时转染相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于BSC-1,CV-1,COS细胞系Sigma-Aldrich(DEAE-DextranTransfectionKit)磷酸钙法磷酸钙DNA复合物吸附细胞膜被细胞内吞稳定转染,染瞬转染不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,有些细胞不适用细胞建议用CSCL梯度离心,转染是拷贝数较多GIBCO BRL ,Promega阳离子脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。
(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)稳定转染,瞬时转染,所有细胞使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。
虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用Invitrogen(Lipofectamine 2000,Lipofectamine,Lipofectin,LipofectaminePlus,Cellfectin)Roche(Dosper,DOTAP,FuGENE6)CPG Biotech Co(GeneLimoPlus,GeneLimoSuper)Promega(Transfast,Tfx,Transfectam)阳离子聚合物带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多稳定转染,瞬时转染,所有细胞除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。

2023 ,43(2) : 092J.SHANXI AGRIC, UNIV . ( N atural Science Edition )学报(自然科学版)04185GDF11通过AKT 通路抑制骨骼肌细胞分化张鹏翔,吴佳豪,冀云燕,薛霖莉,董亚洁,宫泽恩,郝晓静,曹校瑞,赫晓燕*(山西农业大学 动物医学学院,山西 晋中 030801)摘要:[目的]探究骨骼肌GDF11(生长分化因子11,Growth and differentiation factor 11)在生长发育过程中的表达情况及其作用,明确GDF11在骨骼肌细胞中激活的非SMAD 调控通路,为抵抗骨骼肌衰老、促进骨骼肌损伤修复,探究肌肉发育调控的相关机制提供理论参考。
[方法]以不同发育阶段小鼠和C2C12细胞为材料,取不同发育阶段小鼠腓肠肌、使用分化培养基诱导细胞分化、使用D⁃半乳糖诱导C2C12细胞衰老,分别探究GDF11在个体层面和细胞层面骨骼肌生长发育和衰老中的表现和作用;通过构建GDF11的过表达载体和siRNA 载体,观察GDF11对C2C12细胞成肌分化的影响,并检测了在这一过程中细胞内相关基因的变化,探究GDF11在骨骼肌细胞发育中影响;通过对AKT 信号通路的抑制,明确GDF11在骨骼肌细胞分化过程中激活的非SMAD 调控通路。
[结果](1)在小鼠腓肠肌中,GDF11蛋白表达量随着年龄的增长呈现出先下降后上升的趋势。
(2)在细胞分化前期GDF11表达量逐渐升高,并在3 d 时细胞开始分化时达到最高,随后逐渐降低,7 d 时恢复到与初始相似的水平。
(3)随着D⁃半乳糖浓度的增加,细胞衰老程度逐渐增加,同时细胞GDF11表达量逐渐增加。
(4)过表达GDF11使细胞分化进程推迟,但抑制GDF11的表达对细胞分化进程并没有影响。
过表达GDF11上调了AKT 的磷酸化水平。
(5)过表达GDF11的C2C12细胞中阻断AKT 通路能够逆转GDF11造成的分化抑制。

两种常用转染试剂转染siRNA至HL-60细胞转染效率的比较王巍;张晓希;刘新光【摘要】目的比较两种常用转染试剂转染小干扰RNA(siRNA)至悬浮细胞的转染效率及对细胞毒性的影响.方法以羧基荧光素(FAM)标记的siRNA为报告基因,以lipofectamine 2000和siPORT NeoFX为转染试剂,用流式细胞仪检测转染效率,倒置显微镜观察细胞形态,MTT法检测细胞存活率.结果 siRNA>100 nmol/L 时,lipofectamine 2000的转染效率高于siPORT NeoFX(P<0.05);siRNA<100 nmol/L时,前者低于后者(P<0.05).siRNA终浓度及转染试剂用量相同时,lipofectamine 2000组HL-60细胞存活率与SiPORT NeoFX组比较,差异无统计学意义(P>0.05).结论在使用高浓度siRNA时,lipofectamine 2000对HL-60细胞有较高的转染效率和较小细胞毒性.%Objective To compare the transfection efficiency and cytotoxicity between two cationic transfection reagents. Methods Small interfering RNA(siRNA) marked with FAM as a report gene,lipofectamine 2000 and siPORT NeoFX were used as the transfection reagents. Flow cytometer,microscope and MTT assay were used to detect transfection efficiency and cytotoxicity. Results The transfection efficiency of lipofectamine 2000 was higher than siPORT NeoFX when siRNA was over 100 nmol/L(P<0.05) ,otherwise with siRNA under 100 nmol/L(P<0. 05). At the same siRNA concentration and transfection reagent volume, there was no significant difference of vial cells ratios between two groups(P>0.05). Conclusion lipofectamine 2000is an effective and safe transfection reagent to HL-60 cells when siRNA is over 100 nmol/L.【期刊名称】《重庆医学》【年(卷),期】2011(040)004【总页数】4页(P313-314,318,封2)【关键词】脂质体;转染;RNA,小分子干扰【作者】王巍;张晓希;刘新光【作者单位】广东医学院临床血液检验学教研室,东莞,523808;中国人民解放军第四二二医院,广东湛江,524023;广东医学院检验医学研究所,东莞,523808【正文语种】中文RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA 诱发的、同源mRNA高效特异性降解的现象[1-3]。

C2C12细胞的传代培养及诱导分化实验报告C2C12细胞的传代培养及诱导分化实验报告:通过短暂的高电场电脉冲处理细胞,但转染原代细胞比较困难:非病毒载体、细胞孵育时间乃至各组分加入顺序和混合的方式都可能对结果产生影响:新一代的脂质体技术,pH值。
脂质体法。
活化的树状聚合物。
电脉冲和场强的优化对于成功的转染非常重要,使得DNA复合物结合在带负电的细胞表面,从而吸附到带负电的细胞膜表面。
理论上说电穿孔法可用于各种细胞,借助脂质膜将DNA导入细胞膜内,抑制降解活性。
磷酸钙共沉淀转染:需要电转仪器:中性脂质体是利用脂质膜包裹DNA,对原代细胞还可以,状态很不好。
每种细胞电转的条件都需要进行多次优化,不同细胞条件要自己摸索,经过包装细胞的包装得到改造后的病毒,可重复性好,且不需要另外采购特殊试剂、DNA浓度,经内吞进入细胞对原代培养的细胞,再进行感染,经过内吞被导入细胞。
DEAE-葡聚糖仅限于瞬时转染。
非脂质体的脂质,借助内吞作用进入细胞质,其与DNA结合形成胶束结构而非简单的双层膜结构,选择比较好的转染试剂。
活化的氨基可以调节胞内溶酶体pH值。
带正电的DEAE-葡聚糖或polybrene多聚体可以结合带负电的DNA分子。
转染效率高,缓冲液非常有讲究,推荐QIAGEN的superfect转染试剂,沿细胞膜的电压差异会导致细胞膜的暂时穿孔、活体细胞。
实验小站细胞转染操作方法及各方法比较转染,是将外源性基因导入细胞内的一种专门技术。
随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。
转染大致可分为物理介导、化学介导和生物介导三类途径。
电穿孔法、显微注射和基因枪属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态,到转染方法的操作细节,都需要考虑。
一、细胞传代1. 试验准备:200ul/1mlTip 头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。
2. 弃掉培养皿中的培养基,用 1ml 的 PBS 溶液洗涤两次。
3. 用 Tip 头加入 1ml Trypsin 液,消化 1 分钟(37℃,5%CO2 )。
用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
4. 加入 1ml 的含血清培养基终止反应。
5. 用 Tip 头多次吹吸,使细胞完全分散开。
6. 将培养液装入离心管中,1000rpm 离心 5min。
7. 用培养液重悬细胞,细胞计数后选择0.8X106 个细胞加入一个35mm 培养皿。
8. 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
9. 将培养皿转入 CO2培养箱中培养,第二天转染。
doidoi:10.3969/j.issn.1002-2481.2022.03.05山西农业科学2022,50(3):314-318Journal of Shanxi Agricultural Sciences Mimics转染PC12细胞条件的优化任静,郝琴琴,成俊丽,李鹏飞(山西农业大学生命科学学院,山西太谷030801)摘要:PC12作为模式细胞已被广泛应用于多种疾病研究。
为探究高效、低毒的PC12的细胞转染方法,试验采用化学转染法,以带有5′-羧基荧光素(FAM)标记的NC mimics作为外源基因,分别用RFect、D-Portal、Tran‑sIntro TM EL、Lipofectamine3000和Lipofectamine2000等5种转染试剂转染PC12细胞以筛选最佳转染试剂;然后设置NC-FAM mimics浓度为50、60、70、80、90、100nmol/L,通过倒置荧光显微镜观察PC12细胞在最佳转染试剂下的荧光信号对转染效果进行评定。
结果表明,在相同的培养条件下,不同转染试剂对PC12细胞的转染效果之间存在较大差异,其中,TransIntro TM EL转染后荧光强度最高,D-Portal、Lipofectamine3000和Lipofectamine2000转染后荧光信号次之,RFect转染后荧光信号最弱;且不同处理对细胞损害无显著差异。
以TransIntro TM EL作为最佳转染试剂进一步优化NC-FAM mimics转染浓度发现,荧光强度随NC-FAM mimics浓度的增加呈现先增强后降低的趋势,且在NC-FAM mimics浓度为70nmol/L时荧光信号最强;此外不同浓度下的细胞数量无显著差异。
综上可见,以TransIntro TM EL作为转染试剂、NC-FAM mimics浓度为70nmol/L时,转染后PC12细胞荧光强度最高,转染效果最好。
关键词:PC12;化学转染法;TransIntro TM EL;NC-FAM mimics;荧光信号中图分类号:Q78文献标识码:A文章编号:1002-2481(2022)03-0314-05Optimization of Mimics Transfection Conditions in PC12CellsREN Jing,HAO Qinqin,CHENG Junli,LI Pengfei(College of Life Science,Shanxi Agricultural University,Taigu030801,China)Abstract:PC12cells has been widely used as a model for researches on many diseases.To explore transfection methods of PC12cells with high efficiency and low toxicity,in this study,using chemical transfection and taking5'-carboxyfluorescein (FAM)-labeled NC mimics as the foreign gene,five different chemical transfection reagents(RFect,D-Portal,TransIntro TM EL,Lipofectamine3000and Lipofectamine2000)were applied to transfect PC12cells for screening the optimal transfection reagent.Then,concentrations of NC-FAM mimics were set to50、60、70、80、90、100nmol/L,and transfection effects were evaluated by observing fluorescence signal of PC12cells with the optimal transfection reagent under an inverted fluorescence microscope.The results showed that transfection effects between different transfection reagents were significantly different on PC12cells under the same culture condition.The TransIntro TM EL had the highest fluorescence intensity,the group of D-Portal、Lipofectamine3000and Lipofectamine2000took the second place and the RFect had the lowest.In addition,there was no significant difference on injury of cells by different treatments.The further results showed that the trend of fluorescence intensity was first increased and then decreased with increase of the NC-FAM mimics concentration when TransIntro TM EL was taken as the optimal transfection reagent to optimize the NC-FAM mimics transfection concentration.And fluorescence signal was the strongest when the concentration of NC-FAM mimics was70nmol/L.There was also no significant difference on amounts of cells by different concentration.In summary,the PC12cells transfected with the concentraion of70nmol/L of NC-FAM mimics by Transintro TM EL as the optimal transfection reagent in this study had the highest-intensity fluorescence and the best transfection effect.Key words:PC12;chemical transfection;TransIntro TM EL;NC-FAM mimics;fluorescence signal将外源基因导入真核细胞内并使其表达的技术称为细胞转染技术,该技术是研究基因表达调控的重要手段。
转染常用的报告基因报告基因(reporter gene)是一种编码可被检测的蛋白质或酶的基因,是一个其表达产物非常容易被鉴定的基因。
把它的编码序列和基因表达调节序列相融合形成嵌合基因,或与其它目的基因相融合,在调控序列控制下进行表达,从而利用它的表达产物来标定目的基因的表达调控,筛选得到转化体。
作为报告基因,在遗传选择和筛选检测方面必须具有以下几个条件:(1)已被克隆和全序列已测定;(2)表达产物在受体细胞中不存在,即无背景,在被转染的细胞中无相似的内源性表达产物;(3)其表达产物能进行定量测定。
在植物基因工程研究领域,已使用的报告基因主要有以下几种:胭脂碱合成酶基因(nos)、章鱼碱合成酶基因(ocs)nos、ocs这两个基因是致瘤土壤农杆菌(Agrobacterium tumfaciens)的Ti质粒特有的,对Ti质粒进行改造,用相应的致瘤农杆菌转化植物体时,如果外源基因转入植物体中,则这两种报告基因在植物根茎叶中均能表达,不受发育调控,检测时直接用转化体提取液进行纸电泳,染色后在紫外光下观察荧光即可。
新霉素磷酸转移酶基因(nptⅡ)、氯霉素乙酰转移酶基因(cat)nptⅡ、cat及庆大霉素转移酶基因,均为抗生素筛选基因,相关的酶可以对底物进行修饰(磷酸化、乙酰化等),从而使这些抗生素失去对植物生长的抑制作用,使得含有这些抗性基因的转化体能在含这些抗生素的筛选培养基上正常生长,也可以用转化体提取液体,外用同位素标记,放射自显影筛选转化体。
氯霉素乙酰转移酶基因测时可通过放射自显影观察荧光素酶基因(luciferase Gene)1985年从北美荧火虫和叩头虫cDNA文库中克隆出来的,该酶在有ATP、Mg2+、O2和荧光素存在下发出荧光,这样就可用转基因植物整株或部分直接用X-光片或专门仪器进行检测。
具有检测速度快、灵敏度比cat基因高30~1000倍、费用低、不需使用放射性同位素等优点,得到了广泛的采用。
两种转染试剂转染 C2C12 细胞效率比较分精品论文两种转染试剂转染 C2C12 细胞效率比较分析韦伟,赵元元,张维娅,赵书红,李新云5 ,农业动物遗传育种与繁殖教育部重点实验室~华中农业大学~武汉 430070, 摘要:C2C12 细胞是鼠的骨骼肌成肌细胞~常用于体外研究肌细胞成肌分化~研究表明 C2C12 细胞的转染效率较低~为了提高 C2C12 细胞的转染效率~建立理想的转染条件~本研究对比分析了 FuGENE HD 和 Lipofectamine 2000 两种常用转染试剂的转染效率。
研究结果表明10 FuGENE HD 转染寡核苷酸的效率比 Lipofectamine 2000 高~而转染质粒的效率比Lipofectamine 2000 低。
另外我们还发现培养基中的血清会降低细胞的转染效率。
本研究结果为提高 C2C12 细胞的转染效率提供了新的信息。
关键词:转染效率,寡核苷酸,质粒,C2C12 细胞中图分类号:Q-3315Compare analysis of the transfection efficiency of twotransfection regents in C2C12 CellsWei Wei, Zhao Yuanyuan, Zhang Weiya, Zhao Shuhong, Li Xinyun(Key Lab of Agricultural Animal Genetics, Breeding and Reproduction of Ministry of Education,20 Huazhong Agricultural University, WuHan 430070)Abstract: C2C12 cells are the myoblast of mice, which are used asthe model for investigating the differentiation of myoblast in vitro. The transfection efficiency of the C2C12 cells was not good in many studies. In order to improve the transfection efficiency of C2C12 cells and contribute an ideal condition of transfection. The transfection efficiency of two transfection reagents, FuGENE25 HD and Lipofectamine 2000, was analyzed in this study. According the results, the transfection efficiency of FuGENE HD was higher than that of Lipofectamine 2000 when oligo nucleic acids was transfected, but it was lower than Lipofectamine 2000 when plasmid was transfected in the C2C12 cells. Also, we found that serum in cultured medium could inhibit the transfection efficiency. These results offered useful informationfor improving the transfection efficiency of30 C2C12 cells.Key words: transfection efficiency; oligo nucleic acids; plasmid;C2C12 cells0 引言简转染是指将外源遗传物质转入到真核细胞内的过程。
转染对现代分子生物学研究意义35 重大,它解决了外源遗传物质导入细胞的难题,为在细胞水平上进行基因功能研究奠定了基础。
转染技术多种多样,按外源遗传物质是否与基因组整合来分,转染技术分为瞬时转染和稳定转染两大类。
按转染实施手段来分,转染技术分为物理转染法和化学转染法两大类。
常见的物理转染方法有显微注射、电穿孔、基因枪、光学转染等;化学转染法包括 DEAE-葡聚糖法、磷酸钙法、人工脂质体法等。
转染技术的选择会影响细胞转染效率,进而影响到实40 验结果。
因此在进行细胞转染前,应该对转染过程中涉及的因素进行综合分析,以便筛选出针对特定细胞转染的最适方法和条件。
阳离子脂质体因其转染效率高、安全(可降解)、操作简便等原因而倍受关注(1,2),现广泛用于人和其他哺乳动物细胞系或体内细胞的瞬时转染基金项目:本研究受教育部新教师基金项目(20090146120032);国家自然科学基金资助项目(30901020)以及973 项目(2012CB124702)资助。
作者简介:韦伟(1986-),女,博士在读,主要研究方向:骨骼肌生长发育分子机理通信联系人:李新云(1976-),男,副教授,主要研究方向:骨骼肌生长发育分子机理. E-mail:xyli@- 1 -精品论文(3-7)。
目前已有许多研究针对阳离子脂质体的转染效率进行了条件优化,比如 DNA 用量、脂质体和 DNA 的体积质量比、细胞汇合度、脂质体浓度、转染时间等(8-10)。
45 本研究主要对实验室常用的 FuGENE HD 和 Lipofectamine 2000 两种脂质体转染试剂的转染效率进行了对比分析。
我们选取了比较难于转染的鼠 C2C12 成肌细胞,对比分析了这两种转染试剂在 C2C12 细胞中转染寡核苷酸以及质粒的效果。
同时,我们还研究了血清对 C2C12 细胞转染效率的影响。
本研究发现 FuGENE HD 转染寡核苷酸的效率比 Lipofectamine 2000 高,而转染质粒的效率比Lipofectamine 2000 低。
另外,血清会降低 C2C12 细胞的转50 染效率。
1 实验1.1 材料DMEM 高糖、胰酶、胎牛血清(Hyclone 公司);Opti-MEM I Reduced Serum Medium(Gibco 公司);转染试剂 Lipofectamine 2000(Invitrogen 公司);FuGENE HD Transfection55 Reagen(tRoche 公司);FAM 标记的 small RNA 模拟物 FAM-NC(上海吉玛公司);pEGFP-C1及 C2C12 细胞由实验室保存;六孔细胞培养板(Corning 公司)。
1.2 主要仪器CO细胞培养箱为 Thermo Scientific 公司产品,倒置荧光显微镜为 Nicon 公司产品。
21.3 方法60 1.3.1 用 Lipofectamine 2000 和 FuGENE HD Transfection Reagent 向C2C12 细胞中转染FAM-NC 寡核苷酸转染前一天,将 C2C12 细胞接种到六孔细胞培养板,待细胞汇合度达 60~70%时进行转染。
转染之前将细胞分成两组:Lipofectamine 2000 组和 FuGENE HD 组,分别将两组中细胞的培养基换为不含胎牛血清的 DMEM 培养基。
转染时用Opti-MEM I Reduced Serum65 Medium 稀释 Lipofectamine 2000、FuGENE HD 以及 FAM-NC。
稀释后,将FAM-NC 分别与 Lipofectamine 2000、FuGENE HD 混合孵育,使之形成转染复合物。
然后将这两种转染复合物分别加入两组细胞中,转染 6h 后换液。
转染 24h 后弃上清,用 PBS 清洗一次,用倒置荧光显微镜观察两组细胞的荧光数目和强度。
1.3.2 用 Lipofectamine 2000 和 FuGENE HD Transfection Reagent 向C2C12 细胞转染70 pEGFP-C1 载体转染前一天,将 C2C12 细胞接种到六孔细胞培养板,待细胞汇合度达60~70%时进行细胞转染。
转染前细胞分组及换液同上。
转染时用 Opti-MEM I Reduced Serum Medium 稀释 Lipofectamine 2000、FuGENE HD 以及 pEGFP-C1 质粒。
将 pEGFP-C1 质粒分别与两种转染试剂混合,形成转染复合物。
将转染复合物加入到细胞中进行转染,转染效果检查同上。
75 1.3.3 用 Lipofectamine 2000 向带有血清和无血清的 C2C12 细胞中转染FAM-NC 寡核苷酸转染前一天,将 C2C12 细胞接种到六孔细胞培养板,待细胞汇合度达60~70%时进行细胞转染。
在转染之前将细胞分成两组:血清组和无血清组。
分别将两组细胞的培养基换为含 10%胎牛血清的 DMEM 培养基(血清组)和不含胎牛血清的 DMEM 培养基(无血清组)。
- 2 -精品论文80 转染时用 Opti-MEM I Reduced Serum Medium 稀释 Lipofectamine 2000 和 FAM-NC,然后混合形成转染复合物。
将完全相同的转染复合物分别加入两组细胞进行转染。
转染后 6h 统一换成含有 10%胎牛血清的 DMEM 培养基培养。
转染后 24h 检测转染效果,方法同上。
2 结果2.1 C2C12 细胞中 FuGENE HD 转染寡核苷酸的效率比 Lipofectamine 2000 高 85 分别用 FuGENE HD 和 Lipofectamine 2000 向 C2C12 细胞转染 FAM-NC 寡核苷酸,转染 24h 后用荧光倒置显微镜观察两组转染试剂的转染效果。
结果如图 1 所示FuGENE HD 转染试剂组的荧光强度明显高于 Lipofectamine 2000 组,这表明在 C2C12 细胞中转染寡核苷酸,用 FuGENE HD 比用 Lipofectamine 2000 要好。
(a) (b) 90图 1 C2C12 细胞转染 FAM-NC 24h 后的荧光显微照片。
(a)FuGENE HD 转染FAM-NC 的结果;(b)Lipofectamine 2000 转染 FAM-NC 的结果。
Fig. 1 The fluorescence microscopy photos of C2C12 cells when FAM-NC was transfected for 24 hours. (a)FAM-NC was transfected into C2C12 cells using FuGENE HD; (b) FAM-NC was transfected into C2C12 cells95 using Lipofectamine 2000.2.2 C2C12 细胞中 Lipofectamine 2000 转染质粒的效率比 FuGENE HD 高分别用 FuGENE HD 和 Lipofectamine 2000 向 C2C12 细胞转染 pEGFP-C1 质粒,转染 24h 后用荧光倒置显微镜观察两组转染试剂的转染效率。