化药制剂生产工艺信息表new
- 格式:doc
- 大小:65.50 KB
- 文档页数:2
制剂CTD格式申报资料4、5.2类3.2.P 制剂3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1(注:表格依次编号,下同):处方(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
3.2.P.2 产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2.P.2.1处方组成3.2.P.2.1.1原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2.P.2.1.2辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2.P.2.2 制剂研究3.2.P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2.P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。

农药剂型及生产工艺
一、农药剂型
1、可湿性粉剂:由浮选粉剂、悬浮剂、水膜剂、泡沫剂、水凝胶性
粉剂等组成,可以溶解在水中并形成稳定的粉末状分散体,又称悬浮剂、
分散剂、悬液剂。
2、可挥发性液体剂:农药悬浮液或有机液体和溶剂混合形成的液体剂,具有较强的挥发性,具有持久力和活性。
3、水性乳剂:以水为溶剂,将农药、稀释剂、乳化剂等混合制成的
乳状液体剂,具有良好的黏稠性和乳化性,能够持久分散在水中,又简称
水乳剂。
4、悬浮乳剂:将农药、乳化剂、增湿剂等混合制成的乳剂,能够随
水流动悬浮在水面上,就能较好地分散在水中,又被称为悬浮乳剂。
5、水胶性粉剂:以水为溶剂,将农药、抗剥落剂和粘胶性剂等混合后,制成粘性粉剂,又被称为憎水剂。
二、农药生产工艺
1、农药原料预处理:原料收集、质量检验及分类,再进行净化、烘干,把原料加工成最终形状,并进行室内测试。
2、药物制备:根据批次大小和质量要求,分别给定不同的制备工艺、原料搭配比例,再按照药典规定的步骤,经过研磨、分散、混合、搅拌、
烘干、筛分及包装等过程。

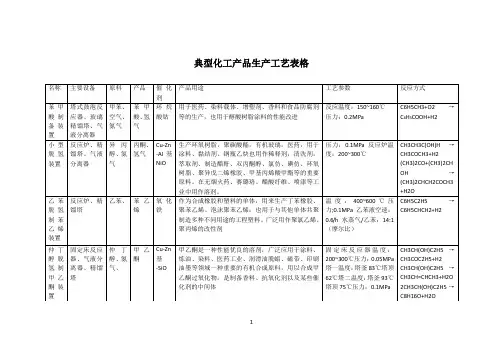
典型化工产品生产工艺表格名称主要设备原料产品催化剂产品用途工艺参数反应方式苯甲酸制备装置塔式鼓泡反应器、玻璃精馏塔、气液分离器甲苯、空气、氮气苯甲酸、氢气环烷酸钴用于医药、染料载体、增塑剂、香料和食品防腐剂等的生产,也用于醇酸树脂涂料的性能改进反应温度:150~160℃压力:0.2MPaC6H5CH3+O2→C6H5COOH+H2小型脱氢装置反应炉、精馏塔、气液分离器异丙醇、氮气丙酮、氢气Cu-Zn-Al基NiO生产环氧树脂,聚碳酸酯,有机玻璃,医药,用于涂料、黏结剂、钢瓶乙炔也用作稀释剂,清洗剂,萃取剂、制造醋酐、双丙酮醇、氯仿、碘仿、环氧树脂、聚异戊二烯橡胶、甲基丙烯酸甲酯等的重要原料。
在无烟火药、赛璐珞、醋酸纤维、喷漆等工业中用作溶剂。
压力:0.1MPa反应炉温度:200~300℃CH3CH3C(OH)H→CH3COCH3+H2(CH3)2CO+(CH3)2CHOH→(CH3)2CHCH2COCH3+H2O乙苯脱氢制苯乙烯装置反应炉、精馏塔乙苯、苯乙烯氧化铁作为合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯、泡沫聚苯乙烯;也用于与其他单体共聚制造多种不同用途的工程塑料。
广泛用作聚氯乙烯、聚丙烯的改性剂温度:400~600℃压力;0.1MPa乙苯液空速:0.6/h水蒸气/乙苯:14:1(摩尔比)C6H5C2H5→C6H5CHCH2+H2仲丁醇脱氢制甲乙酮装置固定床反应器、气液分离器、精馏塔仲丁醇、氮气、甲乙酮Cu-Zn基-SiO甲乙酮是一种性能优良的溶剂,广泛应用于涂料、炼油、染料、医药工业、润滑油脱蜡、磁带、印刷油墨等领域一种重要的有机合成原料,用以合成甲乙酮过氧化物,是制备香料、抗氧化剂以及某些催化剂的中间体固定床反应器温度:200~300℃压力:0.05MPa塔一温度:塔釜83℃塔顶62℃塔二温度:塔釜93℃塔顶75℃压力:0.1MPaCH3CH(OH)C2H5→CH3COC2H5+H2CH3CH(OH)C2H5→CH3CH=CHCH3+H2O2CH3CH(OH)C2H5→C8H16O+H2O1。

CDE公布化药新药生产工艺信息表相关事宜的通知关于公布化药新药生产工艺信息表相关事宜的通知发布日期:20150803根据总局“关于印发药品注册现场核查管理规定的通知”(国食药监注【2008】255号)精神,对于新药申请生产的注册申请,经审评符合规定的,需通知申请人申请生产现场检查,同时告知总局核查中心。
为顺利开展药品注册生产现场检查工作,我中心需将申请人最终确定的拟用于上市生产的生产工艺信息,以“《药品生产工艺信息表》”形式随上述告知函,一并告知总局核查中心,总局核查中心将依据《药品生产工艺信息表》内容进行生产现场检查。
自该项工作开展以来,我中心网站“电子提交/模板下载区”已公布了“工艺模版-大容量注射剂生产工艺信息表”、“工艺模版-非大容量注射剂生产工艺信息表”和“生产工艺确认书”三个文件的提交模版。
因为上述模版要求提供的生产工艺信息相关参数要求等不够详细或规范,致使我中心在具体技术审评过程中,需要花费大量的精力和时间反复与申请人进行沟通交流。
另外,还存在申请人在新药申报生产品种审评过程中不能及时提交《药品生产工艺信息表》的情况,也存在审评结束后(包括药品生产现场检查过程中)变更《药品生产工艺信息表》相关工艺内容等情况。
为提高技术审评质量和效率,我中心结合目前技术审评和生产现场检查要求,与核查中心就审评和生产现场检查中涉及的相关事宜进行了沟通交流,重新撰写了《化药原料药生产工艺信息表》、《化药制剂生产工艺信息表》及《生产工艺信息表确认书》三个文件的提交模版(详见附件1-3)。
经请示国家食品药品监督管理总局同意将上述模版在我中心网站予以公布。
我中心网站原公布的“工艺模版-大容量注射剂生产工艺信息表”、“工艺模版-非大容量注射剂生产工艺信息表”和“生产工艺确认书”同时予以废止。
新公布生产工艺信息表模版与原公布模版比较增加了以下内容:1、工艺信息表记载的生产地址应具体到厂房/车间、生产线。
2、工艺信息表中工艺描述应与工艺规程内容一致,关键工艺需予以标注。

附件3化学仿制制剂CTD格式申报主要研究信息汇总表2.3.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成份在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
2.3.P.2 产品开发2.3..P.2.1 产品开发目标结合原研药或者被仿制药的概况,简要说明产品开发目标,包括剂型、规格的选择依据。
2.3.P.2.2处方组成2.3.P.2.2.1 原料药简要分析与制剂生产及制剂性能相关的原料药的关键理化特性(如晶型、溶解性、粒度分布等等)及其控制。
说明是否进行了原料药和辅料的相容性试验及依据。
如进行了原料药和辅料的相容性试验,简述试验情况,包括试验设计、考察指标、试验结果等2.3.P.2.2.2 辅料简述辅料是否适合所用的给药途径,结合辅料在处方中的作用简述辅料的与制剂性能相关的关键特性。
2.3.P.2.3 处方开发过程简述处方研究的主要内容。
包括处方开发的基本思路,试验设计,考察指标和方法,试验结果,与原研药的比较研究情况,处方的放大和调整等。
示例如下:某普通片剂的处方研究小结:参考原研药说明书、原辅料相容性试验情况、相关生产经验等,确定了辅料的基本种类;参考原研药的重量和大小、以及各辅料常规用量,确定了辅料的用量范围,以××××为指标,采用××××方法,对××××的种类和用量进行了比较筛选,对××××处方进行了研究,以原研药为对照药,结果显示××××,根据以上研究确定了初步的处方;在以上研究基础上,进行了影响因素稳定性考察,与原研药进行了××××的质量对比;在批量放大过程中,对××××进行了调整,确定了最终处方。

总局关于发布化学药品新注册分类申报资料要求(试⾏)的通告(2016年第80号)附件化学药品新注册分类申报资料要求(试⾏)第⼀部分注册分类1、2、3、5.1类申报资料要求(试⾏)⼀、申报资料项⽬(⼀)概要1.药品名称。
2.证明性⽂件。
2.1注册分类1、2、3类证明性⽂件2.2注册分类5.1类证明性⽂件3.⽴题⽬的与依据。
4.⾃评估报告。
5.上市许可⼈信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考⽂献。
8. 包装、标签设计样稿。
(⼆)主要研究信息汇总表9. 药学研究信息汇总表。
10. ⾮临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )⽣产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)⽣产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)⾮临床研究资料14.⾮临床研究资料综述。
15.主要药效学试验资料及⽂献资料。
16.安全药理学的试验资料及⽂献资料。
17.单次给药毒性试验资料及⽂献资料。
18.重复给药毒性试验资料及⽂献资料。
19.遗传毒性试验资料及⽂献资料。
20.⽣殖毒性试验资料及⽂献资料。
21.致癌试验资料及⽂献资料。
22.依赖性试验资料及⽂献资料。
23.过敏性(局部、全⾝和光敏毒性)、溶⾎性和局部(⾎管、⽪肤、粘膜、肌⾁等)刺激性等特殊安全性试验资料及⽂献资料。
24.其他安全性试验资料及⽂献资料。

化药新药开发项目计划表(原料药和制剂开发)项目开题准备工作计划开题准备工作计划项目背景:*1类别合成研究情况报告合成研究相关准备工作制剂合成路线选择报告小试工艺摸索试验方案及关键步骤、关键工艺参数确认报告(见附件s02)原料小试研究信息表(见附件s03)确定的合成工艺报告制剂处方及工艺文献综述及处方及工艺摸索方案原研制剂基本性能参数研究及报告原料药及制剂质量标准的文献查询*7*6120*4*11*3*2工作内容现状及计划内容责任人预计完成时间完成情况统计质量原料药含量测定检验方法预实验研究原料药其他主要检测检验方法预实验制剂有关物质检验方法预实验*原料药有关物质检验方法预实验制剂含量测量检验方法进度表实验制剂其他主要检测(溶出度等)检验方法进度表实验原料药初始关键原料及关键中间体的质量研究(见到附件s-04)原料药初始关键原料及关键中间体质量标准杂质研究情况分析表中原料药质量标准初稿制剂质量标准初稿滴定法制剂的检验物料及设备准备工作原料药样品(须要排序原料下架、制剂处方探索及下架样品的用量)提供更多计划原料药对照Fanjeaux提供更多计划杂质对照Fanjeaux提供更多计划原研制剂提供更多计划特定试药试剂、设备(包含色谱柱)等的订货目录登记注册报生产的项目须要更改“生产许可证”准备工作课题负责人确认总负责人制备课题负责人原料药质量研究负责人制剂课题负责人*10*10*9*8*7附注表明:*1:项目背景主要包含以下内容:产品名称、中文化学名、英文化学名、结构式、分子式、分子量;产品的原研厂家、产品的剂型、规格;国内外采用情况;登记注册分类;国内登记注册申报情况;适应症等信息。
*2:现阶段制备技术属小试或生产;与否展开过规模化的样品研制,如果存有,多大规模;若想提供更多合乎国外药典的样品;若想提供更多制备路线中的中间体及数量;若想提供更多国外药典建议的杂质对照Fanjeaux,如果无法提供更多,建议如何化解。
制剂CTD 格式申报资料4、5.2类3.2.P 制剂3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1 (注:表格依次编号,下同):处方2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
3)说明产品所使用的包装材料及容器。
3.2.P.2 产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2. P.2.1处方组成3.2. P.2.1.1原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2. P.2.1.2辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2. P.2.2 制剂研究3.2. P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2. P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
附件3化学药品生产工艺及质量标准通用格式和撰写指南(征求意见稿)一、化学药品生产工艺通用格式和撰写指南化药原料药生产工艺信息表受理号/登记号:药品名称:生产企业:生产地址(具体到厂房/车间、生产线):(如产品的生产涉及到多个生产企业,请列表分别说明每个生产企业的名称、地址以及职责)1)列表明确关键工艺步骤及工艺参数的信息,作为生产工艺信息表附件。
2)关键起始物料的来源、制备工艺、质量标准和分析方法作为生产工艺信息表附件。
请按中国药典格式规范整理关键起始物料的质量标准。
涉及有关物质检查项的,应附杂质信息,包括结构式、分子式、分子量、化学名称。
3)关键中间体的质量标准和分析方法作为生产工艺信息表附件。
4)原料药的放行标准作为生产工艺信息表附件。
请列表对比放行标准与注册标准的异同,对比内容应包括项目、方法(编号)及限度,突出显示不一致之处。
对于不同于注册标准的项目(包括分析方法及增订项目),请按中国药典格式提供规范的文字描述;无需赘述与注册标准一致的项目,简单说明即可。
5)如包材执行的内控标准与国家标准不同,请列表对比内控标准与国家标准的异同,不一致的项目,请按国家标准格式提供规范的文字描述。
6)变更记录:(如适用)请列表汇总首次获批(自本文件发布实施之日)后与工艺相关的各种变更,明确变更日期、受理号(登记号)/备案号、变更内容等信息。
7)请注意字体、格式与模板保持一致。
化药制剂生产工艺信息表受理号:药品名称:药品上市许可持有人:生产企业:生产地址(具体到厂房/车间、生产线):(如产品的生产涉及到多个生产企业,请列表分别说明每个生产企业的名称、地址以及职责)1)列表明确关键工艺步骤及工艺参数的信息,作为生产工艺信息表附件。
2)原辅料的内控标准和分析方法作为生产工艺信息表附件。
对于原料药的内控标准,请按中国药典格式规范整理。
如原料药关联申报或已有文号,请明确本文件中的内控标准与原料药注册标准的异同,如有差异,请明确说明。
中药注射剂类药品生产工艺和处方核查工作汇总表
1. “中药注射剂”是指批准文号为“国药准字Z”格式的所有注射剂。
2.表内各项仅针对中药注射剂,包括静脉给药者。
每个药品批准文号作为一个品种计数。
3.“未曾生产品种数”是指获得国家药品注册或地标升国标后未曾批量生产的品种数。
4.“停止生产品种数”是指获得国家药品注册或地标升国标后曾经批量生产、现因停止生产未予核查的品种数。
5.“存在来源或评估问题的品种”是指专题列明有关遗留问题、需审核确认的品种。
6. 本表由省(区、市)局汇总填写并加盖公章后报送,原已报送总结的亦须填报。
可将本表传真至:************,并发电子邮件至:************.cn。
附件2 :药品生产工艺变更情况表一、不影响安全性、有效性和质■可控性的工艺变更(一)中药I类和H类变更1.I类变更:此类变更不会引起药用物质基础的改变,对药物的吸收、利用不会产生明显影响,不会引起安全性、有效性的明显改变。
如变更不含挥发性成分、热敏性成分药物的粉碎工艺(其粉碎粒度基本相同)、浓缩干燥工艺或制粒工艺(缩短受热时间或降低受热温度)等,但变更为特殊的浓缩干燥方法,如微波干燥等方法,不属于此类变更。
2.II类变更:此类变更对其药用物质基础或对药物的吸收、利用有影响,但变化不大,包括工艺过程中一些工艺参数及工艺方法的改变,如变更含挥发性成分、热敏性成分药物的涉及受热温度、受热时间的工艺操作,应进行对比研究,如药用物质变化不大,属于H类变更。
(二)化学药品I类和H类变更1.变更原料药的生产工艺I类变更:(1 )变更试剂、起始原料的来源;(2)提高试剂、起始原料、中间体的质量标准;II类变更:(3)变更起始原料、溶剂、试剂、中间体的质量标准;2.变更制剂的生产工艺I类变更:(1)增加生产过程质量控制方法或严格控制限度;(2 )片剂、胶囊、栓剂或阴道栓印记变更; (3)普通或肠溶片剂、胶囊、栓剂或阴道栓的形状、尺寸变更;II类变更:(4)变更生产设备;包括无菌制剂生产中采用相同设计及操作原理的设备替代另一种设备;非无菌制剂生产中采用设计及操作原理不同的设备替代另一种设备;改变半固体制剂生产中混合设备类型,由高速剪切机变更为低速剪切机,或相反变更。
如涉及无菌产品时,变更生产设备不应降低产品的无菌保证水平。
(5)变更制剂生产过程,包括口服固体制剂物料混合过程的混合时间及混合速度等变更,包括半固体制剂混合过程中的混合速度、混合时间、冷却速度等生产过程的变更,还包括半固体制剂水相与油相混合过程的变更。
对于无菌制剂,这种变更包括:①对采用终端灭菌工艺生产的无菌制剂,取消中间过程的滤过环节;②变更除菌过滤过程的滤过参数(包括流速、压力、时间、或体积,但滤过材料和孔径不变)等。