菌落总数检验原始记录
- 格式:docx
- 大小:19.79 KB
- 文档页数:3
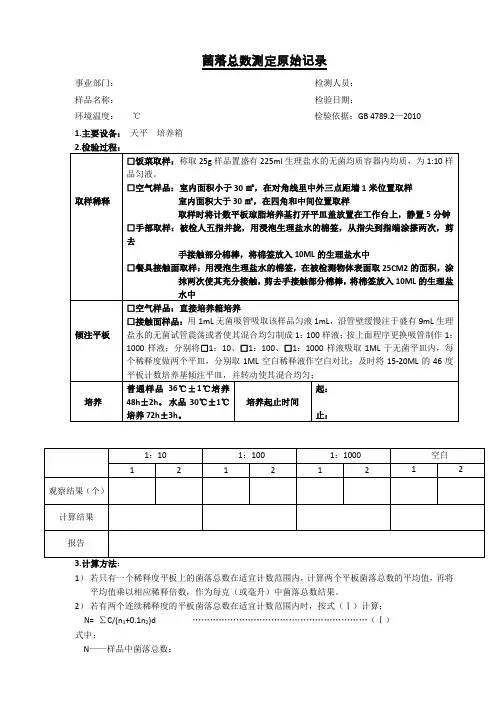
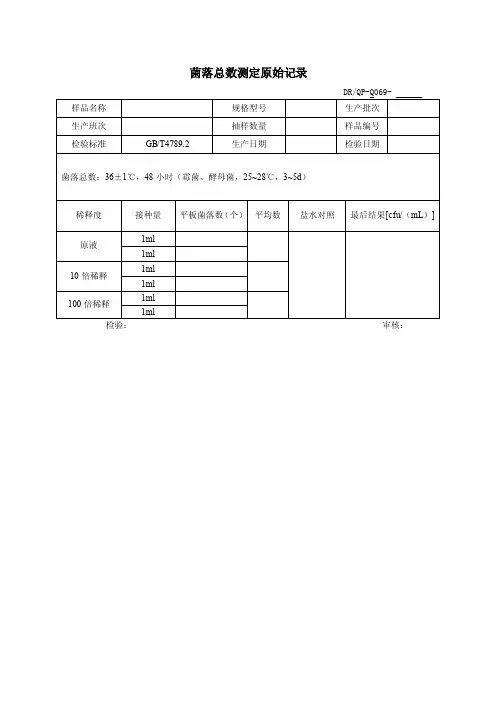
菌落总数测定原始记录
事业部门:检测人员:
样品名称:检验日期:
环境温度:℃检验依据:GB 4789.2—2010
1.主要设备:天平培养箱
3.计算方法:
1)若只有一个稀释度平板上的菌落总数在适宜计数范围内,计算两个平板菌落总数的平均值,再将平均值乘以相应稀释倍数,作为每克(或毫升)中菌落总数结果。
2)若有两个连续稀释度的平板菌落总数在适宜计数范围内时,按式(Ⅰ)计算:
N= ∑C/(n1+0.1n2)d (Ⅰ)
式中:
N——样品中菌落总数;
∑C——平板(含适宜范围菌落总数的平板)菌落数之和;n1——第一个适宜稀释度平板数;
n2——第二个适宜稀释度平板数;
d——稀释因子(第一稀释度)。
审核:。
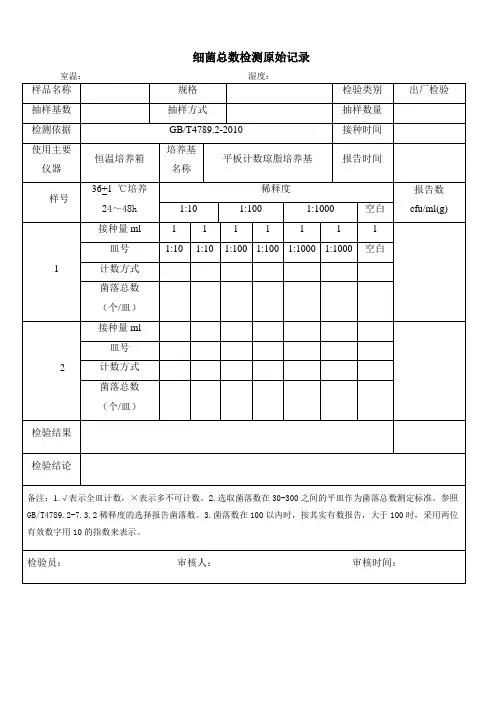

菌落总数检验原始记录(平板计数法)计算方法1 .若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(m1.)样品中菌落总数结果。
2 .若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式⑴计算。
ZZCN- -----------------(n1+0.1M2)J式中:N——样品中菌落数;∑C一一平板(含适宜范围菌落数的平板)菌落数之和;nι——第一稀释度(低稀释倍数)平板个数;n2一一第二稀释度(高稀释倍数)平板个数;d一一稀释因子(第一稀释度)。
3 .若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
4 .若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5 .若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6 .若所有稀释度的平板菌落数均不在30CFU-300CF∪之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
计算过程:方法报告1∙菌落总数小于IoOCFU时,按“四舍五入”原则修约,以整数报告。
2 .菌落总数大于或等于IOOCFU时,第三位数字采用“四舍五入”原则修约后,采用两位有效数字,后面用0代替位数;也可用10的指数形式来表示,按“四舍五人”原则修约后,采用两位有效数字。
3 .若空白对照上有菌落生长,则此次检验结果无效。
4 .称重取样以CF∪∕g为单位报告,体积取样以CF∪∕m1.为单位报告。
报告人报告日期复核人复核日期。
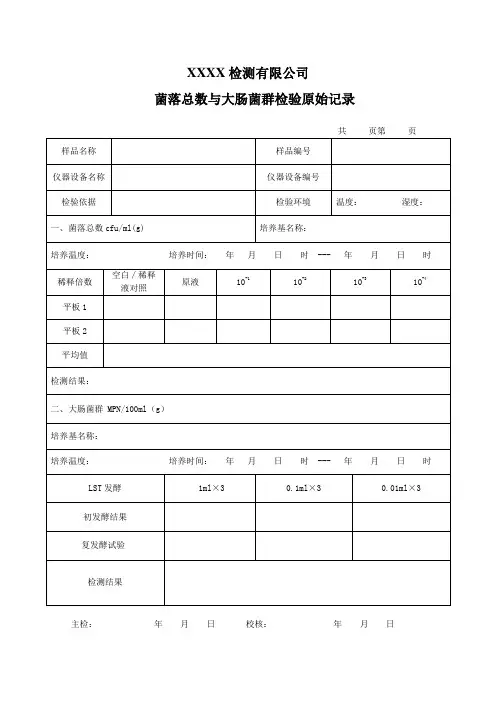
菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
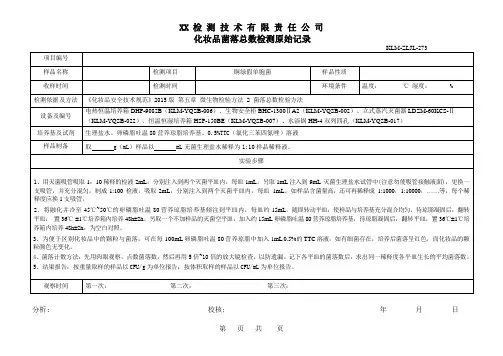
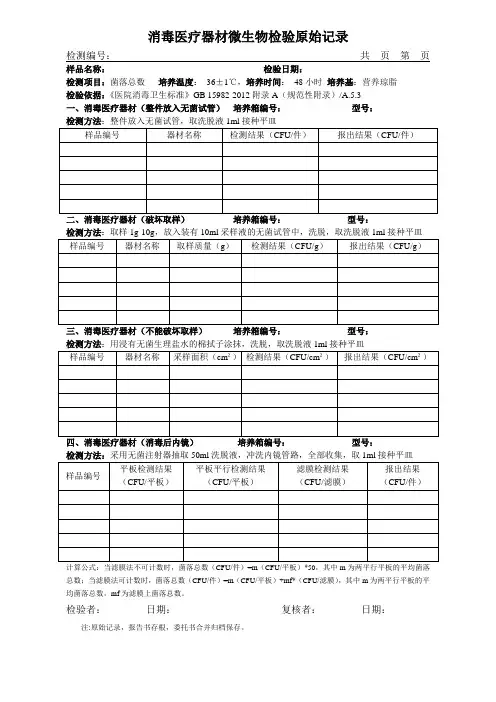
消毒医疗器材微生物检验原始记录
检测编号:共页第页样品名称:检验日期:
检测项目:菌落总数培养温度:36±1℃,培养时间:48小时培养基:营养琼脂
检验依据:《医院消毒卫生标准》GB 15982-2012附录A(规范性附录)/A.5.3
一、消毒医疗器材(整件放入无菌试管)培养箱编号:型号:
二、消毒医疗器材(破坏取样)培养箱编号:型号:
三、消毒医疗器材(不能破坏取样)培养箱编号:型号:
检测方法:采用无菌注射器抽取50ml洗脱液,冲洗内镜管路,全部收集,取1ml接种平皿
计算公式:当滤膜法不可计数时,菌落总数(CFU/件)=m(CFU/平板)*50,其中m为两平行平板的平均菌落总数;当滤膜法可计数时,菌落总数(CFU/件)=m(CFU/平板)+mf*(CFU/滤膜),其中m为两平行平板的平均菌落总数,mf为滤膜上菌落总数。
检验者:日期:复核者:日期:注:原始记录,报告书存根,委托书合并归档保存。

菌落总数与大肠菌群检验原始记录样品名称仪器设备名称检验依据一、菌落总数cfu/ml(g)培养温度:培养时间:空白∕稀释稀释倍数原液液对照平板 1平板 2平均值检测结果:二、大肠菌群MPN/100ml ( g)培养基名称:培养温度:培养时间:共页第页样品编号仪器设备编号检验环境温度:湿度:培养基名称:年月日时 ---年月日时10-110-210-310-4年月日时---年月日时LST 发酵1ml × 30.1ml × 30.0 1ml × 3初发酵结果复发酵试验检测结果主检:年月日校核:年月日菌落总数和大肠菌群检测原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:检验依据GB4789.2-2010 GB4789.3-2010一、菌落总数 cfu/ml(g)培养基名称:培养温度: 36±1℃培养时间:年月日时---年月日时样品数样 1样 2样 3样 4样 5稀释倍数平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2原液10-110-210-310-4空白对照检验结果二、大肠菌群 cfu/ml(g)培养基名称:培养温度: 36±1℃培养时间:年月日时---年月日时样品数样 1样 2样 3样 4样 5稀释倍数平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2原液10-110-210-310-4空白对照验证试验检验结果主检:年月日校核:年月日XXXX检测有限公司水质微生物检验原始记录共页第页样品名称样品编号设备名称检验环境温度:湿度:检验依据一、菌落总数 cfu/ml(g)培养温度: 36± 1℃稀释倍数原液10-110-210-310-410-5平板 1平板 2平均值检测结果:二、总大肠菌群MPN/100ml (g)培养温度: 36± 1℃培养时间:LST 培养基10ml ×1ml ×0.1ml ×0.01ml ×发酵结果验伊红美蓝琼脂平板证革兰氏染色试验乳糖复发酵检测结果三、大肠埃希氏菌MPN/100ml ( g)验自总大肠菌群乳糖发酵试样中的阳性管中取一滴转接伊红美蓝琼脂平板证种与 EC 培养基中置44.5℃培养 24 小时观察试验四、耐热大肠菌群MPN/100ml ( g)验将总大肠菌群多管发酵法初发酵或产气的管中培养后的 EC-MUG 管在暗处用EC-MUG 管中波长 366nm 功率为 6W 的紫外光证用无菌金属接种环将试液接种到试置 44.5℃培养 24 小时观察灯照射验主检:年月日校核:年月日XXXX检测有限公司乳酸菌与大肠菌群检测记录共页第页样品名称样品编号仪器设备名称检验环境温度:湿度:检验依据一、乳酸菌 cfu/ml(g)培养温度: 36± 1℃培养时间:稀释倍数原液10-310-410-510-610-7平板 1平板 2平均值检测结果:二、大肠菌群MPN/100ml ( g)培养温度:培养时间:年月日时 ---年月日时LST 发酵1ml × 30.1ml × 30.0 1ml × 3发酵结果伊红美蓝琼脂平板验证试验革兰氏染色乳糖复发酵检测结果主检:年月日校核:年月日XXXX检测有限公司致病菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:致病菌培养温度:培养时间:年月日时 ---年月日时金黄色葡萄球菌25g 样品 +225ml7.5%(定性检验)氯化钠肉汤,均质检验依据:将上述培养物,分别观察溶血血浆凝固酶试验划线接种到涂片染色Baird-Parker 和血平板实验现象检测结果前增菌增菌分离沙门氏菌将上述培养物,25g样再次将上述培养生化试验品检验依据:+225mlBPW ,分别取 1ml 转接种于 10mlTTB 物,分别划线接种均质与于 BS 琼脂平板10mlSC 内,进行XLD 琼脂平板前增菌实验现象检测结果志贺氏菌25g 样品 +225ml检验依据:GN 增菌液实验现象检测结果25g 样品 +225ml 生理溶血性链球菌盐水,吸取5ml 接种于 50ml 葡萄糖肉汤曾检验依据:菌,划线接种于血平板实验现象检测结果主检:年月将上述培养物分别划线接种于划线接种 TSI,生化试验HE 平板和 EMB 平板葡萄糖半固体涂片染色观察溶血血浆凝固酶试验日校核:年月日霉菌和酵母菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:培养基名称培养温度: 28±1℃培养时间:年月日时---年月日时:观察培养培养温度观察时间观察结果第 1 天第 2 天第 3 天第 4 天第 5 天观察结论:菌落计数:培养温度: 28±1℃培养时间:年月日时---年月日时稀释倍数空白∕稀释液对照原液10-110-2-3-41010平板 1平板 2平均值检测结果主检:年月日校核:年月日商业无菌检验原始记录共页第页样品名称样品编号仪器名称检验环境温度:湿度:仪器编号检验依据1、保温试验:将完整试样一份置于36± 1℃培养箱保温十天,每天观察胖听、泄漏现象。

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
培养温度:28±1℃培养时间:年月日时--- 年月日时:
菌落计数:
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
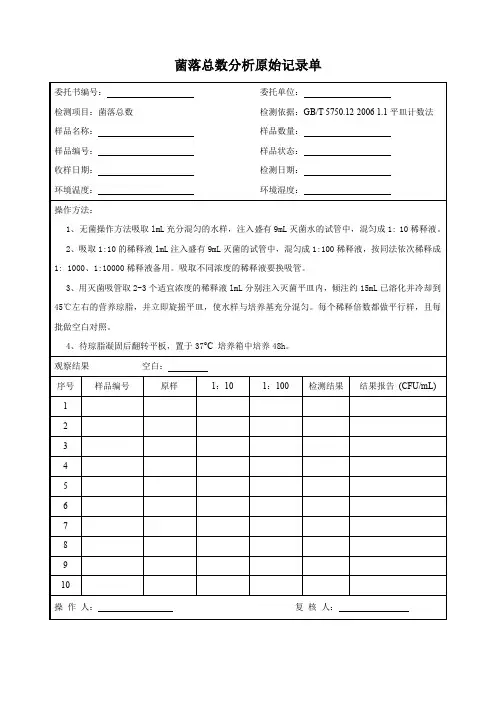

菌落总数测定原始记录事业部门:检测人员:样品名称:检验日期:环境温度:℃检验依据:GB 4789.2—20101.主要设备:天平培养箱2.检验过程:取样稀释□饭菜取样:称取25g样品置盛有225ml生理盐水的无菌均质容器内均质,为1:10样品匀液。
□空气样品:室内面积小于30㎡,在对角线里中外三点距墙1米位置取样室内面积大于30㎡,在四角和中间位置取样取样时将计数平板琼脂培养基打开平皿盖放置在工作台上,静置5分钟□手部取样:被检人五指并拢,用浸泡生理盐水的棉签,从指尖到指端涂搽两次,剪去手接触部分棉棒,将棉签放入10ML的生理盐水中□餐具接触面取样:用浸泡生理盐水的棉签,在被检测物体表面取25CM2的面积,涂抹两次使其充分接触,剪去手接触部分棉棒,将棉签放入10ML的生理盐水中倾注平板□空气样品:直接培养箱培养□接触面样品:用1mL无菌吸管吸取该样品匀液1mL,沿管壁缓慢注于盛有9mL生理盐水的无菌试管震荡或者使其混合均匀制成1:100样液;按上面程序更换吸管制作1:1000样液;分别将□1:10、□1:100、□1:1000样液吸取1ML于无菌平皿内,每个稀释度做两个平皿,分别取1ML空白稀释液作空白对比;及时将15-20ML 的46度平板计数培养基倾注平皿,并转动使其混合均匀;培养普通样品36℃±1℃培养48h±2h。
水品30℃±1℃培养72h±3h。
培养起止时间起:止:1:101:1001:1000空白12121212观察结果(个)计算结果报告3.计算方法:1)若只有一个稀释度平板上的菌落总数在适宜计数范围内,计算两个平板菌落总数的平均值,再将平均值乘以相应稀释倍数,作为每克(或毫升)中菌落总数结果。
2)若有两个连续稀释度的平板菌落总数在适宜计数范围内时,按式(Ⅰ)计算:N= ∑C/(n1+0.1n2)d (Ⅰ)式中:N——样品中菌落总数;∑C——平板(含适宜范围菌落总数的平板)菌落数之和;n1——第一个适宜稀释度平板数;n2——第二个适宜稀释度平板数;d——稀释因子(第一稀释度)。
菌落总数酶底物法原始记录一、引言菌落总数酶底物法是一种常用的微生物计数方法,通过将菌落作为菌落酶底物来测定菌落总数。
本文旨在介绍菌落总数酶底物法的原始记录方法。
二、实验材料与方法1. 实验材料- 菌落总数酶底物试剂盒- 菌落计数平板- 培养基- 无菌培养皿- 秤量纸- 管口塞瓶2. 实验步骤1) 将菌落计数平板标记编号,并在每个平板上绘制三个待测试样品的三倍稀释液。
2) 使用无菌技术将待测试样品依次转移到各个平板上。
3) 使用菌落计数器对每个平板上的菌落进行计数,并将结果记录下来。
4) 使用菌落总数酶底物试剂盒来测定菌落总数,并将结果记录下来。
5) 将实验过程中的所有废液和废物进行处理,确保不对环境造成污染。
三、实验结果记录样品编号平板编号菌落计数菌落总数-------------------------------------1 A1 30 5.36×10^3 CFU/ml1 A2 26 4.64×10^3 CFU/ml1 A3 33 5.86×10^3 CFU/ml2 B1 62 1.10×10^4 CFU/ml2 B2 57 1.02×10^4 CFU/ml2 B3 60 1.07×10^4 CFU/ml3 C1 18 3.20×10^3 CFU/ml3 C2 22 3.92×10^3 CFU/ml3 C3 20 3.56×10^3 CFU/ml四、数据分析与讨论根据实验结果,我们可以得出以下结论:1. 样品1的菌落总数分别为5.36×10^3 CFU/ml、4.64×10^3 CFU/ml和5.86×10^3 CFU/ml。
2. 样品2的菌落总数分别为1.10×10^4 CFU/ml、1.02×10^4 CFU/ml和1.07×10^4 CFU/ml。
菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。
菌落总数测定原始记录事部:品名称:境温度:℃人:日期:依据:GB 4789.2 — 20101.主要:天平培养箱2.程:□ 菜取:称取 25g 品置盛有225ml 生理水的无菌均容器内均,1:10品匀液。
□空气品:室内面小于 30 ㎡,在角里中外三点距 1 米位置取取稀注平板室内面大于30 ㎡,在四角和中位置取取将数平板脂培养基打开平皿盖放置在工作台上,静置 5 分□手部取:被人五指并,用浸泡生理水的棉,从指尖到指端涂搽两次,剪去手接触部分棉棒,将棉放入10ML 的生理水中□餐具接触面取:用浸泡生理水的棉,在被物体表面取25CM2 的面,涂抹两次使其充分接触,剪去手接触部分棉棒,将棉放入10ML 的生理水中□空气品:直接培养箱培养□接触面品:用 1mL 无菌吸管吸取品匀液1mL ,沿管壁慢注于盛有9mL 生理水的无菌管震或者使其混合均匀制成 1 :100 液;按上面程序更吸管制作1:1000 液;分将□1 :10、□1 :100 、□1: 1000 液吸取1ML 于无菌平皿内,每个稀度做两个平皿,分取1ML 空白稀液作空白比;及将15-20ML的46度平培养板数培养基注平皿,并使其混合均匀;普通品36 ℃±1 ℃培养48h ±2h 。
水品30℃±1℃培养起止培养 72h ±3h 。
起:止:1 : 10 1: 100 1:1000 空白1 2 1 2 1 2 1 2察果(个)算果告3.算方法:1 )若只有一个稀度平板上的菌落数在适宜数范内,算两个平板菌落数的平均,平均乘以相稀倍数,作每克(或毫升)中菌落数果。
2 )若有两个稀度的平板菌落数在适宜数范内,按式(Ⅰ)算:N= ∑C/(n 1+0.1n 2)d⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯(Ⅰ)再将式中:N——样品中菌落总数;∑C——平板(含适宜范围菌落总数的平板)菌落数之和;n 1——第一个适宜稀释度平板数;n 2——第二个适宜稀释度平板数;d ——稀释因子(第一稀释度)。