大肠菌群检验原始记录
- 格式:docx
- 大小:8.09 KB
- 文档页数:2
菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时--- 年月日时:
菌落计数:
主检:年月日校核:年月日
商业无菌检验原始记录
共页第页样品名称样品编号
仪器名称检验环境温度:湿度:
仪器编号检验依据
1、保温试验:将完整试样一份置于36±1℃培养箱保温十天,每天观察胖
听、泄漏现象。
2、将保温后的试样与同批正常样品作品作PH比较,明显差异。
3、将样品内容物全部倾出检查其感官,腐败变质现象。
检测结果
备注
主检:日期:校核:日期:。
菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
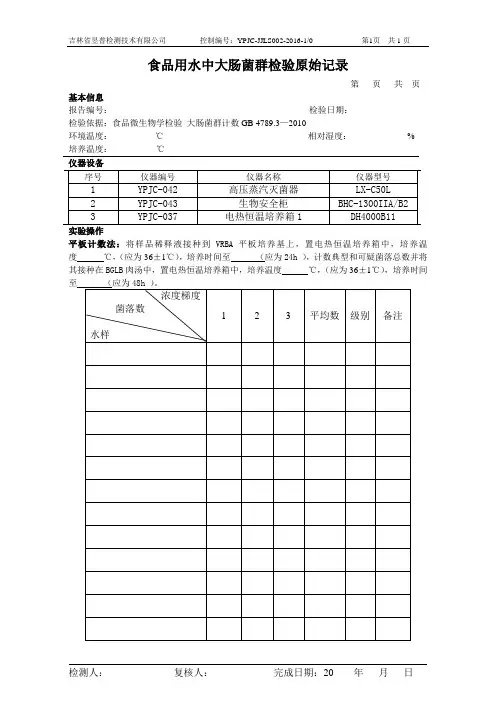
吉林省昱普检测技术有限公司控制编号:YPJC-JJLS002-2016-1/0 第1页共1页
食品用水中大肠菌群检验原始记录
第页共页基本信息
报告编号:__________ 检验日期:_____________
检验依据:食品微生物学检验大肠菌群计数GB 4789.3—2010
环境温度:__________℃相对湿度:_____________%
培养温度:__________℃
实验操作
平板计数法:将样品稀释液接种到VRBA平板培养基上,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间至(应为24h ),计数典型和可疑菌落总数并将其接种在BGLB肉汤中,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间
检测人:复核人:完成日期:20 年月日。
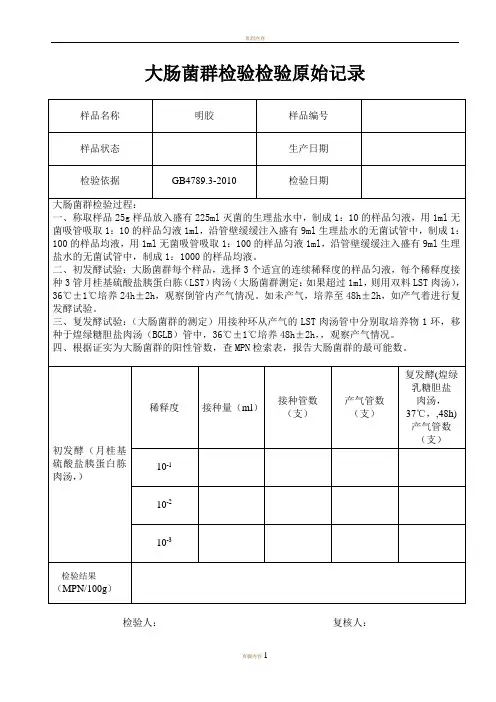

微生物检验原始记录(大肠菌群)检验原始记录编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点:样品名称:样品编号:样品状态:符合检验要求;其他境条件:实验依据及步骤GB4789.3-2016样品稀释固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。
依次进行10倍递增稀释。
液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。
样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。
取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。
按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
从样品匀液制备到样品接种完毕,全过程不得超过15min。
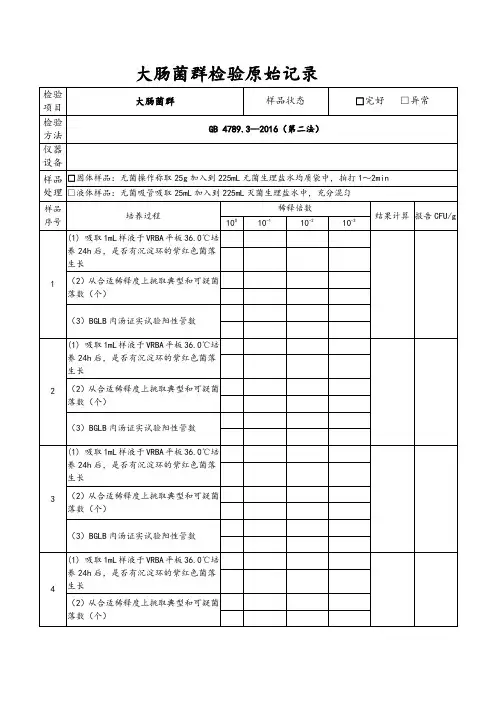
初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤)36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。
产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。
未产气者为大肠菌群阴性。
复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
数据分析与结果一、菌落计数根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
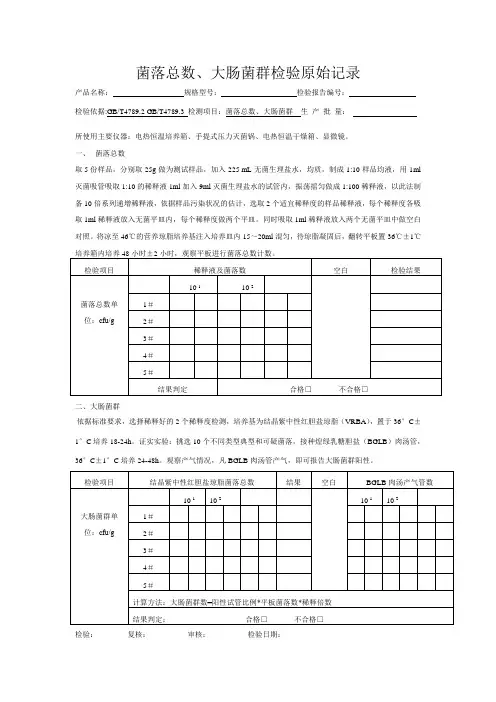
菌落总数、大肠菌群检验原始记录
产品名称:规格型号:检验报告编号:
检验依据:GB/T4789.2 GB/T4789.3 检测项目:菌落总数、大肠菌群生产批量:
所使用主要仪器:电热恒温培养箱、手提式压力灭菌锅、电热恒温干燥箱、显微镜。
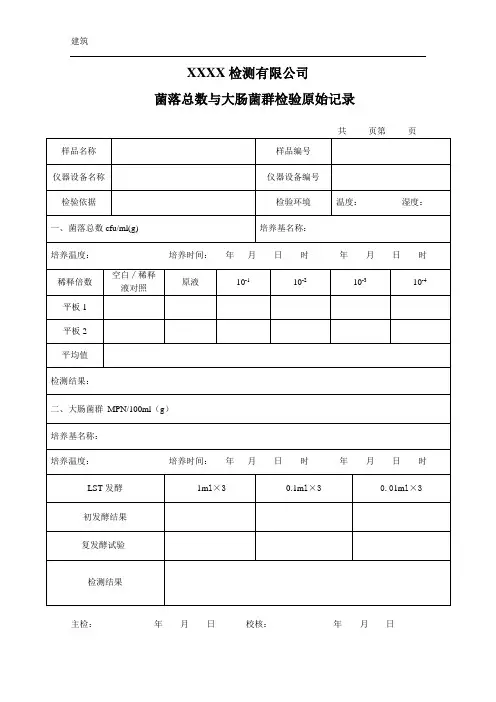
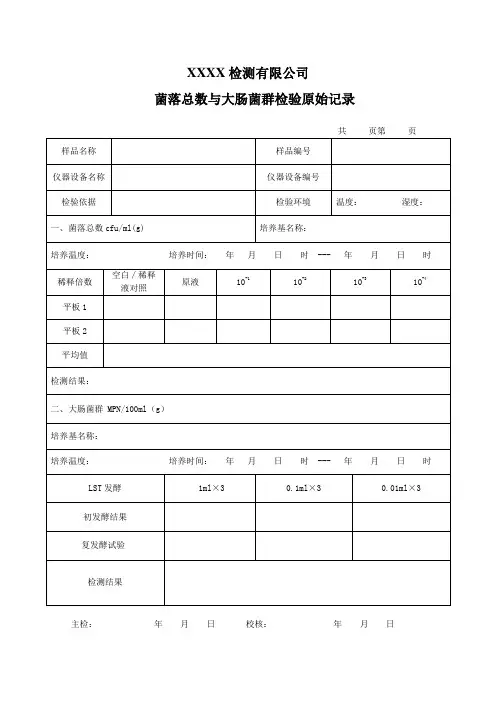
一、菌落总数
取 5 份样品,分别取25g做为测试样品,加入225 mL无菌生理盐水,均质,制成1:10样品均液,用1ml 灭菌吸管吸取1:10的稀释液1ml加入9ml灭菌生理盐水的试管内,振荡摇匀做成1:100稀释液,以此法制备10倍系列递增稀释液,依据样品污染状况的估计,选取2个适宜稀释度的样品稀释液,每个稀释度各吸取1ml稀释液放入无菌平皿内,每个稀释度做两个平皿。
同时吸取1ml稀释液放入两个无菌平皿中做空白对照。
将凉至46℃的营养琼脂培养基注入培养皿内15~20ml混匀,待琼脂凝固后,翻转平板置36℃±1℃
二、大肠菌群
依据标准要求,选择稀释好的2个稀释度检测,培养基为结晶紫中性红胆盐琼脂(VRBA),置于36°C±1°C培养18-24h。
证实实验:挑选10个不同类型典型和可疑菌落,接种煌绿乳糖胆盐(BGLB)肉汤管,36°C±1°C培养24-48h。
观察产气情况,凡BGLB肉汤管产气,即可报告大肠菌群阳性。
检验:复核:审核:检验日期:。

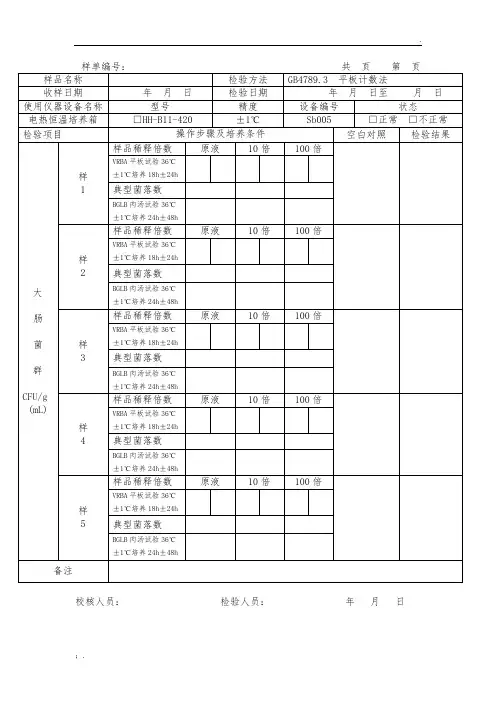
检验原始记录
共页第页
样品名称样品编号
检验环境温度℃相对湿度% 菌落总数的测定(依据GB4789.2-2010检验)
主用仪器:培养箱
检验项目检测结果
样品稀释度10 10 10
菌落数,个
两稀释液之比
空白对照
菌落总数cfu/g
培养温度36℃±1℃培养时间:48 h±2h
主检校核日期
大肠菌群的测定(依据GB4789.3-2010检验)
主用仪器:培养箱
接
种量0.1g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管0.01g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管
0.001g×3
初发酵试验LST肉汤管
复发酵试验BGLB肉汤管
查大肠菌群最可能数(MPN)检索表[MPN/ ]::
培养温度36℃±1℃培养时间:48 h±2h
备注:‘+’表示阳性;‘-’表示阴性。
主检校核日期。
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页
第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
致病菌检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 ---年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
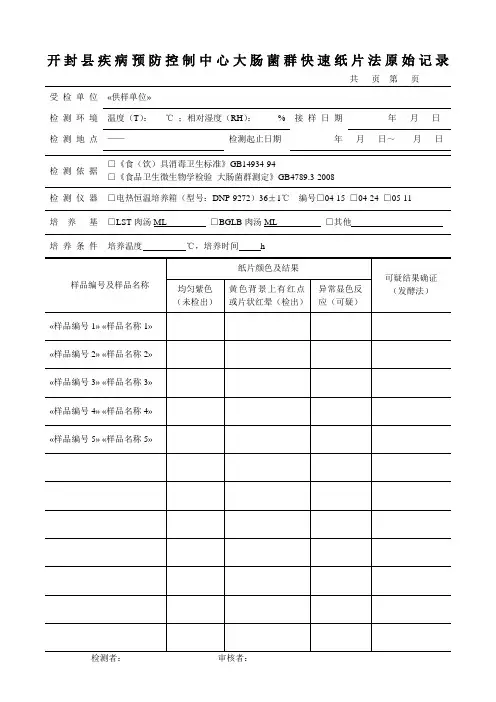
×××产品质量计量检测所
产品检验原始记录
No
产品名称样品编号技术标准
检测地点温度湿度
大肠菌群的测定
一、设备和材料
培养箱(36℃±1℃);恒温水浴锅(46℃±1℃)
二、操作步骤
1、称取(吸取)25g(ml),放于盛有225ml生理盐水的无菌锥形瓶中,充分混匀,制成1:10的样品匀液。
2、用1ml无菌吸管吸取1:10样品匀液1ml,沿管壁缓慢注于盛有9ml稀释液的无菌试管中,振摇试管使其混合均匀,制成1:10的样品匀液。
3、按上述操作程序,制备10倍系列稀释样品匀液,每递增稀释一次,换用一次1ml无菌吸管。
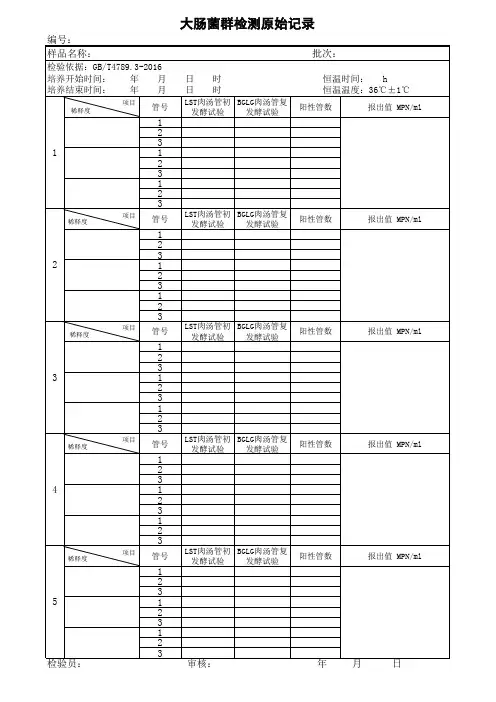
4、选择稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,分别接种ml;ml;ml,在36℃±1℃培养24±2h,未产气者为大肠菌群阴性。
对产气者按下述进行复发酵实验。
5、用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳糖胆盐肉汤(BGLB)管中,36℃±1℃培养48±2h,产气者,计为大肠菌群阳性管。
三、大肠菌群最可能数(MPN)的报告见下表
检验:审核:检验日期:。