第八章 配型配合物
- 格式:doc
- 大小:92.50 KB
- 文档页数:7


第八章配合物的制备配合物数目庞大,制备方法也种类繁多,千差万别。
在此仅就最通用的方法给以介绍。
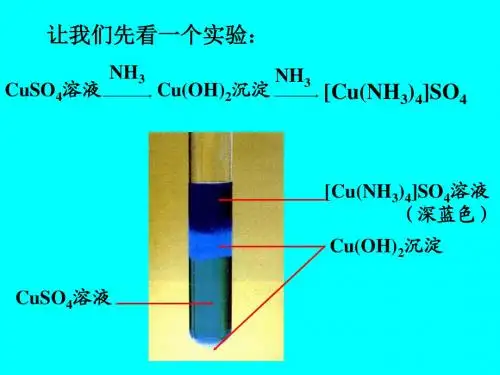
第一节利用配体取代反应合成配合物1、水溶液中的取代反应1)用金属盐水溶液直接与配体反应[Cu(H2O)4]SO4 + 4NH3[Cu(NH3)4]SO4 溶液颜色由浅蓝变为深蓝。
向反应混合物中加入乙醇,就可得到配合物的深蓝色的结晶。
也适合于Ni2+、Co2+及Zn2+, 但不适合与Fe3+、Al3+、Ti4+, 这是由于NH3·H2O = NH4+ + OH-因此形成氢氧化物沉淀。
2)对于惰性配合物,取代反应要求苛刻的条件。
如制备K3[Rh(C2O4)3],需将K3[RhCl6]与K2C2O4的浓溶液煮沸2小时,然后蒸发溶液,可得产物的结晶。
K3[RhCl6] +3K2C2O4K3[Rh(C2O4)3] + 6KCl3)有时被取代的配体不止一种,如:[Co(NH3)5Cl]Cl2+ 3en [Co(en)3]Cl3 +5NH3有时可得到部分取代的配合物:K2[PtCl4] + en [Pt(en)Cl2] + 2KCl2、非水溶剂中的取代反应使用非水溶剂的原因:A、防止水解(如Fe3+、Al3+、Ti4+);B、使不溶于水的配体可溶解;C、配体的配位能力不及水。
1)[Cr(en)3]Cl3的合成在水中反应时CrCl3.6H2O + en Cr(OH)3↓可在乙醚中,按如下方法合成:en KI AgCl无水Cr2(SO4)3溶液[Cr(en)3]I3 [Cr(en)3]Cl3溶液中的产物可通过蒸发结晶或加入乙醇制得。
2)[Ni(phen)3]Cl2(phen为邻菲咯啉)由于phen不溶于水,因而可将其溶于与水能混溶的溶剂中,然后再将其加到金属离子的浓溶液中进行反应。
NiCl2·6H2O(aq) + phen(乙醇) [Ni(phen)3]Cl23)[Ni(EtOH)6](ClO4)2的合成NaClO4无水NiCl2 + EtOH [Ni(EtOH)6]Cl2 [Ni(EtOH)6](ClO4)2在水溶液中:[Ni(EtOH)6]2++ H2O [Ni(H2O)6]2++ EtOH3、固体配合物热分解(固态取代反应)1)[Cu(H2O)4]SO4.H2O = [CuSO4]+5H2O (加热)2)2[Co(H2O)6]Cl2 = Co[CoCl4] +12H2O (加热)变色硅胶的原理(粉红、蓝色)3)[Rh(NH3)5H2O]I3 = [Rh(NH3)5I]I2+ H2O (100℃)4)[Pt(NH3)4]Cl2 = trans-[Pt(NH3)2Cl2] + 2NH3 (250℃)5)[Cr(en)3](NCS)3 = trans-[Cr(en)2(NCS)2]NCS + en (130℃)6)[Cr(en)3]Cl3 = cis-[Cr(en)2Cl2]Cl + en (210℃)第二节利用氧化还原反应合成配合物1、金属的氧化最好的氧化剂是O2或H2O2,不会引入杂质。




无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。


8.1 配合物的基本概念•配位化合物(Coordination Compounds ),简称配合物。
最初的这类化合物都是由稳定存在的简单化合物进一步结合而形成的。
如•等。
后来发现绝大多数的无机化合物,包括盐类的水合晶体,都是以配合物的形式存在的,它们广泛存在于动、植物的有机体中。
对配合物结构和性质的研究,加深和丰富了人们对化学元素性质的认识,推动了化学键和分子结构理论的发展,同时也促进了无机化学的发展。
特别是随着科学技术的进步,大量的新配合物的发现、合成及各个领域的广泛应用,又促过了配合物研究的迅速发展,配合物化学已从无机化学的分支发展成为独立的一门学科—配位化学。
本章将简要地介绍有关配合物的基础知识。
•8.1.1 配合物的定义•配合物一般是指由金属原子或金属离子与其他分子或离子以配合键结合而成的复杂离子或化合物。
例如•等都是配合物。
第8章配位化合物336CoCl NH ⋅232PtCl NH ⋅23()()KCN Fe CN Fe CN ⋅⋅[]234()Cu NH +[]32()Ag NH +[]46()Fe CN -[]4()Al OH -[]333()CoCl NH ⋅()4Ni CO ⎡⎤⎣⎦下一页8.1.1 配合物的定义•这些复杂离子所带电荷的不同,可分为•配阳离子如•配阴离子如。
•严格来说,只有配离子与相反电荷的离子组成的电中性化合物才能称为配合物,•如但有些配位个体本身不带电荷,是中性分子如。
这样的配位个体也是配合物。
所以,在配位化学中,配离子和配合物通常不作严格区分,有时也将配离子称为配合物。
[]32()Ag NH +[]46()Fe CN -[]4()Al OH -[]32()Ag NH Cl []46()K Fe CN []4()Na Al OH []333()CoCl NH ⋅()4Ni CO ⎡⎤⎣⎦[]234()Cu NH +[]344()Cu NH SO 上一页下一页8.1.2 配合物的组成•(1) 中心离了(或原子)•占据配离子中心位置的离子,通常把它叫做中心离子,例如•中的Cu 2+、中的Fe 2+。

第八章 混配型配合物当存在多种配体时,金属离子可以和多种配体形成混配型配合物定义:两种或两种以上的配体A .B .C 与同一种中心离子M 形成的配合物称为混配型配合物。
一种金属离子与一种配体形成的配合物常称为二元配合物,而一种金属离子同时与两种或两种以上的配体所形成的配合物(即混配型配合物)称为多元配合物 MAB ――三元配合物 MABC ―――四元配合物第一节 混配型配合物的形成条件 一. 配位饱和原理若金属离子能分别与两种配体单独发生配位反应,当单一型配合物中金属离子未达到最高配位数时,在有其它配体存在的情况政,很容易与之进一步配合形成更稳定的配位饱和的混配型配合物。
例:N (CH 2COOH )3 + Cd 2+ = Cd(nta)-因Cd 的配位数在此为4,但Cd 的最高配位数可为6,因此,可以进一步和其它的配位体形成混配型配合物。
Cd + nta + nL===CdntaL]][][[][L nta Cd CdntaL =β其中L 可为Cl, Br, I 等。
有关的β值见下表表1 Cd 与nta 和X 的混配型配合物的稳定常数由实验事实可以归纳:1 高价的金属离子易形成稳定的混配型配合物,这是因为高态的金属离子有较高的配位数。
2 周期数高的金属离子易形成混配型配合物,第三.四周期的元素配位数大多数为6,第五.六周期的元素的可达8甚至更多,例如铌钽的配位数可达7或8。
只有一种配体时,饱和金属离子的配位数常因空间位阻.静电斥力等的作用而难以实现,特别是配体为有机配体时更是如此,因为有机配体通常为多齿配体,形成的螯环具有一定的张力。
如用大小搭配适当的两种或两种以上的配体同时饱和金属离子的配 数则比较容易实现。
一般说来,当配位数>=4时,混配型配合物的形成带有一定的普遍性。
二. 类聚效应 即物以类聚的意思。
指两种软硬度相似的配体容易共存于金属离子的内界,形成混配型配合物。
反之,软硬度相差较大的两种配体则较难共同形成混配型配合物。
如F -为硬碱,而CN -为软碱,很难形成混配型配合物。
而Cl - 与I -,Br -与I -,Br - 与Cl -均可和Ag +形成混配型配合物。
在Ag +-S 2O 32--X -(卤素离子)即有类聚效应,在Ag +-S 2O 32--X -体系中S 2O 32-属于软碱,而X -离子的硬度的大小顺序为:F ->Cl ->Br ->I -因此形成的AgS 2O 3X 混配型配合物的次序也应随F -.Cl -.Br -.I -增大。
(Ag + ) 是软酸表2 Ag +-S 2--X -混配型配合物的稳定常数如下:+三. 竞争能力相当原理几种配体共存于一个体系中时,可能存在的几种情况:A 其中一种配体的配位能力远远比其它配体强,在数量上又点优,溶液中只可能存在单一型的配合物。
如Ag-F-CN 体系,只可能形成Ag-CN 间的配合物。
B 若其中某一配体X 的配位能力比另一配体Y 的差,但其数量多,浓度高,此时也可能形成混配型配合物MXY ,形成混配型的可能性不仅取决于生成单一型配合物的稳定常数的大小,而且还决定于溶液中配体浓度的大小,即当溶液中满足:i MZ i MY i MX Z Y X iii][][][βββ≈≈即:[MX I ]≈[MY I ]≈[MZ I ]此时表明X .Y .Z 对金属离子的竞争能力相当, 容易形成混配型配合物 四 形成混配型配合物的条件的选择 配体的选择:1) 形成MX I Y j Z k 的首要条件是X .Y .Z 必须能和M 配位 2) X .Y .Z 的性质不能相差过予悬殊3) X .Y .Z 与M 形成的二元配合物构型最好相同 4) 若配体X 为多齿配体(体积大),则配体Y .Z 应选择体积小.结构简单的单齿或双齿配体。
能存在混配型配合物时,溶液中可能存在的配合物有多种: 如M -A -B 体系,可能有的配合物为: MA ,MA 2,MA 3。
,MB ,MB 2,MB 3,MAB ,MAB 2,MAB 3,MA 2B ,MA 2B 2,MA 2B 3等。
第二节 溶液中混配型配合物的实验研究目前研究得最多的是三元配合物,实验研究的主要内容是: A 确定其组成B 测定其配合物的稳定常数; 常用的方法:1 电位法,2 pH 法3 分光光度法。
一、电位法电位法适合测定配体之一为不加合质子或另一种也不加合质子的配合物的稳定常数的测定。
对M -A -B 体系,设配位反应为 M +iA +jB =MA i B jji j i ij B A M B MA ][]][[][=β溶液中金属离子的总浓度[M]T 为: [M]T =[M]+[MA]+[MAB]+[MAB 2] +[MB]+[MA 2]+[MA 3]+[MB 2]+[MB 3] =∑∑==Ii Jj j i B MA 00][=∑∑==I i Jj j i ij B A M 00][][][β将[M]移到左边,令F =][][M M T,有 F =][][M M T=∑∑==I i Jj j i ij B A 00][][β可以组成浓差电池进行测定。
[M]T支持电解质 A ,B 配体 [M]T支持电解质E =][][ln M M nF RT T=lnnFRT ∑∑==I i Jj j i ijB A 00][][β实际过程中,溶液中M 的配位数是有一定限度的,形成的配合物的种类也不是无限多的。
将F 式子中展开:F =]...)[][][][(...)][][][1(331221110133022010B A A A A A A +++++++++βββββββ +2321221202]...)[][][][(B A A A ++++ββββ测定过程中,可先固定A 配体的浓度不变,而仅仅变化配体B 的浓度,则F 的关系式成为: F =a+b[B]+c[B]2+d[B]3+… 其中:a=...)][][][1(33022010++++A A A βββ b=...)][][][(3312211101++++A A A ββββ c=...)][][][(321221202++++A A A ββββ d=在[A]=[A]1的情况下,变化[B],可测得一系列的F ,数据处理步骤: 1 以F 对[B]作图,2 根据图求出在[A]=[A]1下的a, b, c, d 等值,此时它们应为常数,它们仅仅与[A]有关,即有a(A 1), b(A 1), c(A 1), d(A 1)3 在固定另一个[A]=[A]2的条件下,变化[B],求出a(A 2), b(A 2), c(A-2), d(A 2)4 在固定另一个[A]=[A]j 的条件下,变化[B],求出a(A j ), b(A j ), c(A j ), d(A j )求得a,b,c,d的各组数据为:a(A1); a(A2); ….a(A i); …b(A1); b(A2); b(A i);c(A1); c(A2); c(A i);d(A1); d(A2); d(A i);实质上,a,b,c,d都是[A]的函数,其形式上a,b,c,d都和F具有相同的形式。
以a,b,c,d对[A]作图可以求出所有的稳定常数。
电位法的优点:理论上可以测出所有的配合物的稳定常数,包括单一型的配合物和混配型配合物。
由W.B.Schaap和D.L.McMasters在1961年提出。
缺点:实验过程复杂,数据处理繁琐。
2 pH法pH法的数据处理较为简单,但适用的体系多为配体A、B都是有机配体的体系。
和单一型配合物稳定常数的测定一样,是由测量pH的变化来进行的。
对于两种配体A、B都为有机配体的情况,用pH法研究混配型配合物时一般可分成以下几类:1)两种配体同时与金属离子结合直接生成混配型配合物;2)分两步形成混配型配合物,但形成MA的反应尚未完成,MAB 便已开始形成;3)完全分两步形成混配型配合物,即形成MA完全后再开始形成MAB其中第三种情况较为常见。
选定其中的一种作为第一配体,另一种为第二配体。
选择的依据主要取决于配体的碱性及各自与金属离子形成单一配合物的稳定性。
● 如果两种配体与M 单一配合物的稳定常数相近,则可考虑加质子常数小的配体为第一配体,加质子常数小,则在较低的pH 下,配体即可与M 配位。
● 如果两配体的加质子常数相近,则可考虑与金属离子单一配合物稳定常数大的配体为第一配体,另一种为第二配体。
总体:选择在低pH 范围内能与金属离子形成稳定的配合物为第一配体。
大多数情况下,只研究MAB 型的混配型配合物,在实验中往往控制[M]T :[A]T :[B]T =1:1:1,M 与A 配位后,还可再与B 配位形成MAB 。
当M 与A 配位后,可认为溶液中的金属离子全部已形成MA ,因此研究配位反应,实际上是研究: MA + iB=MAB Iii i B MA MAB ]][[][1=β 由于认为A 已与M 完全配位,故溶液中游离的,未与M 配位的A 也可以忽略不计,其数据处理方法,相对说来较为简单。
[M]T =[MA]+[MAB]+[MAB 2]+…. [B]T =∑∑==++mi ni i i MAB i B H B 11][][][[H]T =∑=-+mi i OH H B H i 1][][][=∑=-+mi i H i OH H H i B 1][][][][β[B]=∑=+-mi iH iT H i OH H H 1][][][][β令的总浓度的总浓度配位的配体已与M B M n B ==∑∑==+ni i ni iMAB MA MAB i 11][][][=∑∑==+n i ini iiB B i i 111][1][1ββ=Tmi i T M B H B B ][])[]([][1∑=+-第三节 混配型配合物的应用。