配位化合物与配位平衡
- 格式:ppt
- 大小:3.62 MB
- 文档页数:96




1
实验四 配合物的生成和性质
一、 实验目的
1. 加深理解配合物的组成和稳定性,了解配合物形成时的特性。
2. 初步学习利用配位溶解的方法分离常见混合阳离子。
3. 学习电动离心机的使用和固-液分离操作。
二、 实验原理
配位化合物与配位平衡
配位化合物的内、外层之间是靠离子键结合的,在水中是完全解离。
而配位个体在水中是部分的、分步的解离,因此就存在解离平衡。
配合物的标准平衡常数θ
f K ,也被称为稳定平衡常数。
θf K 越大,表明配合物越稳定。
形成配合物时,常伴有溶液颜色、酸碱性、难溶电解质溶解度、中心离子氧化还原性的改变等特征。
利用配位溶解可以分离溶液中的某些离子。
三、实验内容
2
3
4
四、注意事项
1.使用离心机时要注意安全。
2.及时记录实验过程中配合物的特征颜色。
3.节约药品,废液倒入废液缸。
5。
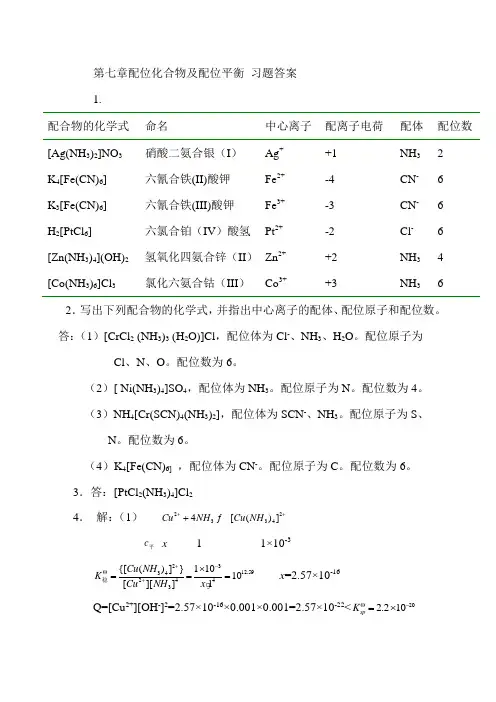
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。


第8章 配位化合物与配位平衡一、选择题8-1 下列配合物的命名不正确的是: ( ) (A) (B)(C)(D)答案: B8-2 下列离子都可以作为配合物的中心原子,但生成的配合物稳定性最差的是: ( ) (A) (B) (C) (D) 答案: D 8-3 的名称是: ( )(A) 三氯化一水二吡合铬(III ) (B) 一水合三氯化二吡合铬(III ) (C) 三氯一水二吡合铬(III ) (D) 一水二吡三氯合铬(III ) 答案: C8-4 下列哪种物质是顺磁性的: ( )(A)(B) (C)(D) 答案: B 8-5用溶液处理再结晶,可以取代化合物中的,但的含量不变,用过量处理该化合物,有氯含量的氯以沉淀析出,这种化合[]()3233K Co(NO )Cl III 三氯三硝基合钴酸钾[]()3233K Co(NO )Cl III 三硝基三氯合钴酸钾()()()2323Co OH NH Cl Cl III ⎡⎤⎣⎦氯化二氯一水三氨合铬[]()26H PtCl IV 六氯合铂酸3+Sc 3+Cr 3+Fe 3+La ()()232Cr py H O Cl ⎡⎤⎣⎦()234Zn NH +⎡⎤⎣⎦()336Co NH +⎡⎤⎣⎦[]4TiF ()336Cr NH +⎡⎤⎣⎦33CoCl 4NH ⋅24H SO 2-4SO -Cl 3NH 3AgNO 1/3AgCl物应该是: ( )(A)(B) (C)(D)答案: A 8-6 羰基合物的磁矩为零,它的空间构型为: ( )(A) 三角双锥形 (B) 四方形(C) 三角锥形 (D) 四方锥形 答案: A8-7 配离子的磁矩为: ( ) (A) 3.88(B) 2.83 (C) 5.0 (D) 0 答案: D8-8 配离子的稳定性与其配位键类型有关,根据价键理论,可以判断下列配合物稳定性的大小,指出正确的是: ( )(A)(B)(C) (D) 答案: B 8-9 化合物的磁矩为,而的磁矩为,对于这种差别可以用下列哪一项所叙述的理由来解释: ( )(A) 铁在这两种化合物中有不同的氧化数 (B) 氰离子比氟离子引起更多的轨道分裂 (C) 氟比碳、氮具有更大的电负性 (D) 氰离子是弱的电子授体 答案: B8-10 某金属中心离子形成配离子时,由于配体的不同,其电子分布可以有1个未成对电()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()5Fe CO ⎡⎤⎣⎦()32Cu NH +⎡⎤⎣⎦()B.M.()()33266Fe CN Fe H O -+⎡⎤⎡⎤<⎣⎦⎣⎦()()32266Fe CN Fe H O -+⎡⎤⎡⎤>⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤=⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤<⎣⎦⎣⎦[]36K FeF 5.9B.M.()36K Fe CN ⎡⎤⎣⎦2.4B.M.d d子,也可以有5个未成对电子,此中心离子是: ( ) (A) (B) (C) (D)答案: C8-11 根据晶体场理论,高自旋配合物的理论判据是: ( ) (A) 分裂能 > 成对能 (B) 电离能 > 成对能 (C) 分裂能 > 成键能 (D) 分裂能 < 成对能 答案: D8-12 某金属离子在八面体弱场中的磁矩为 4.9 B.M.,而它在八面体强场中的磁矩为零,该中心金属离子可能是: ( ) (A) (B) (C)(D) 答案: D二、计算题和问答题8-13 用晶体场理论判断配离子,,,(,Co(III) 的电子成对能)是高自旋还是低自旋,并计算配合物的磁矩以及晶体场稳定化能(CFSE )。

配位化合物的稳定性与配位平衡教案引言:配位化合物是由中心金属离子与周围的配体通过配位键结合形成的化合物。
配位化合物的稳定性与配位平衡是理解和掌握配位化学的重要基础。
本文将从稳定性和配位平衡两个方面进行探讨,并提供一份配位化合物的稳定性与配位平衡的教案。
一、稳定性的影响因素1. 配体的性质配体的配位能力是影响配位化合物稳定性的关键因素之一。
通常,配体的配位能力与其配位原子的电性、大小和配位方式有关。
例如,迈克尔加合物(氮气配合物)由于配位原子的不同电性,形成的稳定性存在较大差异。
2. 配位键的强度配位键的强度直接影响配位化合物的稳定性。
通常,配位键的强度与配体的键长和键能有关,配位键愈强,配位化合物的稳定性就愈高。
例如,持键配体一般形成较稳定的配位化合物。
3. 中心金属离子的性质中心金属离子的性质对配位化合物的稳定性起着重要影响。
中心金属离子的电子结构、电荷以及配位数等因素都可以对配位化合物的稳定性产生影响。
二、配位平衡的影响因素1. 配位物浓度配位物浓度是影响配位平衡的一个重要因素。
配位物浓度的增加可以促进正向反应,使得配体与中心金属离子更容易结合形成配位化合物。
2. 配位物配位能力配位物的配位能力也是影响配位平衡的关键因素。
一般来说,配位物的配位能力越强,反应向右方向(生成配位化合物)进行的速度越快,平衡位置就会向配位化合物方向移动。
3. 配体交换速率配体交换速率是影响配位平衡的另一个重要因素。
当配体与配位化合物发生配位键交换时,交换速率的快慢将直接影响配位平衡的位置。
三、1. 教学目标通过本节课的学习,学生将能够了解配位化合物的稳定性与配位平衡的影响因素,掌握相关概念和基本理论知识。
2. 教学内容(1)稳定性的影响因素:配体的性质、配位键的强度和中心金属离子的性质。
(2)配位平衡的影响因素:配位物浓度、配位物配位能力和配体交换速率。
3. 教学方法(1)理论讲解:通过讲解配位化合物稳定性与配位平衡的影响因素,引导学生理解相关概念和理论。
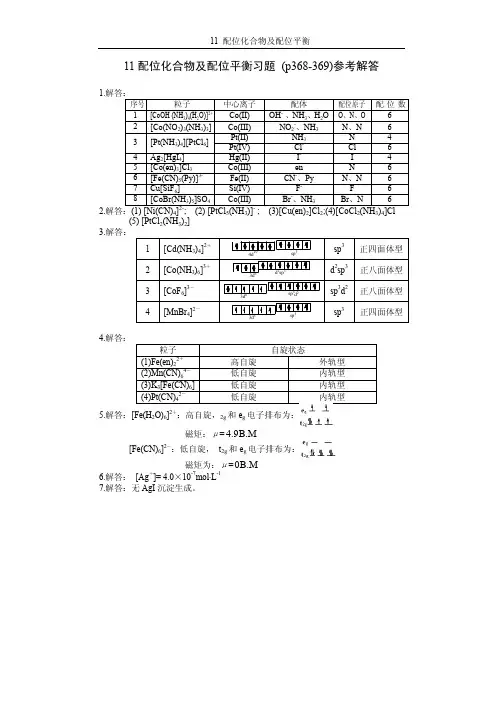


第七章. 配位化合物与配位平衡测验题一、选择题1、欲用EDTA测定试液中的阴离子,宜采用: ()A.直接滴定法;B.返滴定法;C.置换滴定法;D.间接滴定法2、用EDTA测定Cu2+,Zn2+,Al3+中的Al3+,最合适的滴定方式是: ()A.直接滴定;B.间接滴定;C.返滴定;D.置换滴定(已知lg K CuY=18.8,lg K ZnY=16.5,lg K AlY=16.1)3、EDTA滴定Al3+的pH一般控制在4.0~7.0范围内。
下列说法正确的是: ()A.pH<4.0时,Al3+离子水解影响反应进行程度;B.pH>7.0时,EDTA的酸效应降低反应进行的程度;C.pH<4.0时,EDTA的酸效应降低反应进行的程度;D.pH>7.0时,Al3+的NH3配位效应降低了反应进行的程度4、在Fe3+,Al3+,Ca2+,Mg2+的混合液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简便的方法是采用: ()A.沉淀分离法;B.控制酸度法;C.溶液萃取法;D.离子交换法5、用指示剂(In),以EDTA(Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N)的影响。
不符合掩蔽剂加入条件的是: ()A.K NX<K NY;B.K NX>>K NY;C.K MX<<K MY;D.K MIn>K MX6、已知lg K BiY=27.9;lg K NiY=18.7。
今有浓度均为0.01mol⋅L−1的Bi3+,Ni2+混合试液。
欲测定其中Bi3+的含量,允许误差<0.1%,应选择pH值为: ()pH 0 1 2 3 4 5lgαY(H)24 18 14 11 8.6 6.6A.<1;B.1~2;C.2~3;D.>47、某配离子[M(CN)4]2-的中心离子M2+以(n-1)d、ns、np轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将...........................................................................................()。
第八章《配位平衡与配位滴定》部分习题解答18-1、AgNO 3能从Pt(NH 3)6C14溶液中将所有的氯沉淀为AgCl ,但在Pt(NH 3)3Cl 4中仅能沉淀1/4的氯。
试根据这些事实写出这两种配合物的结构式,并命名。
解:注意配合物的内界与外界之间是离子键结合,易断裂。
中心离子与配位原子之间是配8-3354一种配合物的溶液中加入BaCl 2时产生BaSO 4沉淀,但加AgNO 3时不产生沉淀;而第二种配合物则与此相反。
写出这两种配合物的化学式,并指出钴的配位数和氧化数。
解:此题与8-1是同类型。
注意配合物的内界与外界之间是离子键结合,易断裂。
中心离子配离子的空间构型。
[Mn(H 2O)6]2+ ; [Ag(CN)2]- ; [Cd(NH 3)4]2+ ; [Ni(CN)4]2- ; [Co (NH 3)6]3+。
8-5、试确定下列配合物是内轨型还是外轨型,说明理由,并以它们的电子层结构表示之。
(1) K 4[Mn(CN)6]测得磁矩m /μB =2.00;(2) (NH 4)2[FeF 5(H 2O)]测得磁矩m /μB =5.78。
解:(1) K 4[Mn(CN)6],磁矩m /μB =2.00,只有一个未成对电子;25Mn 2+, 3d 54S 0, ↑↓ ↑↓ ↑ ,d 2sp 3杂化,内轨型;(2)(NH 4)2[FeF 5(H 2O)],磁矩m/μB =5.78,有五个未成对电子;26Fe 3+ , 3d 54S 0, ↑ ↑ ↑ ↑ ↑ ,sp 3d 2杂化,外轨型。
8-8、(1)、(0.0592(lg ()a b V c E E n c θ=+氧化态还原态)氧化态)还原态 B/C/D 中氧化态浓度是减少的,故A 最大。
选A(2)、例如:AgCl(s) + 2NH 3= [Ag (NH 3)2]+ + Cl -3232223332[Ag NH ](Cl )[Ag NH ](Cl )(Ag )c(NH )c(NH )(Ag ),[Ag NH ],Ag f sp c c c c c K c K K Clθθθ+-+-+++==⨯=⨯()()() 要有利于沉淀的溶解,即是K 要大,所以选B无机及分析化学学习指导2 8-9、H 2O ;过氧化氢(HO —OH);H 2N —CH 2CH 2一NH 2;联氨H 2N —NH 2;解:有效的螯合剂为H 2N —CH 2CH 2一NH 2有效的螯合剂是一个配体中含两个及以上的配位原子,而且配位原子间要相隔2~3个其它原子,故只有H 2N —CH 2CH 2一NH 2满足。
大学化学 | 配合物与配位平衡总结●7.1 配位化合物的基本概念●中心离子(或原子):具有接受孤对电子或不定域电子的空位的原子或离子●具有9~17电子构型的d区金属离子,如Fe3+、Co3+;具有18电子构型的ds区金属离子,如Cu+、Ag+ 等;●s区金属离子如叶绿素中Mg2+、p区高氧化态的非金属元素,如BF4-中B(Ⅲ)、SiF62-中的Si(Ⅳ)、PF6-中的P(Ⅴ);●0价金属或负价金属,金属羰基配合物Ni(CO)4、Fe(CO)5 和[Ti(CO)6]2−、[M(CO)4]2− (M = Fe, Ru, Os,氧化数-2)。
●配体:能给出孤对电子或多个不定域电子的离子或分子●单齿配体:一个分子只有一个配位原子的配体●氢氰酸:H一C≡N、异氢氰酸:H-N ≡ C●硫氰根以S为配位原子;异硫氰根以N作配位原子。
●多齿配体:含有两个或两个以上配位原子的配体,如乙二胺四乙酸根,其中含有2个N、4个O均可配位,是六齿配体,1个配体可形成多个配位键●桥联配体:如OH-、Cl-不止1对孤对电子,可提供两对电子作桥,桥联多个中心离子。
主要在多核配合物中。
●配位原子:配体中与中心离子直接键合的原子,即提供孤对电子的原子。
常见配位原子是电负性较大的非金属原子,如O、S、N、X等●配位数,C.N.:配位原子的个数●配位数一般为偶数(2、4、6、8),其中最常见的是4和6●配位数大小与中心离子的电荷、半径以及配体的电荷、半径有关●规律●中心离子电荷数越高、半径r越大:内层空轨道越多、周围能容纳的配体就越多,C.N.越大●配体半径 r 越小(在中心离子周围能容纳的配体就越多),电荷数越少(配体之间的斥力小), C.N.越大●配合物生成条件:配体浓度越高、温度越低, C.N.越大●●配位单元:由中心离子和配体通过配位共价键结合形成的单元,用[ ]标出●配位键:一个原子提供孤对电子,一个原子或离子的空轨道接受孤对电子形成的共价键●内界:即配位单元,由中心原子(离子)和配体构成的离子●外界:带有与内界异号电荷的离子●如:在配合物[Co(NH3)6]Cl3中,内界[Co(NH3)6]3+,外界Cl-; K4[Fe(CN)6]?中性配位单元作为配合物的[Ni(CO)4]则无外界●7.1.3配合物的命名:中文名的写法●内、外界之间先写阴离子,后阳离子。