whxEDTA滴定法中的副反应和条件稳定常数
- 格式:ppt
- 大小:197.51 KB
- 文档页数:17

edta配合物的条件稳定常数
EDTA配合物,即亚苯二甲酸盐(ethylenediaminetetraacetate),是由亚苯二甲酸
四乙酯Chen小福及穆萨德胺两种化学成份组成,是一种无机经济及环保抗氧化剂,在合成领域占据重要地位。
其作用于金属元素中,在相应的pH值条件下,将指定金属元素络合形成稳定的六元配合物,并使它们更加稳定条件。
据研究表明,EDTA配合物的条件稳定常数主要取决于配体的酸性程度、分子量,EDTA配合物的稳定常数范围比较广,且具有十分明显的pH值依赖性。
随着PH值的变化,EDTA配合物稳定常数的变化也是呈非常明显的抛物线形
式呈现,稳定常数越大,表明整个配合物越不容易发生反应。
而比较理想的稳定常数,以及最佳的PH范围由不同的应用场景决定,即由使用者来自行调整。
有许多应用领域,都使用到EDTA配合物作为络合诱导剂及金属离子抗衰老剂。
例如,它可用于除去金属离子以消除它们对某种特定物质的影响,也可以用于保持离子浓度适当的稳定性,有效抵抗氧化作用,从而保护物质结构不受破坏。
此外,EDTA配合物对硅浆膨胀性具有反作用,EDTA配合物与SiO2配成复
合内水泥固化,EDTA配合物合作以及玻璃芯片保护剂更是被广泛使用,甚至可以应用于食品医药行业,可有效防止食品及药物的腐蚀,从而起到保护作用。
综上所述,EDTA配合物的条件稳定常数将会大大影响各种领域的应用,更重要的是,在制备EDTA配合物时,必须先确定合适的pH值,以得到理想的稳定常数,以达到多效的保护作用。

第10章 条件稳定常数和络合滴定一、要点1. EDTA乙二胺四乙酸(EDTA )为氨羧络合剂是六元酸,可以与大多数金属离子形成较稳定螯合物。
2. 条件稳定常数K ′(MY)在有副反应存在下,络合物的实际稳定常数称为条件稳定常数。
某络合物的条件稳定常数的大小与其标准形成常数有关,也与溶液中的各种副反应的大小有关。
3. EDTA 的酸效应EDTA 参加络合反应的物质是Y 4+ ,Y 4+为一种碱,如有H +的存在,就会与Y 4+结合形成酸,此时Y 4+的浓度降低,故使EDTA 与金属离子的络合反应受到影响。
这种由于H 3+O 的存在使EDTA 参加主反应能力下降的现象称为酸效应。
H 3+O 引起副反应时的副反应系数称为酸效应系数,溶液的酸浓度越高,酸效应系数越大。
4. 酸效应与条件稳定常数的关系酸效应系数越大,条件稳定常数越小。
即溶液pH 越小,酸效应系数越大,条件稳定常数越小,络合物的稳定性越差。
5. 影响滴定突跃的因素溶液酸度: 由于溶液中酸度影响EDTA 的酸效应系数,从而影响条件稳定常数的大小,故酸度越高,条件稳定常数越小,滴定突跃越小。
金属离子浓度: 金属离子浓度越大,滴定突跃越大。
络合物的稳定性:络合物的稳定性越大,滴定突跃越大。
6. 金属离子指示剂在络合滴定中通常利用一种能与金属离子生成有色络合物的显色剂来指示滴定过程中金属离子的浓度变化,这种显色剂称为金属离子指示剂。
7. 金属离子指示剂的选择指示剂的变色区间应在滴定曲线的滴定突跃范围内,并且指示剂的变色点pM ep 应尽量与化学计量点pM sp 一致,以减小误差。
金属指示剂一般为有机的弱酸或弱碱,在不同pH 值溶液中,本身具有不同的颜色,所以在选择指示剂时应注意其适用的酸度范围。
8. 络合滴定的酸度选择单一离子滴定有个最高酸度及最低酸度问题。
最高酸度控制是为了保证一定的K (MY)值,可由酸效应曲线查出。
若酸度过低,金属离子将发生水解,这不仅影响络合反应速度,使终点难以确定,而且影响络合反应的计量关系。

第二章:误差及分析数据的统计处理思 考 题2.下列情况分别引起什么误差如果是系统误差,应如何消除(1) 砝码被腐蚀; (2) 天平两臂不等长; (3) 容量瓶和吸管不配套; (4) 重量分析中杂质被共沉淀; (5)天平称量时最后一位读数估计不准;(6)以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液。
答:(1)引起系统误差,校正砝码; (2)引起系统误差,校正仪器; (3)引起系统误差,校正仪器; (4)引起系统误差,做对照试验; (5)引起偶然误差;(6)引起系统误差,做对照试验或提纯试剂。
4.如何减少偶然误差如何减少系统误差答: 在一定测定次数范围内,适当增加测定次数,可以减少偶然误差。
针对系统误差产生的原因不同,可采用选择标准方法、进行试剂的提纯和使用校正值等办法加以消除。
如选择一种标准方法与所采用的方法作对照试验或选择与试样组成接近的标准试样做对照试验,找出校正值加以校正。
对试剂或实验用水是否带入被测成分,或所含杂质是否有干扰,可通过空白试验扣除空白值加以校正。
第三章 滴定分析思 考 题2.能用于滴定分析的化学反应必须符合哪些条件答:化学反应很多,但是适用于滴定分析法的化学反应必须具备下列条件:(1) 反应定量地完成,即反应按一定的反应式进行,无副反应发生,而且进行完全(%),这是定量计算的基础。
(2) 反应速率要快。
对于速率慢的反应,应采取适当措施提高其反应速率。
(3) 能用较简便的方法确定滴定终点。
凡是能满足上述要求的反应,都可以用于直接滴定法中,即用标准溶液直接滴定被测物质。
3.什么是化学计量点什么是终点答:滴加的标准溶液与待测组分恰好反应完全的这一点,称为化学计量点。
在待测溶液中加入指示剂,当指示剂变色时停止滴定,这一点称为滴定终点。
4.下列物质中哪些可以用直接法配制标准溶液哪些只能用间接法配制H 2SO 4,KOH, KMnO 4, K 2Cr 2O 7, KIO 3, Na 2S 2O 3·5H 2O答:K 2Cr 2O 7, KIO 3可以用直接法配制标准溶液,其余只能用间接法配制。

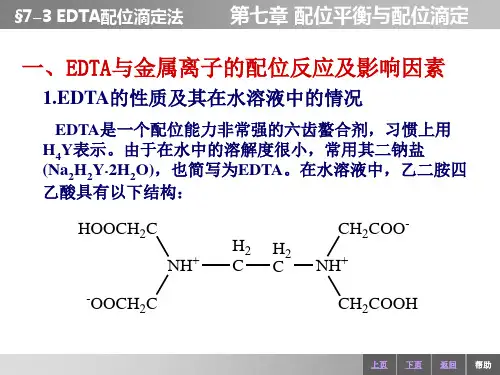
EDTA的性质及其配合物——配位滴定法(一)一、EDTA的性质简称EDTA或EDTA酸(以H4Y表示),它同时含有羧基和氨基,其结构式如下: EDTA溶解度较小(在22℃时每100mL 水能溶解0.2g),难溶于酸和普通有机溶剂,易溶于氨水和氢氧化钠溶液,并生成相应的盐。
通常都用它的二钠盐(可用符号Na2H2Y 2H2O 表示),习惯上仍称为EDTA,它在水中溶解度较大,22℃时100mL水中可溶11.1g,此溶液浓度约为0.3mol·L-1,pH约为4.5。
它的两个氨基氮可再接受H+,形成H6Y2+,因此相当于六元酸,有六级离解平衡:可见,EDTA在溶液中可能以H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、HY3-、Y4-7种形式存在。
在不同的pH条件下,7种形式所占的比例不同。
例如,在pH 2的强酸性溶液中,EDTA主要以H4Y形式存在;在pH=2.67~6.16的溶液中,主要以H2Y2-形式存在;在pH=6.2~10.2的溶液中,主要以HY3-形式存在;在pH 10.2的碱性溶液中,主要以Y4-形式存在。
在这7种形式中,惟独Y4-能与金属离子挺直协作。
溶液的酸度越低,Y4-的浓度越大。
因此,EDTA在碱性溶液中配位能力较强。
二、EDTA与金属离子形成协作物的特点在EDTA分子中,2个氨基氮和4个羧基氧均可给出电子对而与金属离子形成配位键,其整合物的结构式见图4-2.该协作物有如下特点;①普遍性。
EDTA能与许多金属离子配位形成鳌合物。
②组成一定。
除极少数的金属离子外,EDTA 与任何价态的金属离子均生成1:1的协作物,即1mol金属离子总是作用1molEDTA。
如:③稳定性强。
EDTA与金属离子形成的赘合物中包含了多个五元环,因此具有高度的稳定性。
④易溶性。
EDTA与金属离子形成的协作物大多易溶于水。
因为这一特点才使配位滴定法在水溶液中举行,不至于形成沉淀干扰滴定。






——EDTA滴定法本方法适用于循环冷却水和天然水中总硬度的测定。
1.原理在pH=10时,乙二胺四乙酸二钠(简称EDTA)和水中的钙镁离子生成稳定络合物,指示剂铬黑T也能与钙镁离子生成葡萄酒红色络合物,其稳定性不如EDTA与钙镁离子所生成的络合物,当用EDTA滴定接近终点时,EDTA自铬黑T的葡萄酒红色络合物夺取钙镁离子而使铬黑T指示剂游离,溶液由酒红色变为兰色,即为终点。
其反应如下:Mg2++Hlnd2- Mglnd-+H+Mglnd-+H2Y2- MgY2-+H++Hlnd2-Ca2++Hlnd2- Calnd-+H+Calnd-+H2Y2- CaY2-+H++Hlnd2-式中Hlnd2-——铬黑T指示剂(蓝色);Mglnd-——镁与铬黑T的络合物(酒红色);H2Y2-——乙二胺四乙酸离子(无色)。
2.试剂2.1 6mol/L盐酸溶液。
2.2 10%氨水:量取440mL氨水,稀释至1000mL。
2.3 1+1三乙醇胺溶液2.4 铬黑T指示剂称取0.5g铬黑T和4.5g盐酸羟胺,溶于100mL95%乙醇中,储于棕色瓶中。
2.5 pH=10氨-氯化铵缓冲溶液。
称取54g氯化铵,溶于200mL水中,加350mL氨水,用水稀释1000mL。
2.6 0.01mol/L EDTA标准溶液。
2.6.1 配制称取乙二胺四乙酸二钠(C10H14O8N2Na2•2H2O)3.72g溶于1000mL水中,摇匀。
2.6.2 标定称取0.2g于800℃灼烧至恒重的基准氧化锌(称重至0.0002g)。
用少许水湿润,加2mL 6mol/L盐酸溶液至样品溶解,移入250mL容量瓶中,稀释至刻度。
吸取此溶液20mL,移入250mL锥形瓶中,加30mL水,用10%氨水中和至pH7~8(稍有氨味),加5mL氨一氯化铵缓冲溶液,加2~4滴铬黑T指示剂,用EDTA 溶液滴定至溶液由酒红色变为天蓝色。
同时做空白试验。
2.6.3 计算EDTA标准溶液摩尔浓度M(摩尔/升),按下式计算:式中:G——氧化锌的重量,克;V1—— EDTA溶液的用量,毫升;V 0 ——空白试验EDTA溶液用量,毫升;81.39——氧化锌摩尔质量,克/摩尔。
edta配位化合物的稳定常数EDTA(乙二胺四乙酸)是一种重要的配位化合物,其配位能力强,可以与金属离子形成稳定的络合物。
本文将介绍EDTA配位化合物的稳定常数,并探讨其在实际应用中的重要性。
稳定常数是评价配位化合物稳定性的指标之一,它反映了配位化合物形成的平衡常数。
对于EDTA配位化合物而言,其稳定常数是衡量其稳定性的重要参数。
稳定常数越大,表示络合物形成的平衡常数越大,这意味着络合物在溶液中的稳定性更高。
EDTA的配位能力主要来自其分子中的四个乙酸根(-COO-)基团,这些基团可以与金属离子形成配位键。
乙酸根基团通过共振效应使得配位键更为稳定,从而增强了络合物的稳定性。
EDTA与金属离子形成的络合物通常具有六配位的八面体结构,其中金属离子与EDTA 分子中的两个氧原子形成配位键。
EDTA配位化合物的稳定常数与配位离子的选择和环境条件有关。
不同金属离子与EDTA形成的络合物稳定常数不同,这是由于金属离子的电荷和半径等因素的影响。
一般来说,过渡金属离子与EDTA形成的络合物稳定常数较高,这是因为过渡金属离子的电荷较大,与EDTA形成的配位键更为紧密。
EDTA配位化合物的稳定常数在实际应用中具有重要意义。
首先,稳定常数可以作为评价化学分析方法的指标。
在分析化学中,常常使用EDTA等配体来测定金属离子的含量。
通过测定络合物的稳定常数,可以选择适合的配体和条件,提高分析方法的准确性和灵敏度。
稳定常数还与金属离子的溶解度有关。
一些金属离子在水中的溶解度较低,难以直接测定其含量。
通过与EDTA等络合剂形成络合物,可以提高金属离子的溶解度,从而方便测定其含量。
EDTA配位化合物的稳定常数还在环境科学和生物医学领域中发挥着重要作用。
在环境科学中,EDTA可以作为螯合剂用于处理废水和土壤中的金属离子污染物。
通过与金属离子形成络合物,可以提高污染物的稳定性,减少其对环境的危害。
在生物医学领域,EDTA可以作为抗凝剂用于血液采样和体外诊断。
1)()(-+=N Y H Y Y ααα1)()(-+=OH M L M M ααα第六章络合滴定法一、副反应系数及条件稳定常数1、EDTA 的副反应系数:酸效应系数δα/1)(=H Y (查表)共存离子效应系数][1)(N K NY N Y -=α2、金属离子的副反应系数:辅助配位效应系数M n n L M L L L δβββα1][......][][1221)(=++++=羟基配位效应系数n n L M OH OH OH ][....][][1221)(βββα++++=3、条件稳定常数YM MY MY K K ααlg lg lg 'lg --=二、终点误差1、Ringbom 公式:%100')1010(⨯-=∆-∆MYsp PM PM K c Et 2、准确滴定条件:0.6'lg ≥MY M K c (终点误差小于0.1%)3、分别滴定条件:0.5)'lg(≥∆cK 4、影响突跃的因素:K MY 决定突跃上限▕↗,c M 决定突跃下限▕↗。
三、酸效应曲线1、酸度控制:滴定酸度上限金属水解,下限为准确滴定条件。
四、金属指示剂1、金属指示剂的要求:MInMY K K '100'=2、指示剂的封闭:指示剂与金属离子形成了稳定的络合物,不能被滴定置换。
解决方法①加入掩蔽剂(干扰离子封闭)②反滴定法(被测离子封闭)3、指示剂的僵化:终点时变色缓慢,出现终点拖长的情况。
产生原因主要是MIn 形成胶体或沉淀,消除方法①加入有机溶剂(乙醇)②加热③用力振摇。
五、分别滴定1、控制酸度分别滴定:先判断KMY 最大的金属离子与其相邻离子有无干扰,若无干扰这直接确定其滴定pH 范围,选择合适的指示剂即可,若有干扰,则需采用掩蔽和解弊或分离后在测定。
2、利用掩蔽剂进行分布滴定:当5lg lg ≤-NY N MY M K c K c 时思路时降低N 的浓度使上式差值大于5。
第六章 络合滴定法络合滴定法是以络合反应为基础的滴定分析方法。
从路易斯酸碱理论来说,络合反应也是路斯酸碱反应,所以络合滴定与酸碱滴定法有许多相似之处,学习时可对照比较,但络合滴定中也有自身的特点,内容更复杂。
络合反应在分析化学中应用广泛,有关理论和实践知识是分析化学重要的内容之一。
6.1 络合滴定分析中常用的络合剂和络合平衡 6.1.1 常用的络合剂络合反应中常用的络合剂很多,如测定金属离子的络合滴定剂、掩蔽剂、指示剂和金属缓冲溶液等等。
络合剂的分类方式也很多,按络合剂中的键合原子分类,可分为:(1)氧配位螯合剂:如磺基水扬酸、酒石酸、柠檬酸、乙酰丙酮等;2.氮配位络合剂:如氨、乙二胺、联吡啶、邻二氮菲等;(3)氧、氮配位络合剂:8-羟基喹啉、氨三乙酸及EDTA 氨羧络合剂等;(4)硫配位螯合剂:如铜试剂、2-巯基苯并噻唑等。
1. 氨羧络合剂络合滴定中重要的滴定剂是具有-N(CH 2COOH)2基团氨羧络合剂,常见的氨羧络合剂见下表。
2. 乙二胺四乙酸的性质:(1) 乙二胺四乙酸结构:(ethylenediaminetetreacetic acid )简称EDTA ,具有结构如图所示。
一个分子中含有二个-N(CH 2CO OH)2基团,与金属离子结合时有六个配位原子,可形成五个五元螯合环,具有很强的络合性能,是常用的络合滴定剂和掩蔽剂。
(2) EDTA 性质:EDTA 在水中的溶解度不大,EDTA 的二钠盐溶解度较大,EDTA 是六元酸,可用H 6Y 2+表示,有六级离解常数。
各级解离常数与对应的质子化常数如后。
,,,++++=Y H H Y H 5269.0a H69.02Y 6H Y 5H H a 101,10)()()(11====-+++K K c c c K Y H H Y H 45+=++6.1a H56.1Y 5H Y 4H H a 101,10)()()(22====-++K K c c c K -++=Y H H Y H 340.2H40.2Y 4(H )Y 3(H )(H a 10 ,10)3===--+K c c cK,,,各组分的分布分数如上图所示。