whxEDTA滴定法中的副反应和条件稳定常数
- 格式:ppt
- 大小:209.50 KB
- 文档页数:17

edta配合物的条件稳定常数
EDTA配合物,即亚苯二甲酸盐(ethylenediaminetetraacetate),是由亚苯二甲酸
四乙酯Chen小福及穆萨德胺两种化学成份组成,是一种无机经济及环保抗氧化剂,在合成领域占据重要地位。
其作用于金属元素中,在相应的pH值条件下,将指定金属元素络合形成稳定的六元配合物,并使它们更加稳定条件。
据研究表明,EDTA配合物的条件稳定常数主要取决于配体的酸性程度、分子量,EDTA配合物的稳定常数范围比较广,且具有十分明显的pH值依赖性。
随着PH值的变化,EDTA配合物稳定常数的变化也是呈非常明显的抛物线形
式呈现,稳定常数越大,表明整个配合物越不容易发生反应。
而比较理想的稳定常数,以及最佳的PH范围由不同的应用场景决定,即由使用者来自行调整。
有许多应用领域,都使用到EDTA配合物作为络合诱导剂及金属离子抗衰老剂。
例如,它可用于除去金属离子以消除它们对某种特定物质的影响,也可以用于保持离子浓度适当的稳定性,有效抵抗氧化作用,从而保护物质结构不受破坏。
此外,EDTA配合物对硅浆膨胀性具有反作用,EDTA配合物与SiO2配成复
合内水泥固化,EDTA配合物合作以及玻璃芯片保护剂更是被广泛使用,甚至可以应用于食品医药行业,可有效防止食品及药物的腐蚀,从而起到保护作用。
综上所述,EDTA配合物的条件稳定常数将会大大影响各种领域的应用,更重要的是,在制备EDTA配合物时,必须先确定合适的pH值,以得到理想的稳定常数,以达到多效的保护作用。


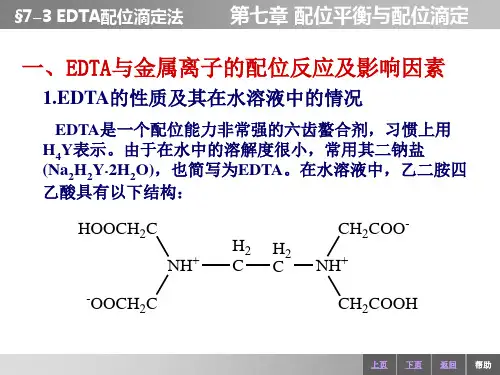
第10章 条件稳定常数和络合滴定一、要点1. EDTA乙二胺四乙酸(EDTA )为氨羧络合剂是六元酸,可以与大多数金属离子形成较稳定螯合物。
2. 条件稳定常数K ′(MY)在有副反应存在下,络合物的实际稳定常数称为条件稳定常数。
某络合物的条件稳定常数的大小与其标准形成常数有关,也与溶液中的各种副反应的大小有关。
3. EDTA 的酸效应EDTA 参加络合反应的物质是Y 4+ ,Y 4+为一种碱,如有H +的存在,就会与Y 4+结合形成酸,此时Y 4+的浓度降低,故使EDTA 与金属离子的络合反应受到影响。
这种由于H 3+O 的存在使EDTA 参加主反应能力下降的现象称为酸效应。
H 3+O 引起副反应时的副反应系数称为酸效应系数,溶液的酸浓度越高,酸效应系数越大。
4. 酸效应与条件稳定常数的关系酸效应系数越大,条件稳定常数越小。
即溶液pH 越小,酸效应系数越大,条件稳定常数越小,络合物的稳定性越差。
5. 影响滴定突跃的因素溶液酸度: 由于溶液中酸度影响EDTA 的酸效应系数,从而影响条件稳定常数的大小,故酸度越高,条件稳定常数越小,滴定突跃越小。
金属离子浓度: 金属离子浓度越大,滴定突跃越大。
络合物的稳定性:络合物的稳定性越大,滴定突跃越大。
6. 金属离子指示剂在络合滴定中通常利用一种能与金属离子生成有色络合物的显色剂来指示滴定过程中金属离子的浓度变化,这种显色剂称为金属离子指示剂。
7. 金属离子指示剂的选择指示剂的变色区间应在滴定曲线的滴定突跃范围内,并且指示剂的变色点pM ep 应尽量与化学计量点pM sp 一致,以减小误差。
金属指示剂一般为有机的弱酸或弱碱,在不同pH 值溶液中,本身具有不同的颜色,所以在选择指示剂时应注意其适用的酸度范围。
8. 络合滴定的酸度选择单一离子滴定有个最高酸度及最低酸度问题。
最高酸度控制是为了保证一定的K (MY)值,可由酸效应曲线查出。
若酸度过低,金属离子将发生水解,这不仅影响络合反应速度,使终点难以确定,而且影响络合反应的计量关系。



一、判断题1、(配位比例特点)配位滴定反应中EDTA 与金属离子的比例一般都是1:1。
(√)2、(稳定常数的概念)EDTA 与某金属离子形成的配合物具有较大的稳定性,也就意味着EDTA 与该金属离子配位反应平衡常数较大。
(√)3、(滴定突跃显著性的影响因素)配位滴定中所有的副反应都对使滴定突跃范围变窄。
(×)4、(副反应系数的数值)若滴定过程中不发生副反应,则副反应系数数值为0。
(×)5、(总副反应系数与分副反应系数的关系)某物质可发生两种副反应,则该物质总的副反应系数为两分副反应系数的加和。
(×)6、(酸效应系数的基本概念)配位滴定中,溶液的pH 越高,则酸效应系数越大。
(×)7、(羟基配位效应系数的基本概念) 配位滴定中,溶液的pH 越高,则羟基配位效应系数越大。
(√)8、(金属指示剂原理)EDTA 滴定金属离子,若使用金属指示剂指示SP ,则EDTA 滴入量在SP 附近时指示剂应发生配位态到游离态的转变。
(√)9、(金属指示剂原理)配位滴定时指示剂与待测金属离子形成的配合物的条件稳定常数越大越好。
(×)10、(金属指示剂原理)金属指示剂只有在合适的pH 条件下,游离态与配位态才会有显著的颜色差异。
(√)11、(金属指示剂原理)金属指示剂的封闭现象是指其与金属形成的配合物溶解性差,使变色反应变慢,而导致终点拖后延长。
(×)12、(金属指示剂原理)金属指示剂的僵化现象是指其与金属形成的配合物稳定性太强,计量点处不明显发生配位态到游离态的转变,而导致无法准确指示计量点。
(×)13、(掩蔽的作用)用EDTA 滴定法测定石灰石中的CaO 和MgO ,滴定前需向溶液中加入三乙醇胺,其目的是掩蔽Fe 3+、Al 3+和 Mn 2+,防止干扰测定。
(√)14、(掩蔽的作用)用EDTA 滴定Ca 2+和Mg 2+的混合溶液前,先将溶液pH 调至≥12,目的是使Mg 2+生成沉淀,通过掩蔽消除其对Ca 2+测定的干扰。




edta配位化合物的稳定常数EDTA(乙二胺四乙酸)是一种重要的配位化合物,其配位能力强,可以与金属离子形成稳定的络合物。
本文将介绍EDTA配位化合物的稳定常数,并探讨其在实际应用中的重要性。
稳定常数是评价配位化合物稳定性的指标之一,它反映了配位化合物形成的平衡常数。
对于EDTA配位化合物而言,其稳定常数是衡量其稳定性的重要参数。
稳定常数越大,表示络合物形成的平衡常数越大,这意味着络合物在溶液中的稳定性更高。
EDTA的配位能力主要来自其分子中的四个乙酸根(-COO-)基团,这些基团可以与金属离子形成配位键。
乙酸根基团通过共振效应使得配位键更为稳定,从而增强了络合物的稳定性。
EDTA与金属离子形成的络合物通常具有六配位的八面体结构,其中金属离子与EDTA 分子中的两个氧原子形成配位键。
EDTA配位化合物的稳定常数与配位离子的选择和环境条件有关。
不同金属离子与EDTA形成的络合物稳定常数不同,这是由于金属离子的电荷和半径等因素的影响。
一般来说,过渡金属离子与EDTA形成的络合物稳定常数较高,这是因为过渡金属离子的电荷较大,与EDTA形成的配位键更为紧密。
EDTA配位化合物的稳定常数在实际应用中具有重要意义。
首先,稳定常数可以作为评价化学分析方法的指标。
在分析化学中,常常使用EDTA等配体来测定金属离子的含量。
通过测定络合物的稳定常数,可以选择适合的配体和条件,提高分析方法的准确性和灵敏度。
稳定常数还与金属离子的溶解度有关。
一些金属离子在水中的溶解度较低,难以直接测定其含量。
通过与EDTA等络合剂形成络合物,可以提高金属离子的溶解度,从而方便测定其含量。
EDTA配位化合物的稳定常数还在环境科学和生物医学领域中发挥着重要作用。
在环境科学中,EDTA可以作为螯合剂用于处理废水和土壤中的金属离子污染物。
通过与金属离子形成络合物,可以提高污染物的稳定性,减少其对环境的危害。
在生物医学领域,EDTA可以作为抗凝剂用于血液采样和体外诊断。
1)()(-+=N Y H Y Y ααα1)()(-+=OH M L M M ααα第六章络合滴定法一、副反应系数及条件稳定常数1、EDTA 的副反应系数:酸效应系数δα/1)(=H Y (查表)共存离子效应系数][1)(N K NY N Y -=α2、金属离子的副反应系数:辅助配位效应系数M n n L M L L L δβββα1][......][][1221)(=++++=羟基配位效应系数n n L M OH OH OH ][....][][1221)(βββα++++=3、条件稳定常数YM MY MY K K ααlg lg lg 'lg --=二、终点误差1、Ringbom 公式:%100')1010(⨯-=∆-∆MYsp PM PM K c Et 2、准确滴定条件:0.6'lg ≥MY M K c (终点误差小于0.1%)3、分别滴定条件:0.5)'lg(≥∆cK 4、影响突跃的因素:K MY 决定突跃上限▕↗,c M 决定突跃下限▕↗。
三、酸效应曲线1、酸度控制:滴定酸度上限金属水解,下限为准确滴定条件。
四、金属指示剂1、金属指示剂的要求:MInMY K K '100'=2、指示剂的封闭:指示剂与金属离子形成了稳定的络合物,不能被滴定置换。
解决方法①加入掩蔽剂(干扰离子封闭)②反滴定法(被测离子封闭)3、指示剂的僵化:终点时变色缓慢,出现终点拖长的情况。
产生原因主要是MIn 形成胶体或沉淀,消除方法①加入有机溶剂(乙醇)②加热③用力振摇。
五、分别滴定1、控制酸度分别滴定:先判断KMY 最大的金属离子与其相邻离子有无干扰,若无干扰这直接确定其滴定pH 范围,选择合适的指示剂即可,若有干扰,则需采用掩蔽和解弊或分离后在测定。
2、利用掩蔽剂进行分布滴定:当5lg lg ≤-NY N MY M K c K c 时思路时降低N 的浓度使上式差值大于5。