副反应系数与条件稳定常数的关系.ppt
- 格式:ppt
- 大小:2.37 MB
- 文档页数:43
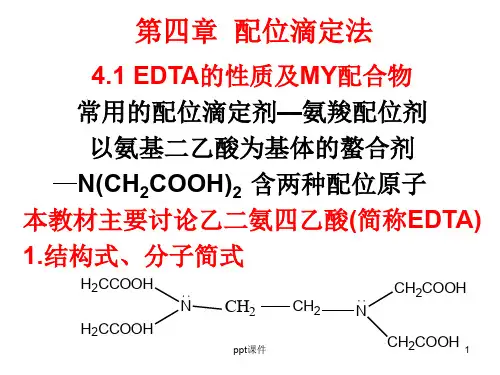









1)()(-+=N Y H Y Y ααα1)()(-+=OH M L M M ααα第六章络合滴定法一、副反应系数及条件稳定常数1、EDTA 的副反应系数:酸效应系数δα/1)(=H Y (查表)共存离子效应系数][1)(N K NY N Y -=α2、金属离子的副反应系数:辅助配位效应系数M n n L M L L L δβββα1][......][][1221)(=++++=羟基配位效应系数n n L M OH OH OH ][....][][1221)(βββα++++=3、条件稳定常数YM MY MY K K ααlg lg lg 'lg --=二、终点误差1、Ringbom 公式:%100')1010(⨯-=∆-∆MYsp PM PM K c Et 2、准确滴定条件:0.6'lg ≥MY M K c (终点误差小于0.1%)3、分别滴定条件:0.5)'lg(≥∆cK 4、影响突跃的因素:K MY 决定突跃上限▕↗,c M 决定突跃下限▕↗。
三、酸效应曲线1、酸度控制:滴定酸度上限金属水解,下限为准确滴定条件。
四、金属指示剂1、金属指示剂的要求:MInMY K K '100'=2、指示剂的封闭:指示剂与金属离子形成了稳定的络合物,不能被滴定置换。
解决方法①加入掩蔽剂(干扰离子封闭)②反滴定法(被测离子封闭)3、指示剂的僵化:终点时变色缓慢,出现终点拖长的情况。
产生原因主要是MIn 形成胶体或沉淀,消除方法①加入有机溶剂(乙醇)②加热③用力振摇。
五、分别滴定1、控制酸度分别滴定:先判断KMY 最大的金属离子与其相邻离子有无干扰,若无干扰这直接确定其滴定pH 范围,选择合适的指示剂即可,若有干扰,则需采用掩蔽和解弊或分离后在测定。
2、利用掩蔽剂进行分布滴定:当5lg lg ≤-NY N MY M K c K c 时思路时降低N 的浓度使上式差值大于5。