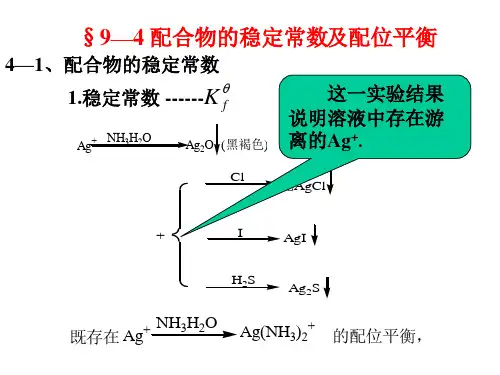
配位化合物的稳定常数.
- 格式:ppt
- 大小:392.50 KB
- 文档页数:6

配位滴定法任务一基础理论基本知识学习目标6.1 配位滴定法概述配位滴定法是以配位反应为基础的滴定分析方法。
配位反应常用的配位剂有无机配位剂和有机配位剂两种。
在配位滴定中常用的配位剂是有机配位剂。
因为配位反应用于配位滴定时必须具备一定的条件。
1.生成的配位化合物必须足够稳定且溶于水,一般要求K稳≥108。
2.配位反应必须按一定的计量关系定量地进行,这是滴定计算的基础。
3.配位反应必须迅速在瞬间完成。
4.有适当的方法确定滴定终点。
由于无机配位剂与金属离子反应生成的配合物稳定常数较小,且配位反应是逐级进行的,难以确定反应的计量关系,因此很难用于滴定分析。
大多数有机配位剂与金属离子反应能够满足配位滴定的反应要求,因为有机配位剂中含有两个以上的配位原子,在与金属离子配位时,形成环状结构的鳌合物,是配位滴定时常用的配位剂。
其中最常用的是乙二胺四乙酸及其二钠盐,它们都可以简称为EDTA。
因此,配位滴定法又称为EDTA滴定法。
知识链接氨羧配位剂氨羧配位剂是一类以氨基二乙酸为基体的一类有机配位剂的总称。
氨基二乙酸的结构式为N CH2CH2COOHCOOH在它的结构中含有配位能力很强的氨基氮和羧基氧两种配位原子,前者易与Co2+、Ni2+、Zn2+、Cu2+、Hg+等金属离子配位,后者几乎能与所有高价金属离子配位,因此氨羧配位剂兼有两者的配位能力,几乎能与所有金属离子配位。
目前氨羧配位剂有几十种,其中应用最广范的是乙二胺四乙酸。
6.2 乙二胺四乙酸6.2.1 乙二胺四乙酸的结构及性质乙二胺四乙酸的结构式为CH2HOOCCH2 HOOC N CH2CH2NCH2CH2COOHCOOH从结构式可知,乙二氨四乙酸分子中有4个羧基,为四元有机弱酸。
可简写成H4Y,简称为EDTA。
EDTA为白色粉末状结晶,微溶于水,在22℃时的溶解度为0.02 g/100 ml,溶液显弱酸性,pH=2.3。
EDTA虽然难溶于水,但易溶于NaOH或氨性溶液中,生成相应的盐,在实际应用中常用其二钠盐。




无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。


配位化合物的稳定性与解题技巧在化学中,配位化合物是由中心金属离子与周围的配体形成的化合物。
配位化合物的稳定性对于理解化学反应、预测物质性质和解题至关重要。
本文将介绍配位化合物稳定性的概念、影响因素和解题技巧。
一、配位化合物稳定性的概念配位化合物的稳定性指的是该化合物在溶液中的形成常数(Kf值)或在晶体中的溶解度。
稳定性较高的配位化合物具有较大的Kf值和较低的溶解度。
二、影响配位化合物稳定性的因素1. 配体的电荷:配体的电荷与中心金属离子的电荷之间的相互作用是影响配位化合物稳定性的重要因素。
一般来说,正电荷中心金属离子与带有负电荷的配体形成较稳定的化合物,而负电荷中心金属离子与带有正电荷的配体形成较稳定的化合物。
2. 配体的位阻效应:配体中的大体积基团会增加配体与中心金属离子之间的位阻效应,从而减弱它们之间的相互作用,导致配位化合物的稳定性降低。
3. 配体的配位能力:配体的配位能力是指配体与中心金属离子形成配合物的倾向性。
不同的配体具有不同的配位能力,而配位能力较强的配体会形成稳定性较高的配位化合物。
4. 配位化合物结构的杂化程度:配位化合物的杂化程度也会影响其稳定性。
杂化程度较高的配位化合物通常较稳定。
5. 配位化合物的配位数:配位数是指一个中心金属离子周围配体的个数。
一般来说,配位数较高的配位化合物的稳定性越低。
三、解题技巧在学习配位化合物稳定性的时候,以下技巧可以帮助你更好地理解和解题:1. 熟悉常见配位体和它们的配位能力:熟悉常见的配位体并了解它们的配位能力是理解配位化合物稳定性的重要基础。
例如,氨(NH3)和氯化物(Cl-)通常具有较强的配位能力,而水(H2O)和乙二胺(en)具有较弱的配位能力。
2. 理解氧化态和配位数的关系:在解题过程中,理解中心金属离子的氧化态和配位数之间的关系可以帮助你判断配位化合物的稳定性。
一般来说,同一中心金属离子的不同氧化态在形成配位化合物时的稳定性顺序为:高价 > 中价 > 低价。


六氨化钴正二离子稳定常数1.引言1.1 概述六氨化钴正二离子是一种重要的配位化合物,其稳定常数的研究对于了解其在溶液中的行为以及在实际应用中的应用具有重要意义。
六氨化钴正二离子是由一个钴离子和六个氨分子配位而成的配合物,化学式为[Co(NH3)6]2+。
它的化学结构和性质使其在催化反应、药物传递系统等领域具有广泛的应用潜力。
稳定常数是评估配合物在溶液中稳定性的重要指标,它可以定量描述配合物中金属离子与配体之间的结合强度。
具体来说,六氨化钴正二离子的稳定常数表示了其与氨配体之间的结合强度。
稳定常数越大,表示配合物越稳定,在溶液中更难解离。
稳定常数的研究有助于我们了解该配合物的溶解度、稳定性以及在化学反应中的催化作用。
本文旨在对六氨化钴正二离子的稳定常数进行深入研究,并探讨其在不同条件下的变化规律。
通过实验测定和理论分析,我们将尽力揭示六氨化钴正二离子稳定常数与配位结构、溶液条件等因素之间的关系,并为该配合物在催化反应和其他领域的应用提供科学依据。
在接下来的章节中,我们将首先对稳定常数的定义和意义进行详细阐述,以此建立对该指标的基本认识。
随后,我们会介绍六氨化钴正二离子的结构和性质,包括其制备方法、物理化学性质等方面的内容。
最后,我们将对研究结果进行总结,并探讨六氨化钴正二离子稳定常数研究的意义和未来展望。
通过全面分析和综合讨论,我们希望能够为该配合物的应用提供深入的理论依据和实践指导。
1.2 文章结构本文将按照以下结构来介绍关于六氨化钴正二离子稳定常数的研究:第一部分是引言。
在引言中,我们将提供一个概述,介绍六氨化钴正二离子稳定常数的背景和重要性。
此外,我们还将说明文章的结构,以及写作此文的目的。
第二部分是正文。
首先,我们会给出稳定常数的定义和意义。
我们将解释稳定常数在化学研究中的重要性,以及其作用和应用领域。
接下来,我们将详细介绍六氨化钴正二离子的结构和性质。
我们将探讨其分子式、分子结构以及相关的物理和化学性质。
化学配位反应实验报告一、实验目的1、了解配位反应的基本概念和特点。
2、掌握配位反应的实验操作和现象观察。
3、学会通过实验数据计算配位化合物的稳定常数。
二、实验原理配位反应是指中心离子(或原子)与一定数目的配体通过配位键形成配合物的过程。
在配位反应中,中心离子提供空轨道,配体提供孤对电子,二者形成配位键。
常见的配体有氨、水、卤素离子等。
配合物的稳定性可以用稳定常数来表示。
稳定常数越大,配合物越稳定。
本实验通过测定不同浓度下配位反应的平衡浓度,计算出配合物的稳定常数。
三、实验仪器和试剂1、仪器分光光度计容量瓶(50 mL、100 mL)移液管(1 mL、5 mL、10 mL)比色皿玻璃棒烧杯(50 mL、100 mL)2、试剂硫酸铜溶液(01 mol/L)氨水(2 mol/L)氯化铵溶液(1 mol/L)四、实验步骤1、配制溶液配制 01 mol/L 的硫酸铜溶液 100 mL。
配制 2 mol/L 的氨水 50 mL。
配制 1 mol/L 的氯化铵溶液 50 mL。
2、测定吸光度取 5 支 50 mL 容量瓶,分别编号为 1、2、3、4、5。
向 1 号容量瓶中加入 1000 mL 01 mol/L 的硫酸铜溶液,用蒸馏水稀释至刻度,摇匀。
此为标准溶液,测定其在一定波长下的吸光度,作为对照。
向 2 号容量瓶中加入 1000 mL 01 mol/L 的硫酸铜溶液,再加入 500 mL 2 mol/L 的氨水,用蒸馏水稀释至刻度,摇匀。
向 3 号容量瓶中加入 1000 mL 01 mol/L 的硫酸铜溶液,再加入1000 mL 2 mol/L 的氨水,用蒸馏水稀释至刻度,摇匀。
向 4 号容量瓶中加入 1000 mL 01 mol/L 的硫酸铜溶液,再加入1500 mL 2 mol/L 的氨水,用蒸馏水稀释至刻度,摇匀。
向 5 号容量瓶中加入 1000 mL 01 mol/L 的硫酸铜溶液,再加入2000 mL 2 mol/L 的氨水,用蒸馏水稀释至刻度,摇匀。