双倒数作图法测米氏常数
- 格式:doc
- 大小:47.50 KB
- 文档页数:1



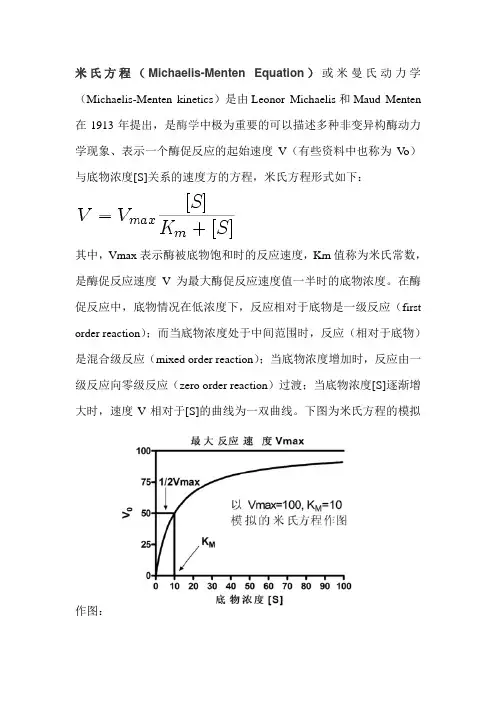
米氏方程(Michaelis-Menten Equation)或米曼氏动力学(Michaelis-Menten kinetics)是由Leonor Michaelis和Maud Menten 在1913年提出,是酶学中极为重要的可以描述多种非变异构酶动力学现象、表示一个酶促反应的起始速度V(有些资料中也称为V o)与底物浓度[S]关系的速度方的方程,米氏方程形式如下:
其中,Vmax表示酶被底物饱和时的反应速度,Km值称为米氏常数,是酶促反应速度V为最大酶促反应速度值一半时的底物浓度。
在酶促反应中,底物情况在低浓度下,反应相对于底物是一级反应(first order reaction);而当底物浓度处于中间范围时,反应(相对于底物)是混合级反应(mixed order reaction);当底物浓度增加时,反应由一级反应向零级反应(zero order reaction)过渡;当底物浓度[S]逐渐增大时,速度V相对于[S]的曲线为一双曲线。
下图为米氏方程的模拟
作图:
酶促反应中的米氏常数的测定和Vmax的测定有多种方法。
比如固定反应中的酶浓度,然后测试几种不同底物浓度下的起始速度,即可获得Km和Vmax值。
但直接从起始速度对底物浓度的图中确定Km 或Vmax值是很困难的,因为曲线接近Vmax时是个渐进过程。
因此,通常情况下,我们都是通过米氏方程的双倒数形式来测定,即Lineweaver-Burk plot,也可称为双倒数方程(double-reciprocal plot):
将1/V 对1/[S]作图,即可得到一条直线,该直线在Y轴的截距即为1/Vmax,在X轴上的截距即为1/Km的绝对值。
示意图如下:。


v = Km + [S ]v :反应初速度(微摩尔浓度变化/min)V :最大反应速度(微摩尔浓度变化/min)[S]:底物浓度(mol/L)Km:米氏常数(mol/L)此方程表明,当已知Km及V时,酶反应速度与底物浓度之间的定量关系。
3.4 双倒数作图法测定Km值:1 Km 1 1v V [S] V1/v对1/[S]作图可得一条曲线,其斜率为Km/Vmax,截距为1/Vmax 。
若将直线延长与横轴相交,则该交点在数值上等于-1/Vmax。
本实验采用最适pH、最适温度下,测定不同浓度时酶活性。
再根据林贝法作图求出Km值。
3.5 纤维素酶水解纤维素产生的纤维二糖、葡萄糖等还原糖能将碱性条件下的3,5-二硝基水杨酸(DNS)还原,生成棕红色的氨基化合物,在540nm波长处有最大光吸收,在一定范围内还原糖的量与反应液的颜色强度呈比例关系,利用比色法测定其3mLDNS反应终止→沸水浴5min →定容至25ml→测定OD540吸光值G 作双倒数图求Km4.3 实验注意事项本实验是一个定量测定方法,为获得准确的实验结果,应尽量减少实验操作中带来的误差。
底物溶液时应用同一母液进行稀释,保证底物浓度的准确性。
严格控制准确的酶促反应时间。
反应温度准确,酶液准确稀释。
不同pH所用酶液用对应pH缓冲液稀释试管上编号:贴上用圆珠笔写上编号的胶布,以防止保温或沸水加热时脱落;移液管使用时量取精准,保证结果可靠准确。
精确记时:每一管加入酶液的时间要做记录,每管之间间隔的时间要合理;避免试管进水:煮沸和用流水冲洗时;由图-1/Km=-7,可得出:Km=0.143 mg/ml(g/L)/(2×104)=0.715×10-5mol/L。
6、分析与讨论:米氏常数(Km)是酶的一个特征性物理量,其大小与酶的性质有关。
Km 值随测定的底物种类、反应的温度、pH 及离子强度而改变。
因此,对某一酶促反应而言,在一定条件下都有特定的Km 值,可用来鉴别酶,例如对于不同来源或相同来源但在不同发育阶段,不同生理状况下催化相同反应的酶是否属于同一种酶[1]。



⽶⽒常数的测定底物浓度对酶促反应速度的影响——⽶⽒常数的测定⼀.⽬的要求1.1了解底物浓度对酶促反应的影响。
1.2掌握测定⽶⽒常数K m 的原理和⽅法。
⼆.实验原理酶促反应速度与底物浓度的关系可⽤⽶⽒⽅程来表⽰:式中:v ——反应初速度(微摩尔浓度变化/min );V ——最⼤反应速度(微摩尔浓度变化/min ); [s]——底物浓度(mol/L ); K m ——⽶⽒常数(mol/L )。
这个⽅程表明当已知K m 及V 时,酶促反应速度与底物浓度之间的定量关系。
K m 值等于酶促反应速度达到最⼤反应速度⼀半时所对应的底物浓度,是酶的特征常数之⼀。
不同的酶,K m 值不同,同⼀种酶与不同底物反应K m 值也不同,K m 值可以近似地反应酶与底物的亲和⼒⼤⼩:K m 值越⼤,表明亲和⼒⼩;K m 值⼩,表明亲和⼒⼤。
则测K m 值是酶学研究的⼀个重要⽅法。
⼤多数纯酶的K m 值在0.01~100mmol/L 。
Linewaeaver-Burk 作图法(双倒数作图法)是⽤实验⽅法测K m 值的最常⽤的简便⽅法:实验时可选择不同的[s],测定对应的v ,以对作图,得到⼀个斜率为V Km的直线,其截距][1s 则为mK 1,由此可求出K m 的值(截距的负倒数)。
本实验以胰蛋⽩酶消化酪蛋⽩为例,采⽤Linewaeaver-Burk 双倒数作图法测定双倒数作图法。
胰蛋⽩酶催化蛋⽩质中碱性氨基酸(L-精氨酸和L-赖氨酸)的羧基所形成的肽键⽔解。
⽔解时有⾃由氨基⽣成,可⽤甲醛滴定法判断⾃由氨基增加的数量⽽跟踪反应,求得初速度。
][][s K s V v m +=V s V K v m 1][1.1+=v 1][1s三.试剂和器材3.1 试剂A.10~30g/L的酪蛋⽩溶液(pH8.5):分别取10、20、25、30g酪蛋⽩溶于约900mL⽔中,加20mL 1mol/L NaOH 连续振荡,微热直⾄溶解,以1mol/L HCl 或1mol/L NaOH调pH⾄8.5,定容1L,即⽣成四种不同[s]的酪蛋⽩标准溶液。


米氏方程与双倒数作图法Lineweaver-Burk plot
米氏方程(Michaelis-Menten Equation)或米曼氏动力学(Michaelis-Menten kinetics)是由Leonor Michaelis和Maud Menten在1913年提出,是酶学中极为重要的可以描述多种非变异构酶动力学现象、表示一个酶促反应的起始速度V (有些资料中也称为Vo)与底物浓度[S]关系的速度方的方程,米氏方程形式如下:
其中,Vmax表示酶被底物饱和时的反应速度,Km值称为米氏常数,是酶促反应速度V为最大酶促反应速度值一半时的底物浓度。
在酶促反应中,底物情况在低浓度下,反应相对于底物是一级反应(first order reaction);而当底物浓度处于中间范围时,反应(相对于底物)是混合级反应(mixed order reaction);当底物浓度增加时,反应由一级反应向零级反应(zero order reaction)过渡;当底物浓度[S]逐渐增大时,速度V相对于[S]的曲线为一双曲线。
下图为米氏方程的模拟作图:
酶促反应中的米氏常数的测定和Vmax的测定有多种方法。
比如固定反应中的酶浓度,然后测试几种不同底物浓度下的起始速度,即可获得Km和Vmax值。
但直接从起始速度对底物浓度的图中确定Km或Vmax值是很困难的,因为曲线接近Vmax时是个渐进过程。
因此,通常情况下,我们都是通过米氏方程的双倒数形式来测定,即Lineweaver-Burk plot,也可称为双倒数方程(double-reciprocal plot):
将1/V 对1/[S]作图,即可得到一条直线,该直线在Y轴的截距即为1/Vmax,在X轴上的截距即为1/Km的绝对值。
示意图如下:。
米氏常数的意义 ★★★当酶促反应处于ν=1/2 V max 时,可从米一曼氏方程式得到K m =[S ]。
由此可知,K m 值是酶促反应速度为最大速度一半时的底物浓度。
它的单位与底物浓度一样,是摩尔/升(mol/L )。
米氏常数是酶学研究中一个极重要的数据,其意义如下: 1. 反映酶的种类K m 值对某一特定酶来说是个常数。
【见一些酶的K m 值】可以利用酶的K m 值比较来源于同一器官不同组织,或同一组织不同发育期的具有同样作用的酶,来判断这些酶是完全相同的酶,或是催化同一反应的一类酶。
2. 反映酶与底物的亲和力从酶被底物饱和的现象出发,按照中间产物假说的设想,酶促反应如下:K m 值等于当K -1≥K +2,即ES 解离成E 和S 的速度超过分解成E 和P 的速度时,K +2可以忽略下计,此时K m 值近似于ES 的解离常数K s (底物常数),在这种情况下,K m 值可用来表示酶与底物的亲和力。
K m 值越大,酶与底物亲和力越小;K m 值越小,酶与底物亲和力越大。
K m 值越大,酶与底物亲和力越小;K m 值越小,酶与底物亲和力越大。
一个酶如有几种底物就有几个K m 值。
其中K m 值最小, V max /K m 值最大者是对酶亲和力最大的底物,一般称为天然底物或最适底物。
K m 值随不同底物而异的现象,可以帮助判断酶的专一性,有助于研究酶的活性部位。
【推导过程】3. 计算底物浓度和相对速度可由所要求的反应速度(应到达V max 的百分比),求出应当加入底物的合理浓度;反之,也可以根据已知底物浓度,求出该条件下的反应速度。
【举例说明】 4. 反应激活剂或抑制剂的存在酶不仅与底物结合,也可与其他配体结合(如激活剂、抑制剂)而影响K m 值。
因此,如果发现某种酶在体外测定的K m 值与体内差别较大,可以预料体内可能存在着天然激活剂降低了K m 值或抑制剂提高了K m 值。
同时也可用不同物质对K m 值的影响,识别生理上有重要意义的调节物。