米氏常数测定(精)
- 格式:ppt
- 大小:314.50 KB
- 文档页数:12

米氏常数实验报告米氏常数实验报告引言:米氏常数是物理学中的一个重要常数,它描述了光在真空中的传播速度。
在本次实验中,我们将通过测量光的传播时间和光程差来确定米氏常数的数值。
通过这个实验,我们将更深入地了解光的性质和光在空间中的传播规律。
实验目的:本实验的目的是通过测量光的传播时间和光程差来确定米氏常数的数值,并验证光在真空中的传播速度是否恒定。
实验器材:本实验所需的器材包括:激光器、分光镜、反射镜、光电探测器、计时器等。
实验步骤:1. 首先,我们将激光器置于实验室的一端,并将其打开。
确保激光器产生的光束是稳定的。
2. 接下来,我们将分光镜放置在激光器的光路中,并调整其角度,使得光束被分光镜分为两束相等的光束。
3. 将两束光束分别引导至反射镜,并使其分别反射回来。
4. 在光束返回的路径上,我们将安装光电探测器,并将其与计时器相连。
5. 开始实验时,我们同时启动激光器和计时器,并记录下光束从激光器发出到光电探测器接收到的时间。
6. 重复实验多次,取平均值作为最终的测量结果。
实验结果:通过多次实验测量,我们得到了光的传播时间和光程差的数据。
根据这些数据,我们可以计算出米氏常数的数值。
讨论与分析:在本次实验中,我们得到了光的传播时间和光程差的数据,进而计算出了米氏常数的数值。
通过比较实验结果与已知的米氏常数数值,我们可以验证光在真空中的传播速度是否恒定。
此外,本实验还可以用于研究光在不同介质中的传播速度。
通过将光束传播到不同介质中,我们可以测量光的传播时间和光程差,并计算出不同介质中的米氏常数。
这有助于我们更深入地了解光在不同介质中的传播规律。
结论:通过本次实验,我们成功地测量了光的传播时间和光程差,并计算出了米氏常数的数值。
实验结果与已知的米氏常数数值相符,验证了光在真空中的传播速度是恒定的。
此外,本实验还为研究光在不同介质中的传播速度提供了一种方法。
总结:米氏常数实验是一项重要的实验,通过测量光的传播时间和光程差,我们可以确定光在真空中的传播速度。
酵母蔗糖酶米氏常数的测定[原理]当环境的温度、pH 和酶浓度等条件恒定时,酶促反应的初速度V 随底物的浓度[S]增高而加快,直至达到一极限,即最大反应速度Vmax 。
根据底物浓度和反应速度的这种关系,Michaelis-Menten 推导得出如下公式:式中Km 为米氏常数。
它是酶的特征性常数。
测定Km 是研究酶的一项重要工作。
大多数酶Km 在10-3~10-5mol/L 左右。
但是Michaelis-Menten 方程中反应速度V 与底物浓度[S]之间为双曲线关系,通过作图求Km 值极不方便。
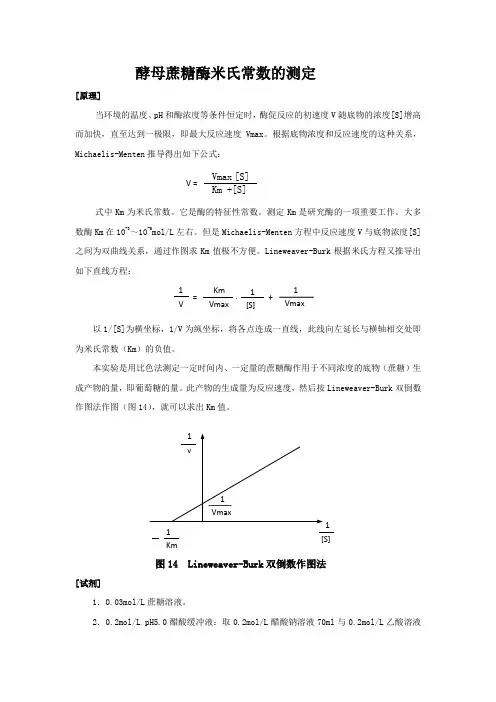
Lineweaver-Burk 根据米氏方程又推导出如下直线方程:以1/[S]为横坐标,1/V 为纵坐标,将各点连成一直线,此线向左延长与横轴相交处即为米氏常数(Km )的负值。
本实验是用比色法测定一定时间内、一定量的蔗糖酶作用于不同浓度的底物(蔗糖)生成产物的量,即葡萄糖的量。
此产物的生成量为反应速度,然后按Lineweaver-Burk 双倒数作图法作图(图14),就可以求出Km 值。
图14 Lineweaver-Burk 双倒数作图法[试剂]1.0.03mol/L 蔗糖溶液。
2.0.2mol/L pH5.0醋酸缓冲液:取0.2mol/L 醋酸钠溶液70ml 与0.2mol/L 乙酸溶液V =Vmax [S] Km +[S]1 V = · 1 Vmax 1 [S] + Km Vmax1 [S] 1 Km30ml相混合。
3.蔗糖酶溶液:干酵母2.5g置研钵中,加蒸馏水4ml,用力研磨10分钟,转移到离心管中,用25ml蒸馏水洗研钵,并将洗涤液一起转移到离心管中,摇匀,静置50分钟,离心(2000r/min 5min),小心取出上清夜备用。
置冰箱保存。
实验时根据需要用蒸馏水适当稀释。
(约25倍稀释)4.碱性硫酸铜溶液:取无水Na2CO340g溶于400ml蒸馏水中;酒石酸7.5g溶于350ml 蒸馏水中;结晶硫酸铜(CuSO4·5H2O)4.5g溶于200ml蒸馏水中,以上分别加热促溶。

一、实验目的1. 理解并掌握米氏常数(Km)及其与最大反应速度(Vmax)的关系。
2. 通过实验测定酶的米氏常数,了解酶与底物之间的亲和力。
3. 学习并掌握酶促反应动力学的基本原理和实验方法。
二、实验原理米氏常数(Km)是酶的特征性常数,表示酶与底物结合的亲和力。
在一定的实验条件下,酶促反应的初速度(v)与底物浓度([S])之间的关系可用米氏方程表示:\[ v = \frac{V_{max} [S]}{Km + [S]} \]当底物浓度很低时,酶促反应速度与底物浓度成正比,随着底物浓度的增加,反应速度逐渐加快,但增速逐渐减慢。
当底物浓度增加到一定程度时,反应速度达到最大值(Vmax),此时酶已全部被底物饱和。
本实验采用分光光度法测定酶的米氏常数。
实验中,通过改变底物浓度,测定不同浓度下酶促反应的初速度,根据米氏方程绘制v/[S]对1/[S]的曲线,通过线性回归分析求出曲线的斜率和截距,进而计算出Km和Vmax。
三、实验材料与仪器材料:1. 酶制剂(如蔗糖酶、淀粉酶等)2. 底物溶液(如葡萄糖溶液、淀粉溶液等)3. 碳酸盐缓冲液4. 4-氨基安替比林5. 铁氰化钾6. 0.1 mol/L NaOH溶液7. 葡萄糖标准溶液仪器:1. 分光光度计2. 移液管3. 移液器4. 恒温水浴5. 试管6. 比色皿四、实验步骤1. 制备酶溶液:将酶制剂溶解于适量的碳酸盐缓冲液中,调节pH值至最适值,稀释至一定浓度。
2. 制备底物溶液:将底物溶液稀释至不同浓度,备用。
3. 测定酶促反应初速度:a. 将不同浓度的底物溶液分别加入试管中,加入适量的酶溶液。
b. 将试管放入恒温水浴中保温一段时间。
c. 取出试管,立即加入适量的4-氨基安替比林和铁氰化钾,充分混匀。
d. 在分光光度计上测定溶液的吸光度,记录数据。
4. 数据处理:a. 以底物浓度[S]为横坐标,酶促反应速度v为纵坐标,绘制v/[S]对1/[S]的曲线。
b. 对曲线进行线性回归分析,求出曲线的斜率和截距。
碱性磷酸酶米氏常数测定P60【实验原理】在环境的温度、pH和酶的浓度一定时,酶促反应速度与底物浓度之间的关系表现在反应开始时,酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。
若继续增加底物浓度,反应速度的增加率将减少。
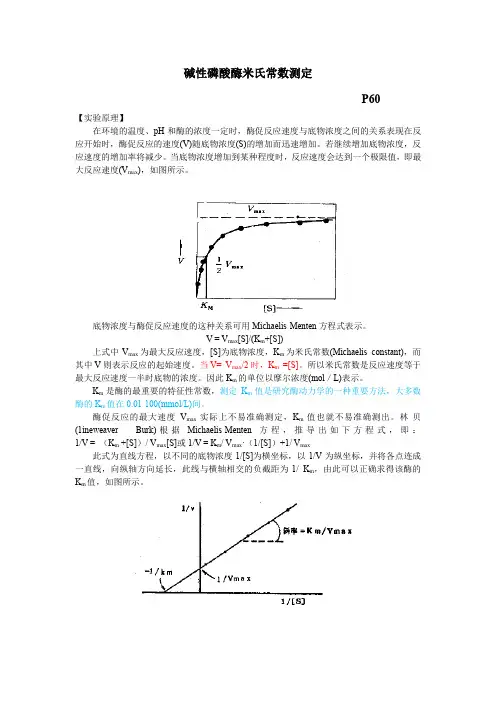
当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(V max),如图所示。
底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。
V = V max[S]/(K m+[S])上式中V max为最大反应速度,[S]为底物浓度,K m为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。
当V= V max/2时,K m=[S]。
所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。
因此K m的单位以摩尔浓度(mol/L)表示。
K m是酶的最重要的特征性常数,测定K m值是研究酶动力学的一种重要方法,大多数酶的K m值在0.01-100(mmol/L)间。
酶促反应的最大速度V max实际上不易准确测定,K m值也就不易准确测出。
林-贝(1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即:1/V = (K m +[S])/ V max[S]或1/V = K m/ V max·(1/[S])+1/ V max此式为直线方程,以不同的底物浓度1/[S]为横坐标,以1/V为纵坐标,并将各点连成一直线,向纵轴方向延长,此线与横轴相交的负截距为-1/ K m,由此可以正确求得该酶的K m值,如图所示。
本实验以碱性磷酸酶为例,测定不同底物浓度的酶活性,再根据Lineweaver-Burk法作图,计算其K m值。
可以作为碱性磷酸酶底物的物质很多,底物反应的酶对于不同的底物有不同的K m值。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。
酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。




【米氏常数】米氏常数测定实验报告.docx【米氏常数】米氏常数测定实验报告此人姓米,单名兰,却没有米兰那种碧绿盎然,幽香沁人的素雅。
她的身高同十几年前参军时,相差无几—1.55米。
3号军装穿在身上,仍旧如长袍加身,宽大得令人忍俊不禁。
第一个对米兰发表看法的,是化验科的金云。
金云姑娘,确如行于天穹的云霞,轻盈高挑的身材,朗若明月的脸庞,使她这只“鹤”,高立于我们这所医院的所有兵姑娘之中。
姑娘对自己的美都是敏感的,“大兵”也不例外。
更何况金云的仰慕者不计其数。
不知何故,却一概吃了闭门羹,落得个没趣。
这个金云啊,美丽使她的嘴变得尖酸起来。
于是乎,米兰也逃不出她那双带着讥讽的笑盈盈的大眼睛。
从医校毕业分到化验科的第2周,金云在医学论文宣读会上,见到了比讲台高不了多少的米兰。
“米兰?嘻嘻!”她一眨黑白分明的眸子,咬着身边另一位护士的耳朵,“米氏常数。
嗯?”“米氏常数?”“酶的底物浓度取决于米氏常数。
它在同等条件下是恒定的。
你瞧,她多恒定,永远只比讲台高半尺。
咯咯!”周围的姑娘们八成听见了。
否则,各种无法揣测的眼神,为什么都聚向站在讲台后面,涨红了脸的米兰?金云矜持地向周围扫了一眼,她为自己的想象力而暗暗自得。
这位以全优成绩毕业的姑娘,连头发梢都是高傲的。
“……是个沉痛的教训。
”米兰颤动着嘴角,向幻灯投影机插进一张照片。
金云低呼了一声,礼堂里那些抄录笔记的大夫们,也交头接耳起来—幕布上一张奇丑无比的脸。
严重烧伤使患者分不清男女,辨不全五官。
变形的脸上爬满了蚯蚓似的斑痕。
又是一张照片,仍旧是一张奇丑的脸。
“手术没有获得预期效果。
主要教训是……”金云无心去关心那位没有恢复容貌的患者,也不再留神米兰那些专科术语了。
她痴呆呆地盯住米兰—“真是太一般啦!”五官似乎是符合解剖位置,但安在米兰宽大的脸庞上,总那么别扭。
又黑又硬的头发从无沿帽下“炸”开来,象一道狭窄的帽檐。
金云下意识地拂拂自己额前那蓬微微弯曲、浓密地偏向一侧的刘海。

酶的米氏常数测定实验报告
酶的米氏常数是衡量酶与底物结合能力的指标之一。
下面是米氏
常数测定实验的报告:
实验目的:
通过测定酶的反应速率,确定酶的米氏常数。
实验原理:
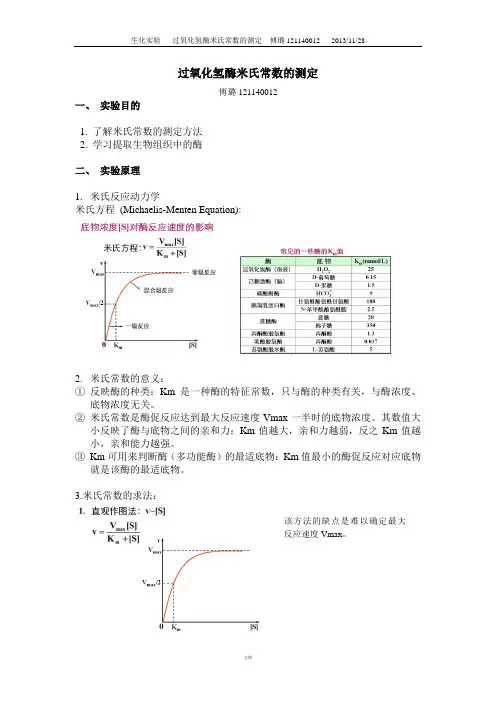
酶促反应遵循米氏-明可夫斯基动力学(Michaelis-Menten kinetics)的规律,即将底物浓度作为独立变量,反应速率作为因变量,建立数
学模型。
该模型表达式为:
V0=Vmax×[S]÷(Km+[S])
其中,V0为反应速率,Vmax为最大反应速率,[S]为底物浓度,Km为
米氏常数。
实验步骤:
1.准备100mmol/L的底物溶液和酶液
2.取不同浓度的底物溶液,加入相同量的酶液,并在恒温水浴中反应
一定时间
3.反应结束后,停止反应,加入酶抑制剂终止反应
4.用滤纸过滤液体,取滤液用于分光光度计测定吸光度
5.将吸光度转换为底物浓度,并绘制底物浓度-V0曲线
6.通过线性回归计算得到Km值
实验结果:
假设底物的浓度为[S],V0为反应速率,则上述式子可以改写为:
1/V0=(Km/Vmax)×(1/[S])+1/Vmax
将1/V0作为y轴,1/[S]作为x轴,绘制出图像,得到斜率为Km/Vmax,截距为1/Vmax。
通过线性回归计算得到Km为10mmol/L,Vmax为5μmol/L·min。
实验结论:
通过实验测定,得到该酶的米氏常数为10mmol/L,最大反应速率为
5μmol/L·min。
这表明该酶与底物的结合能力相对较强,但反应速率并不是特别快。

酶活米氏常数实验一、实验前准备1、24孔板洗净烘干,准备足够枪头。
2、准备催化剂,在光下呈透明状为分散性较好,否则用超声清洗器(位于化学间)超声分散5min,期间准备底物(如TMB或者ABTS),浓度依照自己实验的要求定(10mg/mL 或5mg/mL),一般1mL足够用,可在1.5mL离心管中溶解。
TMB(外间冰箱上层)溶于DMSO(二甲亚砜,位于化学间王春雨的柜子里),ABTS(与TMB放在一起)溶于二次水。
3、将缓冲液、催化剂、底物、H2O2、200µL和10µL移液枪、50µL排枪(位于称量处上方模拟酶专用枪的柜中)、96孔板、24孔板、卷纸一起放入纸盒中,放到对面酶标仪前,开空调定室温(25℃,提醒其他人随手关门),24孔板中其中一排加入适量H2O2(每孔1mL 左右,注意避光,可在板上盖一张卷纸),将缓冲液、催化剂、底物放实验台上,静置0.5-1h。
4、记录本上提前写好实验的加样顺序:催化底物TMB(或ABTS)的酶促动力学过程加样顺序:①200µL缓冲液②10µL催化剂③底物TMB(ABTS)(0,0.5,1,2,4,6,8,10µL) ④32µLH2O2(排枪加)催化底物H2O2的酶促动力学过程加样顺序:①200µL缓冲液②10µL催化剂③H2O2(2,4,6,8,10,16,32,64µL)④10µL底物TMB(ABTS)(排枪加)数据记录按下表记,Code为每次读板时的微孔板编号,Time为对应的读板时的时间,一般30s读板一次,可根据反应的快慢来确定读板的时间。
Code 1 2 3 4 5 6 7TimeTMB 0 0.5 1 2 4 6 8 10V01Code 1 2 3 4 5 6 7TimeH2O2 2 4 6 8 10 16 32 64V01二、实验1、打开酶标仪(开关在仪器后部,若仪器没反应,请检查电源是否接通),密码为5个0,按Enter键进入系统。
过氧化氢酶米氏常数的测定实验报告1. 实验目的与背景哎呀,大家好!今天咱们来聊聊一个挺有趣的实验——过氧化氢酶的米氏常数测定。
别被这个名字吓到了,其实就是在研究一种酶的“工作效率”而已。
想象一下过氧化氢(H₂O₂)就像是个小小的坏蛋,它可不是什么好东西;而过氧化氢酶呢,就是那个专门来捉拿坏蛋的超级英雄。
这种酶存在于咱们的细胞里,帮忙把过氧化氢分解成水和氧气,保护我们的身体不被这些“坏蛋”害了。
米氏常数(Km)这东西呢,简单来说就是衡量酶对底物亲和力的一个参数。
如果Km值小,说明酶对底物的“喜欢”程度高,咱们的超级英雄很厉害;反之则说明这个超级英雄对底物的“兴趣”不大。
通过测定这个值,我们可以更好地理解这位超级英雄的“战斗力”,也能对相关的生物化学反应有个更清晰的认识。
2. 实验原理与方法2.1 实验原理好的,接下来咱们进入正题——实验原理。
首先,得了解酶催化的基本过程。
简单来说,酶会跟底物结合,形成一个“酶底物复合物”,然后催化底物转变为产物。
在这个过程中,酶的催化速率会受到底物浓度的影响。
米氏常数就是用来描述这种关系的一个参数。
咱们用的是过氧化氢酶,它催化的反应是这样的:2 H₂O₂ → 2 H₂O + O₂。
底物过氧化氢在反应过程中会被转化成水和氧气。
通过测定不同底物浓度下反应速率的变化,可以绘制出反应速率与底物浓度的关系图,从中找出米氏常数Km。
2.2 实验步骤接下来,就轮到实验步骤了。
首先,准备好过氧化氢酶和不同浓度的过氧化氢溶液。
每一种底物浓度都要做几个重复实验,以确保数据的可靠性。
接着,将过氧化氢酶加入到每种浓度的过氧化氢溶液中,开始反应。
然后,定期取样,测定反应产物的浓度。
这时,咱们就要用上光谱仪之类的仪器来检测氧气的产生情况,这可是个大工程,得小心翼翼地操作,别弄得一团糟。
3. 实验结果与讨论3.1 实验数据分析一切准备妥当,实验终于开始啦!拿到数据后,我们就可以用“米氏方程”来分析实验结果了。
米氏常数实验报告米氏常数实验报告引言:米氏常数是物理学中一个重要的常数,它与电磁学和光学等领域有着密切的关系。
本实验旨在通过测量光的速度和电磁学参数,来确定米氏常数的数值。
通过实验数据的分析,我们可以更深入地了解光的本质以及电磁学的基本原理。
实验装置和原理:本实验采用了米氏干涉仪作为主要的测量装置。
该装置由一个光源、一对半透半反镜、一对全反射镜和一个干涉屏组成。
光源发出的光经过半透半反镜分为两束,分别经过全反射镜反射后再次汇聚在干涉屏上。
当两束光的光程差为整数倍波长时,会产生明暗相间的干涉条纹。
实验步骤:1. 调整光源位置,使得光线垂直射向半透半反镜。
2. 调整半透半反镜的角度,使得两束光线平行并沿着同一轴线。
3. 调整全反射镜的位置和角度,使得两束光线再次汇聚在干涉屏上。
4. 观察干涉屏上的干涉条纹,并记录下明暗相间的条纹数量。
5. 改变光源的角度或者改变全反射镜的位置,再次观察干涉条纹的变化,并记录下明暗相间的条纹数量。
数据处理和分析:根据实验记录的明暗相间的条纹数量,我们可以计算出光的波长。
根据米氏常数的定义,我们可以将光的波长和电磁学参数联系起来,从而计算出米氏常数的数值。
结论:通过本实验,我们成功测量出光的波长,并通过计算得到了米氏常数的数值。
这个数值对于电磁学和光学的研究具有重要的意义。
通过进一步的实验和研究,我们可以更加深入地理解光的本质和电磁学的基本原理。
实验的局限性和改进方向:本实验中,我们假设光的传播速度是恒定的,并且忽略了其他可能影响实验结果的因素。
然而,在实际情况中,光的传播速度可能会受到介质的影响,因此需要进一步的研究和实验来探究这些因素。
此外,本实验中使用的仪器和装置也可能存在一定的误差,可以通过改进实验装置和提高测量精度来减小误差。
总结:米氏常数实验是一项重要的实验,通过测量光的速度和电磁学参数,可以确定米氏常数的数值。
本实验的结果对于电磁学和光学的研究具有重要的意义。
过氧化氢酶米氏常数的测定一、实验目的了解并掌握米氏常数的意义和测定方法二、实验原理H2O2被过氧化氢酶分解出H2O和O2,未分解的H2O2用KMnO4在酸性环境中滴定,根据反应前后H2O2的浓度差可求出反应速度。
2H2O2 = 2H2O + O22KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O本实验由马铃薯提供过氧化氢酶。
在保持恒定的条件下,用相同浓度的过氧化氢酶催化不同浓度的H2O2分解。
在一定限度内,酶促反应速度与H2O2浓度成正比。
用双倒数作图法(即以1/v对1/[S]作图)可求得过氧化氢酶的Km值。
三、实验器材锥形瓶(6个) 吸管、酸式滴定管四、实验试剂1、0.02mol/L 磷酸缓冲液(pH=7)2、0.004 mol/L KMnO4(需标定)3、0.05 mol/L H2O2(需标定)4、25% H2SO4五、实验操作1、酶液的提取:称取马铃薯(去皮)5克,加0.02mol/L 磷酸缓冲液10mL,再加少量海砂,研磨成匀浆,离心(3000r/ min,10min),上清液即为酶液。
2、滴定:取干燥锥形瓶6只,按下表顺序加入试剂:先加好0.05mol/L H2O2及蒸馏水,加酶液后立即混合,依次记录各瓶的起始反应时间。
各瓶时间达5min时立即加2.0mL 25% H2SO4终止反应,充分混匀。
用0.004 mol/L KMnO4滴定各瓶中剩余的H2O2至微红色,记录消耗的KMnO4体积。
六、实验计算分别求出1─5瓶的底物浓度[S]和相应的反应速度v。
C1V110[S] =5 ∕2C2V2C1V1–v =式中 [S]:为底物物质的量浓度(mol/L)C1:为H2O2物质的的量浓度(mol/L)V1:为H2O2的体积(mL)10:反应的总体积v:反应速度(mmol/min)C2: KMnO4物质的量浓度(mol/L)V2:KMnO4的体积(mL)以1/v对1/[S]作图求出Km。