米氏常数的测定
- 格式:wps
- 大小:166.50 KB
- 文档页数:6


双倒数法测定过氧化物酶的米氏常数学院/专业/班级____________________________________________ 姓名_______________ 合作者___________________________________________________ 教师评定___________【实验目的】以过氧化物酶为例,掌握测定酶促反应初速率和米氏常数的原理及方法【实验原理】1913年,Michaelis 和Menten 运用酶反应过程中形成中间络合物的原理,首先提出了底物浓度和酶促反应速率的关系式,即著名的米氏方程:[][]S K S V v m max +⋅= 式中:v 为反应初速率(微摩尔浓度变化/min );V max 为最大反应速率(微摩尔浓度变化/min );[S ]为底物浓度(mol/L );K m 为米氏常数(mol/L )。
这个方程式表明当已知K m 及V max 时,酶反应速率与底物浓度之间的定量关系。
K m 值等于酶促反应速率达到最大反应速率一半时所对应的底物浓度,是酶的特征常数之一。
不同酶的K m 值不同,同一种酶与不同底物反应K m 值也不同,K m 值可以近似的反应酶与底物的亲和力大小:K m 越大表明亲和力越小;K m 越小表明亲和力越大。
大多数纯酶的K m 值在0.01~100 mmol/L 。
通过米氏方程的不同变形,可有多种求算米氏常数的方法,一般较常用的双倒数法,即取米氏方程的倒数式:[]max max m V 1S 1V K v 1+⋅=以v 1对[]S 1作图得一直线,该直线与横轴截距[]m K 1S 1=-。
过氧化物酶是一种对氢受体(H 2O 2) 底物有特异性,对氢供体底物缺乏特异性的酶,它可催化过氧化氢氧化许多多元酚或多元胺类底物发生显色、荧光或化学发光反应,可用于微量过氧化氢含量测定,也可以和其它酶反应系统偶联可用于测定许多与生命相关的物质:如葡萄糖、半乳糖、氨基酸、尿酸及胆甾醇等,亦是免疫分子和核酸分析中常用的标记物。

【米氏常数】米氏常数测定实验的报告.docx米氏常数是一个经验参数,它是用于测量基质和溶质之间相互作用的重要参数。
米氏常数的测定涉及到溶质和基质的相互作用,主要是通过溶解度进行测定。
下面就是本实验的报告。
实验背景米氏常数是用来描述溶质在溶液中浓度度量的非线性关系的参数。
米氏方程如下:Ksp = [A+]^m [B-]^n其中Ksp是溶解度积常数,[A+]和[B-]分别表示电离度为1的正离子和负离子的浓度,m和n分别为正离子和负离子在配位物中的摩尔数。
溶解度积(或离解平衡常数)是可以直接从溶解度数据中获得的参数,这些参数是根据溶解度测量推导出来的,通常采用天平法或者滴定法进行测量。
实验目的本实验的目的是测定铅酸盐的米氏常数,用溶解度法测定铅酸盐的溶度积常数,并根据米氏方程计算米氏常数。
实验原理铅酸盐在水溶液中的离解方程式:PbSO4(s) ⇆ Pb2+(aq) + SO42-(aq)溶解度积常数是根据溶解度求出的:对于低溶度度超取6.5,我们软件系统一压根对孔直接忽略其离子反应方程中的y。
实验流程1. 准备1 L的稀铅酸溶液(2 × 10-5 mol/L)2. 取0.2 mL的稀铅酸热解,目测重量大概是0.03 g左右。
3. 将稀铅酸加入100 mL的无铅纯水溶液中,然后调整pH值,使稀铅酸与水达到最大的平衡浓度。
4. 记录溶解度数值,并计算铅酸盐的溶解度积常数。
实验结果1. 初始重量为0.03 g的铅酸盐溶解后,其溶解度为5.5 × 10-5 mol/L。
2. 根据铅酸盐的溶解度计算溶解度积常数Ksp为3.025 × 10-9。
3. 根据米氏方程Ksp = [Pb2+][SO42-],计算出米氏常数为1.79。

一、实验目的1. 理解并掌握米氏常数(Km)及其与最大反应速度(Vmax)的关系。
2. 通过实验测定酶的米氏常数,了解酶与底物之间的亲和力。
3. 学习并掌握酶促反应动力学的基本原理和实验方法。
二、实验原理米氏常数(Km)是酶的特征性常数,表示酶与底物结合的亲和力。
在一定的实验条件下,酶促反应的初速度(v)与底物浓度([S])之间的关系可用米氏方程表示:\[ v = \frac{V_{max} [S]}{Km + [S]} \]当底物浓度很低时,酶促反应速度与底物浓度成正比,随着底物浓度的增加,反应速度逐渐加快,但增速逐渐减慢。
当底物浓度增加到一定程度时,反应速度达到最大值(Vmax),此时酶已全部被底物饱和。
本实验采用分光光度法测定酶的米氏常数。
实验中,通过改变底物浓度,测定不同浓度下酶促反应的初速度,根据米氏方程绘制v/[S]对1/[S]的曲线,通过线性回归分析求出曲线的斜率和截距,进而计算出Km和Vmax。
三、实验材料与仪器材料:1. 酶制剂(如蔗糖酶、淀粉酶等)2. 底物溶液(如葡萄糖溶液、淀粉溶液等)3. 碳酸盐缓冲液4. 4-氨基安替比林5. 铁氰化钾6. 0.1 mol/L NaOH溶液7. 葡萄糖标准溶液仪器:1. 分光光度计2. 移液管3. 移液器4. 恒温水浴5. 试管6. 比色皿四、实验步骤1. 制备酶溶液:将酶制剂溶解于适量的碳酸盐缓冲液中,调节pH值至最适值,稀释至一定浓度。
2. 制备底物溶液:将底物溶液稀释至不同浓度,备用。
3. 测定酶促反应初速度:a. 将不同浓度的底物溶液分别加入试管中,加入适量的酶溶液。
b. 将试管放入恒温水浴中保温一段时间。
c. 取出试管,立即加入适量的4-氨基安替比林和铁氰化钾,充分混匀。
d. 在分光光度计上测定溶液的吸光度,记录数据。
4. 数据处理:a. 以底物浓度[S]为横坐标,酶促反应速度v为纵坐标,绘制v/[S]对1/[S]的曲线。
b. 对曲线进行线性回归分析,求出曲线的斜率和截距。





酶的米氏常数测定实验报告
酶的米氏常数是衡量酶与底物结合能力的指标之一。
下面是米氏
常数测定实验的报告:
实验目的:
通过测定酶的反应速率,确定酶的米氏常数。
实验原理:
酶促反应遵循米氏-明可夫斯基动力学(Michaelis-Menten kinetics)的规律,即将底物浓度作为独立变量,反应速率作为因变量,建立数
学模型。
该模型表达式为:
V0=Vmax×[S]÷(Km+[S])
其中,V0为反应速率,Vmax为最大反应速率,[S]为底物浓度,Km为
米氏常数。
实验步骤:
1.准备100mmol/L的底物溶液和酶液
2.取不同浓度的底物溶液,加入相同量的酶液,并在恒温水浴中反应
一定时间
3.反应结束后,停止反应,加入酶抑制剂终止反应
4.用滤纸过滤液体,取滤液用于分光光度计测定吸光度
5.将吸光度转换为底物浓度,并绘制底物浓度-V0曲线
6.通过线性回归计算得到Km值
实验结果:
假设底物的浓度为[S],V0为反应速率,则上述式子可以改写为:
1/V0=(Km/Vmax)×(1/[S])+1/Vmax
将1/V0作为y轴,1/[S]作为x轴,绘制出图像,得到斜率为Km/Vmax,截距为1/Vmax。
通过线性回归计算得到Km为10mmol/L,Vmax为5μmol/L·min。
实验结论:
通过实验测定,得到该酶的米氏常数为10mmol/L,最大反应速率为
5μmol/L·min。
这表明该酶与底物的结合能力相对较强,但反应速率并不是特别快。

酶活米氏常数实验一、实验前准备1、24孔板洗净烘干,准备足够枪头。
2、准备催化剂,在光下呈透明状为分散性较好,否则用超声清洗器(位于化学间)超声分散5min,期间准备底物(如TMB或者ABTS),浓度依照自己实验的要求定(10mg/mL 或5mg/mL),一般1mL足够用,可在1.5mL离心管中溶解。
TMB(外间冰箱上层)溶于DMSO(二甲亚砜,位于化学间王春雨的柜子里),ABTS(与TMB放在一起)溶于二次水。
3、将缓冲液、催化剂、底物、H2O2、200µL和10µL移液枪、50µL排枪(位于称量处上方模拟酶专用枪的柜中)、96孔板、24孔板、卷纸一起放入纸盒中,放到对面酶标仪前,开空调定室温(25℃,提醒其他人随手关门),24孔板中其中一排加入适量H2O2(每孔1mL 左右,注意避光,可在板上盖一张卷纸),将缓冲液、催化剂、底物放实验台上,静置0.5-1h。
4、记录本上提前写好实验的加样顺序:催化底物TMB(或ABTS)的酶促动力学过程加样顺序:①200µL缓冲液②10µL催化剂③底物TMB(ABTS)(0,0.5,1,2,4,6,8,10µL) ④32µLH2O2(排枪加)催化底物H2O2的酶促动力学过程加样顺序:①200µL缓冲液②10µL催化剂③H2O2(2,4,6,8,10,16,32,64µL)④10µL底物TMB(ABTS)(排枪加)数据记录按下表记,Code为每次读板时的微孔板编号,Time为对应的读板时的时间,一般30s读板一次,可根据反应的快慢来确定读板的时间。
Code 1 2 3 4 5 6 7TimeTMB 0 0.5 1 2 4 6 8 10V01Code 1 2 3 4 5 6 7TimeH2O2 2 4 6 8 10 16 32 64V01二、实验1、打开酶标仪(开关在仪器后部,若仪器没反应,请检查电源是否接通),密码为5个0,按Enter键进入系统。
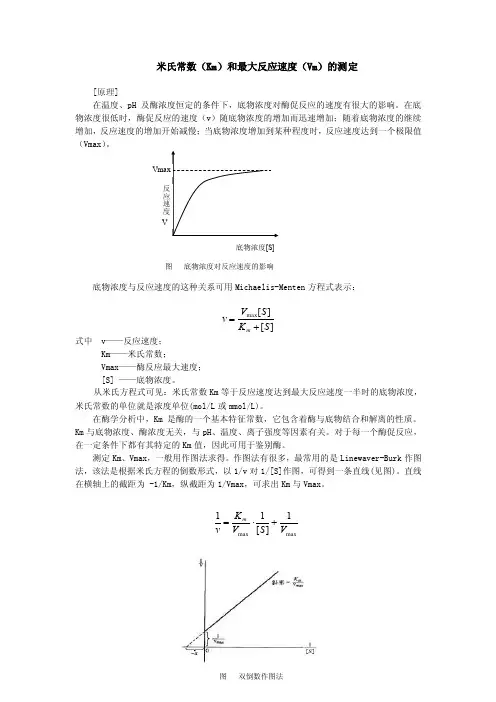
米氏常数(Km )和最大反应速度(Vm )的测定[原理]在温度、pH 及酶浓度恒定的条件下,底物浓度对酶促反应的速度有很大的影响。
在底物浓度很低时,酶促反应的速度(v )随底物浓度的增加而迅速增加;随着底物浓度的继续增加,反应速度的增加开始减慢;当底物浓度增加到某种程度时,反应速度达到一个极限值(Vmax )。
底物浓度与反应速度的这种关系可用Michaelis-Menten 方程式表示:][][max S K S V v m +=式中 v ——反应速度;Km ——米氏常数;Vmax ——酶反应最大速度; [S] ——底物浓度。
从米氏方程式可见:米氏常数Km 等于反应速度达到最大反应速度一半时的底物浓度,米氏常数的单位就是浓度单位(mol/L 或mmol/L)。
在酶学分析中,Km 是酶的一个基本特征常数,它包含着酶与底物结合和解离的性质。
Km 与底物浓度、酶浓度无关,与pH 、温度、离子强度等因素有关。
对于每一个酶促反应,在一定条件下都有其特定的Km 值,因此可用于鉴别酶。
测定Km 、Vmax ,一般用作图法求得。
作图法有很多,最常用的是Linewaver-Burk 作图法,该法是根据米氏方程的倒数形式,以1/v 对1/[S]作图,可得到一条直线(见图)。
直线在横轴上的截距为 -1/Km ,纵截距为1/Vmax ,可求出Km 与Vmax 。
maxmax 1][11V S V K v m +⋅=底物浓度[S]图 底物浓度对反应速度的影响图 双倒数作图法抑制剂影响酶促反应的因素之一,根据抑制剂与酶结合的特点可分为不可逆抑制和可逆抑制二种类型,其中可逆抑制有可分为三种类型:竞争性抑制、非竞争性抑制和反竞争性抑制。
(1)竞争性抑制类型:酶不能同时与底物和抑制剂结合。
动力学特征为:表观米氏常数Km'增加,Vm'不变。
(下式中Ki 为抑制剂常数,[I]为抑制剂浓度)。
][)][1(][S K I K S V v im m ++=)][1('im m K I K K += (2)非竞争性抑制类型:抑制剂、底物能同时与酶结合,但此复合物不能进一步分解为产物,Km'不变,Vm'下降。
米氏常数测定实验报告米氏常数测定实验报告引言:米氏常数是指光在真空中的速度,它是物理学中一个重要的常数。
本实验旨在通过测量光在不同介质中的传播速度,从而确定米氏常数的数值。
实验仪器和材料:1. 光路调整器2. 光源3. 半反射镜4. 透镜5. 光电探测器6. 不同介质样品(如水、玻璃、空气等)7. 计时器8. 数据记录表格实验步骤:1. 将光源放置在实验台上,并使用光路调整器调整光线的方向和强度,确保光线垂直射入实验装置。
2. 将半反射镜放置在光路上,使光线分为两束,一束射向透镜,另一束射向光电探测器。
3. 将不同介质样品依次放置在透镜前方,确保光线经过样品后再射向光电探测器。
4. 使用计时器记录光线从光源到光电探测器的时间,并记录下实验所用的介质。
5. 重复步骤3和4,使用不同介质进行多次测量,确保数据的准确性和可靠性。
6. 将实验数据整理并填入数据记录表格中。
数据处理:根据实验数据,我们可以计算出光在不同介质中的传播速度。
首先,我们需要计算光线从光源到光电探测器的路径长度。
根据光线的传播路径和介质的折射率,可以使用折射定律计算出路径长度。
然后,我们可以通过路径长度除以传播时间,得到光在不同介质中的传播速度。
最后,通过比较不同介质中的传播速度,我们可以确定米氏常数的数值。
实验结果和讨论:根据实验数据和计算结果,我们可以得到光在不同介质中的传播速度。
通过比较不同介质中的传播速度,我们可以看到光在空气中传播的速度最快,而在水和玻璃中传播的速度较慢。
这是因为不同介质对光的传播具有不同的阻碍作用,导致光的传播速度发生变化。
根据实验数据和计算结果,我们还可以确定米氏常数的数值。
通过将光在不同介质中的传播速度与真空中的传播速度进行比较,我们可以得到米氏常数的数值。
实验结果显示,米氏常数的数值约为3.0 x 10^8 m/s,这与已知的数值非常接近。
结论:通过本实验,我们成功地测定了光在不同介质中的传播速度,并确定了米氏常数的数值。
⽶⽒常数的测定底物浓度对酶促反应速度的影响——⽶⽒常数的测定⼀.⽬的要求1.1了解底物浓度对酶促反应的影响。
1.2掌握测定⽶⽒常数K m 的原理和⽅法。
⼆.实验原理酶促反应速度与底物浓度的关系可⽤⽶⽒⽅程来表⽰:式中:v ——反应初速度(微摩尔浓度变化/min );V ——最⼤反应速度(微摩尔浓度变化/min ); [s]——底物浓度(mol/L ); K m ——⽶⽒常数(mol/L )。
这个⽅程表明当已知K m 及V 时,酶促反应速度与底物浓度之间的定量关系。
K m 值等于酶促反应速度达到最⼤反应速度⼀半时所对应的底物浓度,是酶的特征常数之⼀。
不同的酶,K m 值不同,同⼀种酶与不同底物反应K m 值也不同,K m 值可以近似地反应酶与底物的亲和⼒⼤⼩:K m 值越⼤,表明亲和⼒⼩;K m 值⼩,表明亲和⼒⼤。
则测K m 值是酶学研究的⼀个重要⽅法。
⼤多数纯酶的K m 值在0.01~100mmol/L 。
Linewaeaver-Burk 作图法(双倒数作图法)是⽤实验⽅法测K m 值的最常⽤的简便⽅法:实验时可选择不同的[s],测定对应的v ,以对作图,得到⼀个斜率为V Km的直线,其截距][1s 则为mK 1,由此可求出K m 的值(截距的负倒数)。
本实验以胰蛋⽩酶消化酪蛋⽩为例,采⽤Linewaeaver-Burk 双倒数作图法测定双倒数作图法。
胰蛋⽩酶催化蛋⽩质中碱性氨基酸(L-精氨酸和L-赖氨酸)的羧基所形成的肽键⽔解。
⽔解时有⾃由氨基⽣成,可⽤甲醛滴定法判断⾃由氨基增加的数量⽽跟踪反应,求得初速度。
][][s K s V v m +=V s V K v m 1][1.1+=v 1][1s三.试剂和器材3.1 试剂A.10~30g/L的酪蛋⽩溶液(pH8.5):分别取10、20、25、30g酪蛋⽩溶于约900mL⽔中,加20mL 1mol/L NaOH 连续振荡,微热直⾄溶解,以1mol/L HCl 或1mol/L NaOH调pH⾄8.5,定容1L,即⽣成四种不同[s]的酪蛋⽩标准溶液。
米氏常数和最大反应速率的测定米氏常数和最大反应速率是化学和生物学实验中常用的概念,用于描述反应的速度、强度和动力学特征。
本文将简要介绍这两个概念的概念解释、测定方法和实验应用。
一、米氏常数1、概念解释米氏常数(Michaelis–Menten constant),又称Michaelis常数,是指在酶促反应中,酶与底物结合成酶-底物复合物的速度等于酶-底物复合物解离的速度时,底物浓度等于米氏常数时,酶催化底物转化的速率达到最大的底物浓度。
即具有一定的底物浓度时,酶反应速率线性增加,但当底物浓度增加到一定程度时,反应速率不再随之增加。
2、测定方法测定米氏常数的实验方法叫作Michalis-Menten方法。
首先,在不同的底物浓度下,测定酶催化底物转化的速率(V0),然后作图,以底物浓度为自变量,速率为因变量,得到一个曲线。
通过对这个曲线拟合,计算出Vmax(酶的最大催化速率)和Km(米氏常数)。
3、实验应用米氏常数是衡量底物与酶结合的亲和力的指标,也可以用来确定酶的催化效率,因此被广泛应用于生物化学和酶学的研究中。
例如,在药物开发过程中,可以通过测定药物对酶的抑制作用来计算Km值,以此评估药物的有效性和选择性。
二、最大反应速率最大反应速率(maximum reaction rate)是指在一定反应条件下,反应物浓度充足时,反应反应的最大速率。
最大反应速率是反应速率的一个重要参数,因为它反映了反应物种类、反应条件、反应物浓度等因素对反应速率的影响。
测定最大反应速率的方法主要有两种:手动法和自动法。
手动法适用于较为简单的反应,如催化反应;自动法适用于反应物种类较多、反应复杂的反应,如酶催化等反应。
手动法的操作相对较为简便,在反应器中加入反应物并记录反应速率随时间的变化;自动法则需要使用自动反应系统,能够在反应条件和反应时间上实现严格的控制和记录。
最大反应速率是反应速率的一个重要参数,可以用于评估反应的强度、动力学特征和反应机理。
过氧化氢酶米氏常数的测定过氧化氢酶米氏常数的测定傅璐121140012一、实验目的1. 了解米氏常数的测定方法2. 学习提取生物组织中的酶二、实验原理1.米氏反应动力学米氏方程(Michaelis-Menten Equation):2.米氏常数的意义:①反映酶的种类:Km是一种酶的特征常数,只与酶的种类有关,与酶浓度、底物浓度无关。
②米氏常数是酶促反应达到最大反应速度Vmax一半时的底物浓度。
其数值大小反映了酶与底物之间的亲和力:Km值越大,亲和力越弱,反之Km值越小,亲和能力越强。
③Km可用来判断酶(多功能酶)的最适底物:Km值最小的酶促反应对应底物就是该酶的最适底物。
3.米氏常数的求法:该方法的缺点是难以确定最大反应速度Vmax。
该作图法应用最广。
但在低浓度是v值误差较大,在[S]等差值实验时作图点较集中于纵轴。
因此在设计底物浓度时,最好将1/[S]配成等差数列,这样可使点距较为平均,再配以最小二乘回归法,就可以得到较为准确的结果。
此法优点是横轴上点分布均匀,缺点是1/v会放大误差,同时对底物浓度的选择有要求。
[S]<<Km时图形近于水平线,[S]>>Km时直线将在原点附近与轴相交。
4.氧化酶:生物体内重要的三种氧化酶类,其作用均是消除体内自由基:①POD:过氧化物酶②SOD:超氧化物歧化酶③CAT:;过氧化氢酶5.过氧化氢酶的作用:植物体内活性氧代谢加强而使过氧化氢发生积累。
过氧化氢可进行一步生成氢氧自由基。
氢氧自由基是化学性质最活泼的活性氧,可以直接或间接地氧化细胞内核酸、蛋白质等生物大分子,并且有非常高的速度常数,破坏性极强,可使细胞膜遭受损害,加速细胞的衰老和解体。
过氧化氢酶(catalase,CAT)可以清除过氧化氢、分解氢氧自由基,保护机体细胞稳定的内环境及细胞的正常生活,因此CAT是植物体内重要的酶促防御系统之一,其活性高低与植物的抗逆性密切相关。
6.过氧化氢酶活力的测定方法:①紫外吸收法:过氧化氢在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240nm)随反应时间而降低。
底物浓度对酶促反应速度的影响
——米氏常数的测定
一.目的要求
1.1了解底物浓度对酶促反应的影响。
1.2掌握测定米氏常数K m 的原理和方法。
二.实验原理
酶促反应速度与底物浓度的关系可用米氏方程来表示:
式中:
v ——反应初速度(微摩尔浓度变化/min );
V ——最大反应速度(微摩尔浓度变化/min ); [s]——底物浓度(mol/L ); K m ——米氏常数(mol/L )。
这个方程表明当已知K m 及V 时,酶促反应速度与底物浓度之间的定量关系。
K m 值等于酶促反应速度达到最大反应速度一半时所对应的底物浓度,是酶的特征常数之一。
不同的酶,K m 值不同,同一种酶与不同底物反应K m 值也不同,K m 值可以近似地反应酶与底物的亲和力大小:K m 值越大,表明亲和力小;K m 值小,表明亲和力大。
则测K m 值是酶学研究的一个重要方法。
大多数纯酶的K m 值在0.01~100mmol/L 。
Linewaeaver-Burk 作图法(双倒数作图法)是用实验方法测K m 值的最常用的简便方法:
实验时可选择不同的[s],测定对应的v ,以 对 作图,得到一个斜率为V K
m
的直线,其截距
][1s 则为m
K 1,由此可求出K m 的值(截距的负倒数)。
本实验以胰蛋白酶消化酪蛋白为例,采用Linewaeaver-Burk 双倒数作图法测定双倒数作图法。
胰蛋白酶催化蛋白质中碱性氨基酸(L-精氨酸和L-赖氨酸)的羧基所形成的肽键水解。
水解时有自由氨基生成,可用甲醛滴定法判断自由氨基增加的数量而跟踪反应,求得初速度。
]
[][s K s V v m +=
V s V K v m 1
][1.1+
=v 1][1s
三.试剂和器材
3.1 试剂
A.10~30g/L的酪蛋白溶液(pH8.5):
分别取10、20、25、30g酪蛋白溶于约900mL水中,加20mL 1mol/L NaOH 连续振荡,微热直至溶解,以1mol/L HCl 或1mol/L NaOH调pH至8.5,定容1L,即生成四种不同[s]的酪蛋白标准溶液。
B.中性甲醛溶液:
100mL分析甲醛加20 mL 0.25%酚酞乙醇溶液,以0.1mol/L NaOH滴至微红,密闭于玻璃瓶中。
C.0.25%酚酞乙醇溶液:
2.5g酚酞以50%乙醇溶解,并定容至1L。
D.标准0.1mol/L NaOH溶液:
事先用邻苯二甲酸氢钾标定过。
3.2 材料
胰酶溶液:称取3g胰酶(胰蛋白酶、胰淀粉酶、胰脂肪酶的混合物)溶于25ml蒸馏水中,放入冰箱保存。
3.3 器材
恒温水浴;50ml三角烧瓶(×16),150ml三角烧瓶(×4);吸管5ml(×1),10ml(×5);量筒100ml(×4);25ml碱式滴定管及滴定台,蝴蝶夹;恒温水浴;滴管。
四.操作方法
1. 取50mL三角瓶4个,加入5mL甲醛与1滴酚酞,以0.1mol/L标准NaOH滴定至微红色,4个瓶颜色应当一致,编号。
2. 量取30g/L酪蛋白50mL,加入一150mL三角瓶,37℃保温10min,然后吸取5mL酶液加到酪蛋白液中。
(同时计时!)充分混合后立即取出10mL反应液(定为0号样品)加入一含甲醛的小三角瓶中(1号)加10滴酚酞。
以0.1mol/L NaOH 毫升数,记下耗去的0.1mol/L标准NaOH的毫升数。
3. 在2min,4min,6min时,分别取出10mL反应液,加入2号,3号,4号小三角瓶,同上操作,记下耗去NaOH的毫升数。
以滴定度(即NaOH的毫升数)对时间作图,得一直线,其斜率即初速度为V40(相对于40g/L的酪蛋白浓度)。
然后分别量取25g/L,20g/L,10g/L的酪蛋白溶液,重复上述操作,分别测出V25、V20、V10。
利用上述结果,以1/v对1/[s]作图,即求出V与Km值。
五.实验数据处理
5.1.实验原始数据记录:如表1中所示。
表1 实验数据记录
实验号(酶解时间/min)酪蛋白浓度1(0)2(2)3(4)4(6)
NaOH消耗的体积/ml
10g/L 0.88 1.32 1.52 1.74
20g/L 1.19 1.67 2.07 2.35
25g/L 1.51 1.87 2.29 2.80
30g/L 1.51 1.98 2.53 2.99
5.2相对各浓度酪蛋白的各初速度值
以滴定度(即NaOH的毫升数)对时间作图,得一直线,其斜率即初速度值。
(1)相对于10g/L酪蛋白的初速度V10
根据数据作图得图1-1。
由图1-1中得直线方程y=0.139x+0.948,其斜率为0.139,即为V10=0.139g/L·min。
(2)相对于20g/L酪蛋白的初速度V20
根据数据作图得图2。
由图2中得直线方程y=0.194x+1.238,其斜率为0.194,即为V20=0.194g/L·min。
(3)相对于25g/L酪蛋白的初速度V25
根据数据作图得图1-3。
由图1-3中得直线方程y=0.215x+1.474,其斜率为0.215,即为V25=0.215 g/L·min。
(4)相对于30g/L酪蛋白的初速度V30
根据数据作图得图1-4。
由图1-4中得直线方程y=0.250+1.504,其斜率为0.250,即为V30= 0.250g/L·min。
5.3求解V与Km值
表2 求得的v与[s]值
酪蛋白浓度[s]/(g/L)1/[s] 初速度v /(g / L·min) 1/v
10 0.100 0.1397.194
20 0.050 0.194 5.155
25 0.040 0.215 4.651
30 0.033 0.250 4.000
以1/v对1/[s]作图,得一直线(见图2),其斜率即Km/V,截距即1/V,即求出V与Km值。
由图2可知,斜率为45.14,截距为2.7334,即Km /V= 45.14 ,1/V=2.7334
所以,Km=45.14/2.7334=16.51g/L
六.实验结果与讨论
实验表明,反应速度只在最初一段时间内保持恒定,随着反应时间的延长,酶促反应速度逐渐下降。
原因有多种,如底物浓度降低,产物浓度增加而对酶产生抑制并加速逆反应的进行,酶在一定PH及温度下部分失活等。
因此,研究酶的活力以酶促反应的初速度为准。
在本实验中,图1-1和1-2线性不是很理想,可能的原因有:
(1)酶促反应的时间没有得到严格的控制
(2)实验所用的酶是粗酶液,是胰酶溶液是胰蛋白酶、胰淀粉酶和胰脂肪酶的混合物,并不是纯酶。
我们知道酶的催化具有高度的专一性,一种酶只能作用于特定的底物,所以本实验中所用的酶不能准确反应酶作用于底物的反应速度。
七.思考题
1.试述底物浓度对酶促反应速度的影响。
(1) 在生化反应中,若酶的浓度为定值,底物的起始浓度较低时,酶促反应速度与底物浓度成正比,反应相对于底物是一级反应。
(2) 在较高的底物浓度下,酶被饱和,进一步提高底物浓度,反应速度提高,但并不是成比例增加,反应相对于底物是混合级反应。
(3) 当所有的酶与底物结合生成中间产物后,即使再增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加,反应相对于底物是个零级反应。
在实际测定中,即使酶浓度足够高,随底物浓度的升高,酶促反应速度并没有因此增加,甚至受到抑制。
其原因是:高浓度底物降低了水的有效浓度,降低了分子扩散性,从而降低了酶促反应速度。
过量的底物聚集在酶分子上,生成无活性的中间产物,不能释放出酶分子,从而也会降低反应速度。
2.在什么条件下,测定酶的Km值可以作为鉴定酶的一种手段,为什么?
当酶作用的底物是酶的最适底物时,并且在最适的pH最适温度以及离子强度等条件下,测定酶的Km值可以作为鉴定酶的一种手段。
因为同一种酶的不同底物作用,不同pH、温度以及离子强度等条件下测定的Km值是不同的。
3.米式方程中的Km值有何实际应用?
(1) 鉴定酶:通过测定Km,可鉴别不同来源或相同来源但在不同发育阶段、不同生理状态下催化相同反应的酶是否属于同一种酶。
(2) 判断酶的最适底物:一种酶如果可以作用于几个底物,就有几个Km值。
测定各种底物的Km值,Km最小的就是最适底物。
(3) 计算一定速度下的底物浓度:由Km值及米氏方程可决定在所要求的反应速度下应加入的底物浓度。
(4) 了解酶的底物在体内具有的浓度水平
(5) 判断反应方向或趋势:催化可逆反应的酶,对正逆两向的Km值通常是不同的。
(6) 推测代谢途径
(7) 判断抑制类型:测定不同抑制剂对某个酶的Km值及Vmax的影响,可以判断该抑制剂的抑制作用类型。