2ml血液基因组DNA提取方法
- 格式:doc
- 大小:31.00 KB
- 文档页数:2

血液DNA提取步骤1. 吸取7ml红细胞裂解液打一个10ml离心管。
2. 将抗凝全血(使用前先恢复到室温)颠倒混匀后,吸取2ml加到上述装有红细胞裂解液的的离心管中,颠倒6-8次,并倒置轻弹管壁,确保充分混匀。
3. 室温放置10min,期间颠倒混匀和漩涡震荡交替进行,共进行4-5次交替。
4. 2000g离心10min,倒弃红色上清液,并尽可能的多吸弃上清,留下完整的管底白细胞团。
5. 加入3ml细胞裂解液到重悬的白细胞,迅速有力吹打几次混匀以裂解白细胞,由于基因组DNA立刻释放出来,这个时候混匀物会马上变得十分粘稠,立刻停止吹打(以免剪切断DNA),颠倒旋转离心管10次保证裂解液和所有的白细胞接触并裂解。
6. 加入1ml蛋白沉淀液后,在旋涡振荡器连续震荡25秒,混匀后可能见到一些白色团块。
7. 3000g离心10min,这时候应该可以见到管底暗褐色的蛋白沉淀。
8. 小心吸取上清液(约3ml)到一个新的15ml离心管中。
9. 加入等体积室温的异丙醇(3ml),轻柔颠倒30次混匀或者知道出现棉絮状白色DNA。
10. 2000g离心5min,让白色DNA的沉淀自然沉到管底,然后尽量倒去上清液,注意不要倒掉底部的白色沉淀。
11. 加入2ml70%乙醇后,颠倒混匀,2000g离心2min,管底可见白色DNA沉淀,倒弃上清液。
12. 加入2ml70%乙醇,颠倒几次漂洗DNA沉淀,2000g离心2min,吸去上清,离心管倒置晾干几分钟,控干残留乙醇。
13. 加入250ulDNA溶解液重新水化DNA沉淀,轻弹管壁混匀,在4摄氏度放置过夜来重新水化DNA。
14. DNA可以存放在2-8摄氏度,如果要长期存放,可以放置在-20摄氏度。
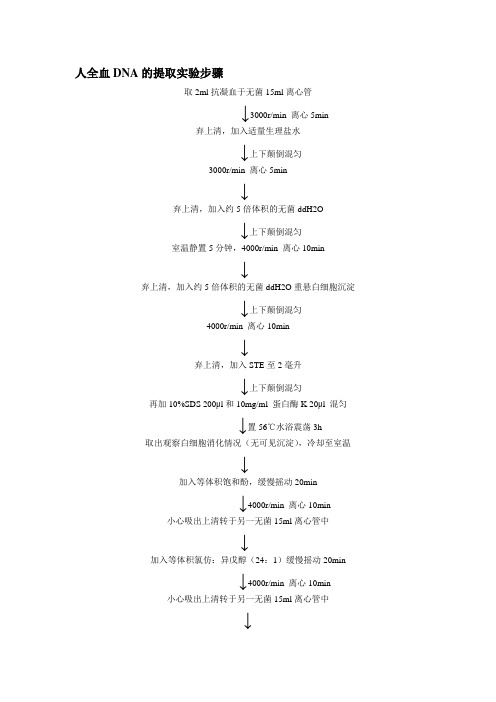
人全血DNA的提取实验步骤
取2ml抗凝血于无菌15ml离心管
↓3000r/min 离心5min
弃上清,加入适量生理盐水
↓上下颠倒混匀
3000r/min 离心5min
↓
弃上清,加入约5倍体积的无菌ddH2O
↓上下颠倒混匀
室温静置5分钟,4000r/min 离心10min
↓
弃上清,加入约5倍体积的无菌ddH2O重悬白细胞沉淀
↓上下颠倒混匀
4000r/min 离心10min
↓
弃上清,加入STE至2毫升
↓上下颠倒混匀
再加10%SDS 200μl和10mg/ml 蛋白酶K 20μl 混匀
↓置56℃水浴震荡3h
取出观察白细胞消化情况(无可见沉淀),冷却至室温
↓
加入等体积饱和酚,缓慢摇动20min
↓4000r/min 离心10min
小心吸出上清转于另一无菌15ml离心管中
↓
加入等体积氯仿:异戊醇(24:1)缓慢摇动20min
↓4000r/min 离心10min
小心吸出上清转于另一无菌15ml离心管中
↓
向上清中加入1/10体积的3M NaAC(pH5.2),混匀
↓
再加入2倍体积的无水乙醇,缓慢摇动即可见DNA丝状体
↓
用无菌吸管吸出DNA丝状体移至装有1ml70%乙醇的Epp管内
↓
12000r/min 离心3~5min,弃上清。
沉淀用1ml 70%乙醇洗涤1~2次
↓
12000 r/min 离心3~5min,弃上清。
↓
室温风干或DNA风干机抽干
↓
用100μl TE溶解DNA 沉淀。

从全血和体液中提取基因组DNA 的操作步骤提取DNA 需要的仪器和试剂:⑴ 1.5ml 离心管⑵ 移液管: 1000ul, 200ul, 40ul 各一支和移液管尖头: 100-1000ul, 1-200ul 各一盒⑶ 微型滤柱(备用)⑷ 小型旋转混合器一台⑸ 小型离心机: 可放入1.5ml 离心管和2ml 收集管.⑹ 恒温水浴⑺ 电冰箱: -20 C, 4 C⑻ 无水乙醇(自备)⑼ 70% 乙醇(自备)⑽ 利普生DNA 提取试剂盒。
内含: ⑴ 裂解液1 ⑵ 裂解液2 ⑶消化液 ⑷纯化液⑸弥散液 ⑹蛋白酶K ⑺ 带钩细玻棒一盒 ⑻ 微型滤柱若干。
提取DNA 前注意:⑴ 使血样品内容物达到室温(15 – 25 C )。
⑵ 预热水浴到58 C , 为步骤3作准备。
⑶ 置弥散液于58 C 内,为步骤4或步骤7作准备。
⑷ 所有的离心步骤均在室温下进行。
⑸ lml 全血可提得15-60ug DNA 。
一.从1ml 全血或体液中提取DNA 的步骤:⑴ 裂解1: 取1ml 全血,血桨,血清,淋巴细胞放入到1.5ml 的离心管中,加入400ul 裂解液1。
上下翻转,使沉淀物分散,旋转脉动15秒后放入离心机中离心,离心速率为8000rpm ,1min.。
倒掉上层液,可见离心管底部有血色沉淀。
重复此裂解步骤一次,这次是加入1ml 裂解液1。
最后用移液管吸净所有上层液弃去, 以使离心管底部的血色沉淀不再残留有裂解液1。
⑵ 裂解2: 在上面离心管中加入1ml 裂解液2。
上下翻转,务必使沉淀物分散, 旋转脉动15秒后放入离心机中离心,8000rpm ,1 min.。
倒掉上清液,可见离心管底部有微量淡红色沉淀。
重复此裂解步骤一次,这次仍然是加入1ml 裂解液2,最后用移液管吸净所有上清液弃去,以使离心管底部的灰白色沉淀不再残留有裂解液2。
⑶ 消化: 吸取蛋白酶K 10ul ( = 0.2mg )加入到上面的离心管中,用移液管尖头反复吹打, 使蛋白酶K 与沉淀物均匀接触后, 加入320ul 消化液,上下翻转离心管, 务必使沉淀物分散于消化液中。

实验一、血液标本提取DNA(蛋白酶K-酚抽提法)一、实验原理离心分离到外周血的白细胞层;用细胞裂解液溶解细胞膜、核膜,使组蛋白与DNA分离,再用酚、三氯甲烷/异戊醇抽提去除蛋白质,最后经乙醇沉淀即可得到基因组DNA片段。
二、实验步骤:1、血液标本处理 1.0ml抗凝全血(ACD、EDTA抗凝均可)2000rpm离心10min(1.5mlEP管)。
轻轻去上清液(血浆),吸出淡黄色悬浮液(白细胞层)置于另一2.0mlEP管中。
(约50μl)2、细胞裂解加入10倍体积组织细胞裂解液,37℃1h,3、加入蛋白酶K消化加入蛋白酶K至终浓度100μg/ml(约4μl),充分混匀,37℃震荡12-24h或37℃1h后,56℃水浴3h。
保温过程中不时摇动,混匀反应液。
液体逐渐变粘稠,表明已有DNA释放出来,操作应轻柔。
4、酚抽提:将上述溶液冷却至室温,加等体积的Tris饱和酚(pH8.0)溶液,温和缓慢颠倒离心管10min,混匀两相成乳液。
12000rpm 5分钟,两相分层。
用宽口径移液管小心吸出上层粘稠的水相,移至一新的2.0mlEP管中。
(小心一点,不要吸入蛋白层。
如交界处有白色沉淀,需重新抽提有机相,用酚重新抽提两次,合并水相)5、三氯甲烷/异戊醇抽提上清液加等体积三氯甲烷:异戊醇(24:1),倒转混匀10分钟,12000rpm5分钟,取上层水相0.5ml入另一新的2.0mlEP管;6、DNA沉淀上清液中加0.2倍体积3.0mol/L 醋酸钠,再加2倍体积的4℃冰箱冷却后的无水乙醇,轻柔振摇,充分混匀;应可看到白色絮状物(DNA)。
12000rpm 5分钟,弃上清液;7、纯化:加1ml 70%乙醇洗涤,12000rpm 离心5分钟,去上清夜,重复1次;(此过程不得振荡摇动)8、溶解:弃上清液后,自然干燥(挥发痕量乙醇)后,用30μl pH8.0TE完全溶解,保存在-20℃备用。
三、注意事项1、加样准确,操作轻柔;微量加样器绝对不能超过最大量程;2、加酚试剂时,不要接触到皮肤上,有腐蚀性;如不小心弄到,立即用清水冲洗;3、取上清液时,不可吸到下层溶液;4、加TE液后轻摇10min溶解DNA或-4˚C保存待用。

全血基因组DNA的提取实验2 全血基因组DNA的提取原理:由于血液各组成成分颗粒大小及比重的不同,利用明胶的吸附作用,使红细胞沉降在管底,从而与白细胞分离。
通过SDS的破膜(细胞膜和核膜)作用,使白细胞释放出DNA,然后利用酚和氯仿抽提纯化,分离除去蛋白质,最后用乙醇沉淀析出DNA。
材料:方法:1.提取WBC(1)取1ml全血(EDTA抗凝),加入等体积(1ml )3%的明胶,盖紧后颠倒混匀,37℃水浴静置5-10分钟。
明胶是高分子的聚合物,可与红细胞粘合并使其凝聚成串钱状而加速红细胞快速沉降,使之与白细胞分离。
(2)取上清液至另一干净离心管,4000转离心5分钟。
(3)弃上清液,留沉淀。
2.破碎WBC在留有沉淀的离心管中加TES 2ml,溶解沉淀(滴管或加样器抽吸,一定要充分吹散沉淀以利于破膜)后加10% SDS 10滴,抽吸混匀,破膜。
以后的操作要小心轻柔,以免机械剪切力破坏核酸的完整性(核酸已释出)3.抽提DNA(1)加入2 ml pH 7.8的饱和酚(在通风橱中操作,吸取下层。
苯酚有毒,注意安全),颠倒混匀(一定要充分混匀)。
4000转离心5-10分钟。
(2)取上层水相至另一离心管,加入等体积的氯仿:异戊醇(24:1)(在通风橱中操作,有毒,注意安全),颠倒混匀,4000转离心5分钟。
4.沉淀DNA将上层水相移至一小玻璃试管中,小心沿试管壁加入2.5倍体积的无水乙醇,用滴管吸上层乙醇沿管壁缓慢冲洗下层溶液(小心,不要把DNA吹散),看到DNA絮状沉淀完全析出为止。
5.溶解DNA沉淀用吸管吸出絮状沉淀至另一1.5ml小离心管,稍离心后加入70%乙醇洗涤1次(去除共沉淀的盐),离心后将乙醇去除干净,挥干5-10分钟。
将上述挥干的DNA加入200-300μl TE(或者双蒸水),轻轻震荡,使之溶解,冰箱保存备用。
结果:获得基因组DNA 讨论:小组10人,个人分别为一组,有的同学的DNA成形状不明显,到实验步骤的最后没有肉眼看见DNA絮状沉淀析出,难以判断基因组DNA是否提取成功。

试剂盒提取血样DNA方法
(1)将血液样本从冰箱取出,置于冰上,待全血开始融化时各加入2ml细胞裂解液CL,上下颠倒混匀,放回冰中,放置约1小时。
(2)将(1)中加过CL的10个血样取出,分别各自分装在2个2ml离心管中,10000rpm离心1min,倒掉上清液,留下细胞核沉淀,向细胞核沉淀中各自加入200ul缓冲液GS,震荡至彻底混匀。
(3)向上述20个离心管中分别加入200ul缓冲液GB,然后再分别加入20ul Proteinase K,充分颠倒混匀,置于56摄氏度水浴中放置10分钟,期间颠倒混匀数次,未彻底变清亮,继续放置一段时间直至溶液变清亮。
(4)室温放置2~5min后各加入350ul缓冲液BD,充分颠倒摇匀,将混合溶液各自分别加入吸附柱CG2中,12000rpm离心30秒,倒掉收集管中的废液,将吸附柱放回收集管。
(5)向吸附柱中加入500ul缓冲液GDB,12000rpm离心30秒,倒掉废液。
(6)向吸附柱中加入600ul漂洗液PWB,12000rpm离心30秒,倒掉废液,再次在12000rpm 离心2分钟,倒掉废液,将吸附柱放置于通风厨中,直至彻底晾干。
(7)将吸附柱转入1.5ml离心管中,向吸附膜中央悬空滴加80ul洗脱缓冲液TB,室温放置2min,12000rpm离心2min,将离心管中洗脱液TB重新吸入吸附柱中,室温放置2分钟,重复离心操作,收集洗脱液,并且各自合并到一个离心管中,最后获得DNA提取液约160ul.。
全血基因组DNA提取步骤1、冷冻全血室温化开。
(如时间紧可37℃化开,反复冻融有利于细胞破裂释放核酸)。
2、取1mL全血,加400μl灭菌蒸馏水,轻缓颠倒混匀5min。
(破碎红细胞)3、10000rpm,10min,可见底部沉淀,倒掉液体。
4、加1mL水,弹起沉淀,颠倒混匀5min。
(破碎红细胞)5、10000rpm,10min,倒掉液体。
(视情况而定,可再洗一次)6、依次加入500μl STE,25μl 10%SDS,10μl 10μg/mL 蛋白酶K。
弹起,颠倒混匀。
7、50℃水浴过夜,可加摇床。
(蛋白酶K的最适温度为55℃,资料上为3h,考虑到过夜时间较长,故降低温度)8、从水浴锅中取出,待降至室温。
9、加500μl Tris饱和酚,颠倒混匀10min。
10、12000rpm,10min。
从离心机取出时注意不要摇动离心管。
仔细将上清移入另一离心管,注意不要吸到中间蛋白层。
11、上清液中加500μl Tris饱和酚,颠倒混匀10min。
12000rpm,10min,取上清。
12、上清液中加500μl 酚/氯仿/异戊醇(25:24:1),颠倒混匀10min。
12000rpm,10min,取上清。
13、上清液中加500μl 氯仿/异戊醇(24:1),颠倒混匀10min。
12000rpm,10min,取上清。
14、加1mL冰冻无水乙醇,轻轻颠倒,可见白色絮状沉淀,用枪头挑入另一离心管。
若只见白色浑浊液体(无絮状沉淀),可加20μl 醋酸铵,轻轻颠倒混匀,液体可变清亮。
8000rpm,5min。
倒去液体。
15、加1mL 70%冰冻乙醇洗涤沉淀,8000rpm,5min。
倒去液体。
16、将离心管倒扣在滤纸上,晾干(需1h以上)。
17、加100μl TE,弹起,置4℃过夜溶解。
次日0.8%琼脂糖凝胶电泳检测。
血液DNA提取方法(中量)适用于大标本量血液DNA提取1.10.5ml BIOG DNA BLOOD ISOLATE KIT析出液加入59.5mL无水乙醇;18mL BIOG DNA BLOOD ISOLATE KIT洗涤液加入42mL无水乙醇2.取15mL离心管,加入7.5mLBIOG结合液,再加入2.5ml的血液,震荡混匀15秒,室温放置5分钟,5,000 rpm 离心3分钟。
3.彻底移去上清,加入625μLPBS,悬浮沉淀;加入2500 μLBIOG裂解液,250μLBIOG消化液,充分振荡混匀,56℃水浴10 分钟至细胞完全裂解。
4.加入6250ul配置好的析出液,轻轻颠倒混匀。
5.将吸附柱放入收集管内,将4813μL上述溶液转入吸附柱内,静置2分钟,5,000 rpm 离心2分钟,弃收集管内废液;6.将吸附柱放回收集管内,将剩余4813μL溶液转移至吸附柱内,重复上一步骤。
7.将吸附柱放回收集管内,加5000 μL洗涤液至吸附柱内,5,000 rpm 离心1分钟,弃收集管内废液。
8.将吸附柱放回收集管内,5,000 rpm 离心2分钟,离去残留的洗涤液。
9.取出吸附柱,放入新的15 mL 离心管内,加入250-400μL BIOG洗脱液,静置3 分钟,5,000 rpm离心2分钟,收集DNA溶液。
提的DNA即可用于下一步实验或-20℃保存。
如需浓缩核酸,则可继续进行后续步骤。
10.于洗脱液中加入800ul无水乙醇,轻轻颠倒混匀,5,000 rpm 离心5分钟,弃上清。
11.开盖室温放置5min,待乙醇挥发后,加入30-50ul洗脱液溶解核酸。
提取的DNA即可用于下一步实验或-20℃保存注意:1.裂解液如有白色絮状物析出属正常现象,置于37℃水浴中溶解即可。
2.配制好的析出液如出现沉淀,可在37℃溶解,摇匀后使用.。
血液dna提取方法
血液DNA提取方法一般包括以下步骤:
1. 血液收集:收集抽取一定量的血液样本,一般使用采血针或者其他采血装置。
2. 血细胞分离:利用离心、负压抽滤等方法将血液中的红细胞、白细胞和血小板等不同成分分离开来。
3. 细胞裂解:将分离后的白细胞等血液细胞用裂解液或者其他溶解剂进行细胞裂解,使细胞膜破裂,释放出细胞内的DNA。
4. DNA纯化:通过离心、过滤或柱层析等方法将裂解后的细胞中的DNA纯化出来,去除其他残留物质。
5. 检测DNA浓度和纯度:利用紫外吸收分光光度计等设备检测提取得到的DNA的浓度和纯度。
以上是一般常用的血液DNA提取方法,不同的实验目的和要求可能会有所不同,因此在实际操作中需要根据具体情况选择合适的方法。
血液基因组dna的提取
血液基因组DNA的提取是一种常用的分子生物学技术,在实
验室中可以进行以下步骤:
1. 样本收集:使用适当的采集工具,如血液采集管或抽血针,从受试者的静脉或指尖收集血液样本。
2. 细胞溶解:将采集到的血液样本转移到一个试管中,并加入细胞溶解缓冲液。
这个缓冲液中含有盐和酶,可以溶解血细胞膜,释放细胞内的核酸。
3. 蛋白质消化:加入蛋白酶K等酶,用于消化血液样品中的
蛋白质,使DNA从蛋白质中解脱出来。
4. DNA沉淀:通过加入盐和酒精,使DNA从溶液中沉淀出来。
沉淀的DNA可以通过离心将其分离出来。
5. 清洗和纯化:将沉淀的DNA用乙醇或异丙醇洗涤,以去除
残留的盐和酒精。
然后使用缓冲液或纯化试剂将DNA溶解和
纯化。
6. DNA浓度和质量测定:使用分光光度计或荧光探针等工具,测定提取的DNA的浓度和质量。
这一步可以帮助确定DNA
是否适用于后续的实验。
血液基因组DNA提取的具体方法可能因实验室和所需的
DNA用途而有所不同。
以上步骤提供了一个常见的基本流程,但具体的实验细节和试剂可以根据实验需求进行调整和优化。
血液基因组DNA提取方法
提取步骤:1.8ml抗凝血,4O C,2500rpm离心20min,小心吸去上清血浆,留血细胞;4O C 1×BLB加满2ml 离心管,反复颠倒充分混匀,-20O C静止30min,再摇匀,4O C 5000rpm离心10min,弃上清液;加1.8ml 1×BLB混匀,转入2.0ml离心管;4O C 12000rpm离心3min,弃上清液;加入1×BLB 1ml冲洗红细胞后弃冲洗液留底物(重复该步骤一次),加700ul STE;20%SDS 150ul,加20mg/ml PK 10ul,混匀;65 O C 间歇摇匀反应0.5-1小时;加入1mg/ml RNase A 20ul,混匀,反应30min;置冰上冷却5min,加入700ul饱和酚,摇15min;4O C 12000rpm离心3min,小心吸取上清液于2.0ml离心管;加700ul三氯甲烷,摇匀5min;12000rpm 离心3min,吸上清液于2.0ml离心管,加4O C预冷无水乙醇1ml,反复颠倒混匀,至出现明显纤维状沉淀析出,小心移入4O C预冷1ml 70%酒精中,反复颠倒洗涤沉淀,12000rpm离心3min,小心倾倒除去乙醇,静置待管壁液体完全挥发,加入600ul TE缓冲液溶解DNA,小心混匀待用。
准备试剂:BLB、STE、SDS、PK、RNaseA、饱和酚、三氯甲烷、无水乙醇、70%酒精、TE缓冲液
10×红细胞裂解液配制过程:
试剂:NH4CL(1.5M)80g;KHCO3(100nM)10g;Na2EDTA(10nM)3.7g;Distilled H2O 1000ml;
(加1N HCL或1N NaOH,调节pH值用)。
配制:(1)将NH4CL(1.5M)80g;KHCO3(100nM)10g;Na2EDTA(10nM)3.7g试剂溶于900ml 去离子水中;
(2)调节溶液pH值到7.2-7.4,加去离子水定容到1L;
(3)在制备工作液时,将此储存液稀释10倍后使用。
1×蛋白裂解液(STE):2M Tris-HCL(pH 8.2)0.5ml,4M NaCL 10ml,2mM EDTA 0.4ml,加dH2O至100ml。
(4)十二烷基硫酸钠(SDS):十二烷基硫酸钠4g,加入20ml去离子水溶解,成为20%SDS,备用。
(5)蛋白酶K(PK)100mg/瓶,加入5ml 去离子水,稀释为20mg/ml。