结节性硬化症伴肝脏、双肾、胰腺错构瘤1例
- 格式:pdf
- 大小:887.66 KB
- 文档页数:2




2例多系统受累结节性硬化症患者的CT影像分析1 病例简介病例1,女,55岁,主诉:发热3天伴乏力纳差。
体格检查:头面部局部皮肤扁丘状增厚,红褐色,质韧,表面光滑;面部三角区间红色皮疹,按之稍褪色,无贫血貌;左眼睑下垂;左侧腰部数枚直径约0.5-2cm淡红色斑块。
实验室检查尿蛋白阳性,尿红细胞26/uL,尿白细胞36/uL。
头颅、胸腹部CT检查示骨骼及多脏器改变,如图1。
根据国际结节性硬化症诊断标准最终确诊结节性硬化症(TSC)。
病例2,女,32岁,主诉:体检发现蛋白尿2年余,加重2月。
体格检查:面部三角区间红色皮疹,按之稍褪色,无贫血貌;左上腹压痛,无反跳痛,双肾区叩击痛。
实验室检查尿隐血、尿蛋白及尿酮体阳性,尿红细胞65/uL,尿白细胞100/uL。
头颅、胸腹部及脊柱CT检查示骨骼及多脏器改变,如图2。
根据国际结节性硬化症诊断标准最终确诊结节性硬化症(TSC)。
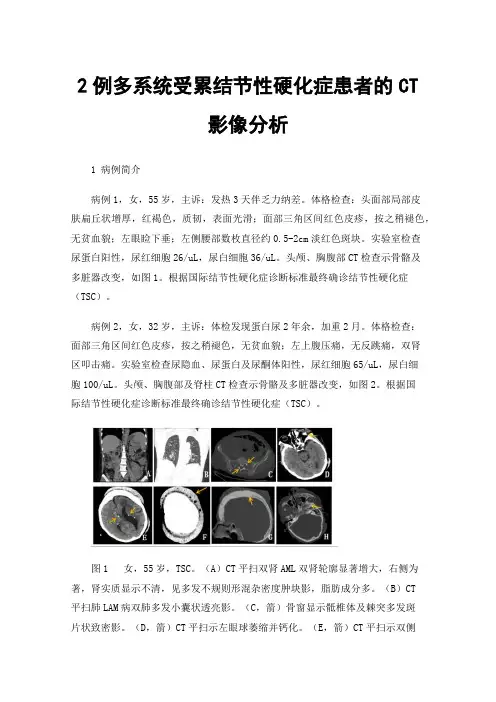
图1 女,55岁,TSC。
(A)CT平扫双肾AML双肾轮廓显著增大,右侧为著,肾实质显示不清,见多发不规则形混杂密度肿块影,脂肪成分多。
(B)CT平扫肺LAM病双肺多发小囊状透亮影。
(C,箭)骨窗显示骶椎体及棘突多发斑片状致密影。
(D,箭)CT平扫示左眼球萎缩并钙化。
(E,箭)CT平扫示双侧脑室室管膜下对称分布多发小结节状高密度影。
(F,箭)CT平扫示头部皮肤广泛增厚并密度增高。
(G、H,箭)骨窗示颅骨广泛增厚并多发斑片状致密影。
图2 女,32岁,TSC。
(A)CT平扫示双肺透亮度增加,多发小囊状透亮影。
(B、D)CT平扫示双肾体积增大,左肾为著,多发血管平滑肌脂肪瘤,轮廓不清。
(C)骨窗脊柱矢状位示椎体及棘突多发斑片状骨质密度增高影。
(E)骨窗示双侧髋骨多发斑片状骨质密度增高影。
(F)肝左内叶小圆形脂肪密度影。
(G)室管膜下小结节状高密度影。
2 讨论结节性硬化症(tuberous sclerosis,TSC)又称Bourneville病,是一种常染色体显性遗传的神经皮肤综合征,多由外胚叶组织的器官发育异常所致,可出现脑、皮肤、周围神经、肾等多器官受累,其特征是在多个器官中形成错构瘤,典型的三联征是面部皮脂腺瘤、癫痫发作和智能减退。


结节性硬化症的颅脑及肾脏影像学表现与治疗马银华【摘要】目的探讨结节性硬化症伴多脏器损害的影像学特点.方法回顾性分析19例结节性硬化症伴皮肤、大脑、肾脏、肝脏等多器官损害的病例资料、临床表现及影像学改变.结果 CT显示室管膜下多发胶质结节及皮层灰质结节呈等密度,钙化结节为高密度,室管膜下病灶多突入侧脑室内,伴有脑积水和肿瘤.MRI 病变T1WI呈等或低信号,T2WI呈高信号,肿瘤的信号不均一.结论影像学检查室管膜下结节、皮质结节,内脏多发性错构瘤为特征,治疗方案应根据双肾肿瘤的大小、分布、发展情况及症状决定,手术时应注意保留正常肾组织,保护肾功能.【期刊名称】《罕少疾病杂志》【年(卷),期】2011(018)001【总页数】3页(P12-14)【关键词】结节性硬化症;体层摄影术;X线计算机;磁共振成像,肾错构瘤【作者】马银华【作者单位】吉林省神经精神病医院,四平,136000【正文语种】中文【中图分类】R742.1;R814.42;R445.2结节性硬化症(tuberous sclerosis complex, TSC)是一少见神经皮肤综合征,常同时发生肾血管平滑肌脂肪瘤(angiomyolipoma,AML),而肾AML患者也有部分伴有TSC,国内肾AML患者中伴TSC者仅占3.9%,远低于国外[1]。
累及肝、脾、骨骼等器官者较少见。
我们共收治19例此类患者,其中1例合并脑肿瘤;3例合并肾错构瘤,报告如下:1 资料与方法1.1 病例资料收集1993年-2009年经CT及MRI诊断的脑结节性硬化19例,男10例、女9例。
年龄6-45岁。
19例中有7例同时做了MRI扫描。
临床表现:19例均有不同程度的皮脂腺瘤,主要见于口鼻周围、双颊、前额的密集黄豆粒大红色硬性皮疹,呈蝶形分布,互不融合。
伴癫痫发作,反应迟钝,言语不清,脑电图轻度异常改变。
1.2 影像学方法 GE Sytec1600C型CT机和GE Prespeed ell型双层螺旋CT机、西门子1.5T超导核磁共振成像仪。

不典型肾脏错构瘤CT和MRI影像学诊断研究王济民;孔延亮【摘要】目的:分析不典型肾脏错构瘤的电子计算机断层扫描(CT)及核磁共振成像(MRI)表现,进一步提高不典型肾脏错构瘤术前诊断的准确率.方法:收集经手术及病理证实的10例不典型肾脏错构瘤患者的临床资料和MSCT及MRI影像资料,其中7例行CT和MRI平扫及增强,3例行M R增强,未行C T增强;观察不典型肾脏错构瘤患者影像学诊断效果及临床特征.结果:10例患者平扫示双肾实质内混杂密度影,共计15个病灶,7个位于右肾,8例位于左肾,5例双肾多发,边界欠清晰,5例实质部分呈均匀密度,2例密度不均匀,合并多房囊变及出血,1例可见斑点样脂肪密度影,2例合并肝脏错构瘤;1例含有钙化.增强扫描后,5例均匀性病灶延迟强化,3例不均匀性强化,实质部分呈较明显持续性不均匀强化;2例单纯脂肪性无强化表现.结论:不典型肾脏错构瘤的CT及M R影像学表现不同,综合检查及分析可提高本病的诊断准确率.【期刊名称】《陕西医学杂志》【年(卷),期】2019(048)003【总页数】4页(P341-344)【关键词】不典型错构瘤;肾脏;电子计算机断层扫描;核磁共振成像;影像诊断【作者】王济民;孔延亮【作者单位】陕西省铜川矿务局中心医院呼吸病院铜川727000;陕西省铜川市人民医院铜川727000【正文语种】中文【中图分类】R445.3肾血管平滑肌脂肪瘤 ( Renal angiomyolipoma, RAML)又称肾错构瘤,是最常见的肾脏良性肿瘤[1],典型的RAML扫描因为发现瘤内负脂肪成分而确诊。
不典型ARAML(Atypical renal angiomylipoma,ARAML)为瘤内缺乏脂肪或无脂肪、瘤体含单一成分(如平滑肌、脂肪、上皮组织)及瘤内合并囊变出血、坏死[2],当错构瘤具有少量脂肪组织和丰富的血管时,在增强CT扫描方面,其表现与肾透明细胞癌非常接近,容易导致误诊为肾癌[3]。


参考文献[1]国家癌症中心,国家肿瘤质控中心胃癌质控专家委员会.中国胃癌规范诊疗质量控制指标(2022版)[J].中华肿瘤杂志,2022,44(10):997-1002.[2]SiegelRL,MillerKD,WagleNS,etal.Cancerstatistics,2023[J].CACancerJClin,2023,73(1):17-48.[3]BrayF,FerlayJ,SoerjomataramI,etal.Globalcancerstatistics2018:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries[J].CACancerJClin,2018,68(6):394-424.[4]郑㊀琪,丁彩霞,李索妮,等.胃印戒细胞癌伴 冰冻腹 1例病例报道[J].消化肿瘤杂志(电子版),2022,14(3):360-363.[5]TanZ.Recentadvancesinthesurgicaltreatmentofadvancedgastriccancer:areview[J].MedSciMonit,2019,25:3537-3541.[6]RodríguezSalasN,Gonz lezPazC,RiveraT,etal.Colonicanasto⁃mosisandcolonicpolypmucosalmetastasisofsignetringcellgastricadenocarcinoma[J].ClinTranslOncol,2010,12(3):238-239.[7]OgiwaraH,KonnoH,KitayamaY,etal.Metastasesfromgastricade⁃nocarcinomapresentingasmultiplecolonicpolyps:reportofacase[J].SurgToday,1994,24(5):473-475.[8]厉㊀瑶,厉学民,王连云,等.胃癌卵巢转移23例临床分析[J].浙江医学,2018,40(11):1250-1251.[9]齐增平,李江花,左献军.希罗达治疗老年胃癌双侧肾上腺转移患者1例报告[J].中国民康医学,2016,28(14):80.[10]ChuaWJ,WanWK,YewTanDM.Ararecaseofduodenalpapillametastasisfromthegastroesophagealjunction[J].AmJGastroen⁃terol,2022,117(2):213.[11]MishimaM,SakuraiT,MiyamotoS.Intramucosalmetastasisofgas⁃triccancertotheduodenum[J].ClinGastroenterolHepatol,2019,17(13):A27.[12]丁苗苗,高㊀平,高亚杰,等.胃癌术后小肠转移1例[J].大连医科大学学报,2017,39(2):205-206.[13]任佳欣,程彩霞.胃癌子宫内膜转移1例报道[J].肿瘤学杂志,2022,28(8):703-704.[14]FléjouJF.WHOclassificationofdigestivetumors:thefourthedi⁃tion[J].AnnPathol,2011,31(5Suppl):S27-S31.[15]GoldsteinNS,LongA,KuanSF,etal.Colonsignetringcellade⁃nocarcinoma:immunohistochemicalcharacterizationandcomparisonwithgastricandtypicalcolonadenocarcinomas[J].ApplImmuno⁃histochemMolMorphol,2000,8(3):183-188.[收稿日期㊀2023-09-15][本文编辑㊀韦㊀颖]本文引用格式陈彩云,包㊀真,欧阳鹏,等.胃癌回肠转移一例[J].中国临床新医学,2024,17(3):338-340.㊀㊀[关键词]㊀胰腺肿瘤;㊀假乳头状瘤;㊀肝转移;㊀病例报道㊀㊀[中图分类号]㊀R735 9㊀[文献标识码]㊀B㊀[文章编号]㊀1674-3806(2024)03-0340-03㊀㊀doi:10.3969/j.issn.1674-3806.2024.03.191 病例介绍患者,女,44岁,因 发现腹部占位1周 于2020年4月20日入住宜昌市中心人民医院㊂体格检查:腹部平软,无压痛㊁反跳痛,未触及包块,肝脾未触及,Murphy征(-),肝区无叩击痛,无移动性浊音,肠鸣音正常㊂血常规㊁生化检查无明显异常,肿瘤标志物阴性㊂胰腺平扫增强CT检查(见图1):胰腺尾部见团块状混杂低密度影,大小约6 3cmˑ5 8cm,病灶密度不均,内见点状钙化,周围间隙稍模糊,增强扫描病灶强化程度低于正常胰腺强化程度,肝内见多发类圆形低密度影,边界欠清,增强扫描病灶环形强化,胆囊结节状高密度影,脾脏增大㊂胰腺动㊁静脉造影检查:胰腺病灶由脾动脉分支供血,脾脏静脉受侵,近中远段闭塞,周围多发侧支血管,胃壁静脉曲张,右侧见副肾动脉㊂影像学诊断考虑胰腺癌伴肝转移㊁胆囊结石㊁脾大㊂正电子发射断层扫描/计算机断层扫描(positronemissiontomography/computedtomography,PET/CT)提示胰腺尾部团块病灶,代谢异常增高,考虑肿瘤;肝脏多发低密度结节,代谢增高,考虑肝脏转移㊂患者于2020年4月22日在超声㊃143㊃㊀㊀中国临床新医学㊀2024年㊀3月㊀第17卷㊀第3期引导下行肝占位穿刺活检术,病理结果提示:镜下见肝细胞分化尚好,另见较多异型细胞呈腺样㊁实性巢状排列,周围间质细胞见黏液样变性,细胞内外可见嗜酸性小体,考虑为恶性肿瘤㊂肝脏穿刺物免疫组化结果(见图2):CK8/18(+),CK19(-),CK7(-),AFP(-),GS(+),Glypican⁃3(+),HSP70(弱+),CD10(+),Ki⁃67(约7%+),CgA(-),Syn(-),CD56(膜+),HCC(-),pgp9 5(-),CD34(血管+),Vimentin(+),PR(弱+),β⁃catenin(浆㊁核+),NSE(部分弱+),E⁃cad(-)㊂特殊染色结果:PAS(+),PAS+淀粉酶(+)㊂5月8日在全麻下行腹腔镜辅助中转开腹的胰体尾切除㊁脾脏切除㊁胆囊切除㊁肝脏多发肿瘤切除术,术后予以对症治疗㊂术后病理结果:(1)结合镜下形态及免疫表型,符合胰腺实性假乳头状瘤(solidpseudopapillaryneoplasmofthepancreas,SPN)伴出血,肿瘤大小约6 5cmˑ6 0cmˑ5 0cm㊂免疫组化结果(见图3)为CD10(+),CD56(+),CgA(-),CyclinD1(+),Galectin⁃3(散在+),NSE(部分+),Vimen⁃tin(+),PR(部分+),Ki⁃67(约5%+),Syn(散在+),β⁃cate⁃nin(+),PCK(AE1/AE3,散在+)㊂(2)送检(肝转移瘤)镜下可见实性假乳头状瘤图像,染色结果:PAS(+),PAS+淀粉酶(+)㊂(3)慢性胆囊炎伴胆石症㊂术后病理结果结合手术标本免疫组化结果,诊断为SPN伴肝转移㊂患者出院后2次来院行介入栓塞治疗㊂患者于当地医院定期复查,电话随访3年,未见复发及转移㊂本研究获宜昌市中心人民医院医学伦理委员会批准㊂ⓐ肝脏多发低密度影;ⓑ胰腺尾部可见团块状低密度影图1㊀胰腺影像学检查所见㊀ⓐHE染色(ˑ100);ⓑCD10染色(ˑ40);ⓒVimentin染色(ˑ40);ⓓβ⁃catenin染色(ˑ100)图2㊀肝脏穿刺物病理检查所见㊀ⓐHE染色(ˑ100);ⓑCD10染色(ˑ40);ⓒVimentin染色(ˑ40);ⓓβ⁃catenin染色(ˑ100)图3㊀术后胰腺肿物病理检查所见2㊀讨论2 1㊀SPN是罕见的胰腺低度恶性肿瘤㊂该肿瘤一般为较大且边界清楚的混合性实体瘤或囊性肿瘤,占外分泌型胰腺肿瘤的1% 2%,占胰腺囊性肿瘤的5%[1]㊂SPN可发生在胰腺任何部位,以体尾部较常见㊂有研究表明,性激素可能参与SPN的发病机制,孕酮可能是其致癌因子,因此SPN常见于年轻女性,男性和老年人的发病率较低[2⁃3]㊂转移性SPN少见,占SPN的5% 15%,肝脏转移的报道较常见,可能与胰腺静脉回流有关[4]㊂因胰腺是腹膜间位器官,当肿瘤向周围侵犯时,其邻近器官组织,如肝脏㊁十二指肠㊁腹膜及邻近血管等容易受累[5]㊂本例报道为44岁女性患者,其肿瘤发生在胰腺体尾部并肝脏多发转移㊂2 2㊀大多数SPN患者有上腹不适等非特异性症状,或有肿瘤逐渐增大产生的压迫症状,部分患者完全没有症状,仅通过影像学检查偶然发现肿瘤,几乎没有实验室特异性指标[6]㊂SPN在CT上通常表现为边界清楚的圆形或卵圆形低密度影,出血和囊变则表现为更低密度区,难以与其他胰腺肿瘤相鉴别,例如胰腺癌㊁胰腺浆液或黏液性囊腺瘤㊁囊腺癌㊁胰腺囊肿等[7]㊂本例患者急行腹部CT时发现大小约6 3cmˑ5 8cm的胰腺尾部占位性病变,脾脏血管受侵,考虑为胰腺癌,并且肝内占位图像与胰腺占位有相似表现,PET/CT提示胰腺尾部团块病灶及肝脏多发低密度结节代谢异常增高,初步诊断为胰腺癌伴肝脏转移,但仍需进一步病理检查明确诊断㊂2 3㊀SPN可采用超声内镜进行占位组织穿刺活检[8]㊂本例患者有肝脏转移灶,先进行肝脏占位组织活检,检查结果考虑为恶性肿瘤,遂行腹腔镜下胰腺体尾切除㊁脾脏切除㊁胆囊切除㊁肝脏多发肿瘤切除术㊂SPN通常为边界清楚的圆形或类圆形肿物,一般较㊃243㊃ChineseJournalofNewClinicalMedicine,March2024,Volume17,Number3㊀㊀大,有实性㊁囊性㊁出血和坏死等多样表现,以实性为主的SPN较少见[9]㊂本例患者胰腺肿物与周围组织分界较清,切面灰白,呈实性,部分区域出血㊁坏死;肝脏转移瘤直径为0 9 2 7cm,包膜完整,与周围组织分界较清,切面灰白,呈实性㊂SPN在镜下呈一种带有血管柄的假乳头和有出血的囊性成分的特征性结构,间质伴透明变㊁黏液变,其间有丰富的毛细血管,肿瘤细胞的细胞质嗜酸性,核圆而小,染色质细腻,常有核沟或凹陷,通常呈凹槽状[10]㊂本例患者送检标本镜下可见多异型细胞,周围间质细胞黏液样变性,细胞内外可见嗜酸性小体㊂除了镜下形态,还需要通过免疫组化来进一步明确诊断㊂不同肿瘤细胞表现出不同程度的异质性,在SPN中,β⁃catenin㊁Vimentin㊁α1⁃抗胰蛋白酶㊁神经元特异性烯醇化酶等通常呈强阳性染色,CD10以及孕激素受体大多呈阳性,角蛋白在大部分病例中有表达[11⁃12]㊂本例患者胰腺肿物及肝脏穿刺物免疫组化结果显示β⁃catenin㊁Vimentin㊁CD10等染色阳性,明确诊断为SPN伴肝脏转移㊂2 4㊀手术是SPN患者的首选治疗方案,具体手术方式取决于肿瘤的位置㊁大小以及其对周围组织侵犯㊁转移等情况㊂肿瘤若发生在胰头,一般行根治性胰十二指肠切除术;若发生在胰腺体尾部,一般行远端胰腺切除术㊂有研究提出SPN摘除术不仅能取得相似的手术效果,也不会增加复发风险,而且与传统术式相比,还有恢复更快㊁减少腺体分泌功能影响的优点[13⁃14]㊂由于SPN的罕见性和惰性,其肝转移的最佳治疗方案尚不明确㊂本例患者肿瘤发生在胰腺尾部及肝脏,首选行腹腔镜下胰体尾㊁肝脏多发转移瘤㊁脾切除术,由于患者脾脏动脉和静脉受侵犯,分离困难,最终行中转开腹术㊂与胰腺癌不同,大多数SPN伴肝脏转移的患者进行转移病灶手术切除后存活时间延长,预后良好[13,15]㊂对于不能切除或不能完全切除肝脏转移灶的患者,采用射频消融术㊁介入栓塞术㊁放疗或化疗等措施也能取得良好效果[6]㊂本例患者肝脏转移灶>5个,不适宜行肝脏转移瘤射频消融术,出院后患者2次来院行介入栓塞术治疗㊂在3年随访中,患者未见复发及转移㊂综上所述,SPN是一种罕见的低度恶性肿瘤,常见于年轻女性,罕见转移㊂实验室检查以及影像学检查往往难以确诊,SPN诊断标准主要依靠病理检查㊂SPN伴肝转移通常首选的治疗方式为手术切除原发肿瘤以及转移灶,针对不能手术切除的肝转移灶也可行射频消融术㊁介入栓塞术等综合治疗,一般预后良好㊂参考文献[1]ChenJ,ZongL,WangP,etal.Solidpseudopapillaryneoplasmsofthepancreas:clinicopathologicanalysisandapredictivemodel[J].ModPathol,2023,36(6):100141.[2]WuJ,MaoY,JiangY,etal.Sexdifferencesinsolidpseudopapil⁃laryneoplasmofthepancreas:apopulation⁃basedstudy[J].CancerMed,2020,9(16):6030-6041.[3]WeiG,LuoQ,FangJ,etal.Thesexfeaturesofpatientswithsolidpseudopapillaryneoplasmsofthepancreas:aretrospectivestudy[J].FrontOncol,2022,12:844182.[4]DhaliA,RayS,DasS,etal.Clinicalprofileandoutcomeofsolidpseudopapillaryneoplasmofthepancreas:aretrospectivestudyon28patients[J].IntJSurg,2022,104:106708.[5]SantosD,CalhauA,BacelarF,etal.Solidpseudopapillaryneoplasmofpancreaswithdistantmetastasisduringpregnancy:adiagnosticandtreatmentchallenge[J].BMJCaseRep,2020,13(12):e237309.[6]YaoJ,SongH.Areviewofclinicopathologicalcharacteristicsandtreat⁃mentofsolidpseudopapillarytumorofthepancreaswith2450casesinChinesepopulation[J].BiomedResInt,2020,2020:2829647.[7]KimJS,HaoEI,RhoSY,etal.Clinicalpatternofpreoperativeposi⁃tronemissiontomography/computedtomography(PET/CT)canpre⁃dicttheaggressivebehaviorofresectedsolidpseudopapillaryneoplasmofthepancreas[J].Cancers(Basel),2021,13(9):2119.[8]WangX,ZhuD,BaoW,etal.Prognosticenigmaofpancreaticsolidpseudopapillaryneoplasm:asingle⁃centerexperienceof63patients[J].FrontSurg,2021,8:771587.[9]DeRobertisR,MarchegianiG,CataniaM,etal.Solidpseudopapil⁃laryneoplasmsofthepancreas:clinicopathologicandradiologicfea⁃turesaccordingtosize[J].AJRAmJRoentgenol,2019,213(5):1073-1080.[10]LaRosaS,BongiovanniM.Pancreaticsolidpseudopapillaryneoplasm:keypathologicandgeneticfeatures[J].ArchPatholLabMed,2020,144(7):829-837.[11]ChenJ,ZongL,WangP,etal.Solidpseudopapillaryneoplasmsofthepancreas:clinicopathologicanalysisandapredictivemodel[J].ModPathol,2023,36(6):100141.[12]ChenH,HuangY,YangN,etal.Solid⁃pseudopapillaryneoplasmofthepancreas:a63⁃caseanalysisofclinicopathologicandimmu⁃nohistochemicalfeaturesandriskfactorsofmalignancy[J].CancerManagRes,2021,13:3335-3343.[13]LiuQ,DaiM,GuoJ,etal.Long⁃termsurvival,qualityoflife,andmolecularfeaturesofthepatientswithsolidpseudopapillaryneoplasmofthepancreas:aretrospectivestudyof454cases[J].AnnSurg,2023,278(6):1009-1017.[14]林贤超,林荣贵,陆逢春,等.微创手术治疗胰腺实性假乳头状瘤临床疗效分析(附单中心89例报告)[J].中国实用外科杂志,2023,43(7):777-781.[15]马㊀驰,谭㊀广.胰腺实性假乳头状瘤的外科诊治进展[J].肝胆外科杂志,2022,30(1):9-12.[收稿日期㊀2023-09-25][本文编辑㊀韦㊀颖]本文引用格式江敏芝,江书典,胡明政.胰腺实性假乳头状瘤伴肝转移一例[J].中国临床新医学,2024,17(3):340-342.㊃343㊃㊀㊀中国临床新医学㊀2024年㊀3月㊀第17卷㊀第3期。
先叙述其全称,然后括号注出中文或英文全称及其缩略语,后两者间用“,”分开。
缩略语不得移行。
十二、论文所涉及的课题如取得国家或部、省级以上基金或属攻关项目,应在文题页左下方脚注中注明,如“本课题受××基金资助(NO1×××)”,作为脚注的第一项,并附基金证书复印件。
文题上不加角注。
脚注与正文之间用水线隔开。
十三、根据“著作权法”,并结合我刊具体情况,凡来稿在接到我刊回执后3个月内,如未接到对来稿的处理意见,则仍在审阅研究中。
作者如欲投他刊,望事先与本刊联系。
来稿一律文责自负,本刊有权对来稿做文字修改、删节,凡有涉及原意的修改则提请作者考虑。
稿件退给作者修改,如3个月不修回者,该修改稿将作新稿重新登记。
十四、凡来稿需付稿件处理费(1500字以下5元,1500字以上10元),中华医学会会员免交。
稿件确认刊载后需按通知数额付版面费。
版面费可由作者单位从课题基金、科研费或其他费用中支付。
确有困难者可申请减免。
来稿刊出后酌致稿酬,论著类另赠当期杂志1册及抽印本20册;病例报告及其他短文每篇仅赠当期杂志1册。
十五、来稿请用16开单面方格稿纸楷写或打写,切勿自创字体及符号,标点占1格。
英文摘要及文献应隔行打印。
来稿应一式两份,其中1份为手写或打印稿,另1份可为复印件,并注意清洁、整齐。
凡不符合以上要求及字迹潦草、涂改不清的稿件,一律退回。
来稿请先经作者所在单位领导和统计室审核,并附正式推荐介绍信。
介绍信除对稿件内容注明审评意见外,还应包括:无一稿两投;不涉及保密;署名无争议等项。
来稿请寄:北京东四西大街42号中华医学会杂志社中华神经科杂志编辑部。
邮政编码:100710。
来稿请勿寄给个人。
结节性硬化病尸检一例报告官 鹏 汪秉康 易旭夫 患者女,26岁,农民。
1996年某日与人发生纠纷过程中缓慢倒地而死。
因死因不明进行法医尸检鉴定。
据了解既往有抽搐、反应迟钝等表现。
!-?@A!DOI:10.3969/j.issn.1001-5256.2023.04.022LPL基因变异导致的婴儿家族性高乳糜微粒血症合并肾脏错构瘤1例报告陈欣涛1a,2,方微园1a,龚晓妍1b,林 琼2,陆 怡1a1复旦大学附属儿科医院a.儿童肝病中心,b.临床营养科,上海201102;2无锡市儿童医院消化科,江苏无锡214023通信作者:陆怡,luyi@fudan.edu.cn(ORCID:0000-0002-3311-4501)关键词:脂蛋白脂酶缺乏症Ⅰ型;高甘油三酯血症;肾脏错构瘤基金项目:国家重点研发计划(2021YFC2700800)InfantilefamilialchylomicronemiasyndromecausedbyLPLgenevariantscoexistingwithrenalhamartoma:AcasereportCHENXintao1a,2,FANGWeiyuan1a,GONGXiaoyan1b,LINQiong2,LUYi1a.(1.a.TheCenterforPediatricLiverDiseases,b.DepartmentofClinicalNutrition,Children’sHospitalofFudanUniversity,Shanghai201102,China;2.DepartmentofGastroenterology,WuxiChildren’sHospital,Wuxi,Jiangsu214023,China)Correspondingauthor:LUYi,luyi@fudan.edu.cn(ORCID:0000-0002-3311-4501)Keywords:HyperlipoproteinemiaTypeI;Hypertriglyceridemia;RenalHamartomaResearchfunding:NationalKeyResearchandDevelopmentProgramofChina(2021YFC2700800)1 病例资料患儿男性,4月龄+20天,因“发现血脂异常8天”于2021年3月收治复旦大学附属儿科医院肝病科。