硅烷生产方法评价
- 格式:pdf
- 大小:1.88 MB
- 文档页数:5

关于硅烷法制备多晶硅工艺研究硅烷法是一种常用的制备多晶硅的工艺方法,也被称为化学气相沉积法。
它是一种将硅材料从气相转化为固相的化学反应过程,通过控制温度、压力和反应气氛等参数,可以制备高纯度、大尺寸、低杂质的多晶硅材料。
硅烷法制备多晶硅的工艺流程包括硅烷气相制备、反应槽气氛控制、沉积反应和多晶硅生长等步骤。
首先是硅烷气相制备。
硅烷是一种有机硅化合物,由硅和氢原子组成。
制备硅烷的方法有很多种,常用的有热分解法、三硅烷氧化法等。
硅烷气相制备的关键是要保证产生高纯度的硅烷气体,避免杂质的影响。
接下来是反应槽气氛控制。
反应槽是硅烷法制备多晶硅的关键设备,其气氛控制对产品质量起着重要作用。
通常采用惰性气体(如氩气)和氢气混合的气氛,控制反应槽内的气氛成分和流速,以调控反应过程中的温度和压力。
然后是沉积反应。
在控制好反应槽内气氛后,将硅烷气体输送到反应槽中,与基片表面发生化学反应,使硅烷气体分解,产生游离的硅原子沉积在基片上,形成硅层。
反应条件的选择对硅层的沉积速率、均匀性和晶体结构有着重要的影响。
最后是多晶硅的生长。
沉积的硅层并非是完全结晶的,需进行后续的热处理或控制晶体生长条件,使其逐渐形成多晶结构。
常用的方法有热退火、区域熔融和液相外延等。
这些方法能够消除硅层中的晶粒界面,促进晶体生长,提高多晶硅的结晶质量。
硅烷法制备多晶硅具有优点明显,例如制备过程可扩展性强、成本相对较低、能够制备大尺寸的硅片等。
然而,也面临一些挑战,例如反应槽的设计和优化、硅烷气氛的控制、多晶硅层的均匀性和控制等。
因此,需要进一步的研究和探索,以提高多晶硅的质量和降低制备成本。
总之,硅烷法是制备多晶硅的重要方法之一,通过合理控制制备工艺和条件,可以得到高质量的多晶硅材料。
未来随着技术的不断发展,硅烷法在半导体材料制备领域将会发挥更大的作用。

硅烷的生产工艺硅烷是一种由硅和氢组成的化合物,其化学式为SiH4。
硅烷是一种无色、有毒的气体,常用于半导体材料的制备和有机合成中。
下面将介绍硅烷的生产工艺。
硅烷的生产工艺主要有热解法和电解法两种。
热解法是最常用的生产硅烷的方法之一。
该方法基于硅矿石的热解反应,通过在高温下将硅矿石与还原剂(如碳)反应,生成硅烷气体。
具体步骤如下:将硅矿石与还原剂混合,并加热至高温。
高温下,硅矿石中的硅与还原剂发生反应,生成硅烷气体。
反应过程中,还可以加入助催化剂,以提高反应速率。
将产生的硅烷气体通过冷凝器冷却,使其凝结成液体。
由于硅烷的沸点较低,在常温下可以将其液化。
将液体硅烷进行分离和纯化,以获得高纯度的硅烷产品。
分离和纯化的方法可以采用蒸馏、吸附等技术。
电解法是另一种生产硅烷的常用方法。
该方法利用电解池中的电解反应,通过电解硅矿石溶液来制备硅烷。
具体步骤如下:将硅矿石溶解在酸性溶液中,得到含有硅离子的溶液。
将该溶液注入电解池中,设置阳极和阴极,并施加电流。
在阳极上,硅离子被氧化成硅氧化物;在阴极上,水分子被还原成氢气。
通过气体收集装置,收集产生的硅烷气体。
硅烷气体可以通过冷凝和纯化步骤得到高纯度的硅烷产品。
这两种生产硅烷的方法各有优缺点。
热解法适用于大规模生产,工艺相对简单,但需要高温条件和较长的反应时间。
电解法适用于小规模生产,工艺相对复杂,但可以实现连续生产和高纯度产品。
除了热解法和电解法,还有一些其他的生产硅烷的方法。
例如,还可以利用化学气相沉积法(CVD)在特定条件下直接从硅源材料中合成硅烷。
此外,还可以通过化学反应、气相传递等方法来制备硅烷。
硅烷的生产工艺包括热解法和电解法等多种方法。
这些方法在不同的应用领域中有不同的适用性和优劣势。
随着科学技术的不断进步,人们对硅烷生产工艺的研究也在不断深入,将有助于提高硅烷的生产效率和产品质量。
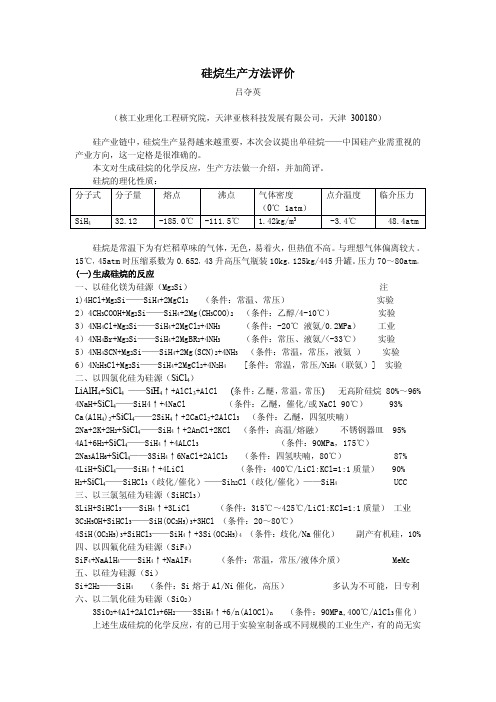
硅烷生产方法评价吕夺英(核工业理化工程研究院,天津亚核科技发展有限公司,天津300180)硅产业链中,硅烷生产显得越来越重要,本次会议提出单硅烷——中国硅产业需重视的产业方向,这一定格是很准确的。
本文对生成硅烷的化学反应,生产方法做一介绍,并加简评。
硅烷的理化性质:硅烷是常温下为有烂稻草味的气体,无色,易着火,但热值不高。
与理想气体偏离较大。
15℃,45atm 时压缩系数为0.652,43升高压气瓶装10kg。
125kg/445升罐。
压力70~80atm。
(一)生成硅烷的反应一、以硅化镁为硅源(Mg 2Si)注1)4HCl+Mg 2Si——SiH 4+2MgCl 2(条件:常温、常压)实验2)4CH 3COOH+Mg 2Si——SiH 4+2Mg(CH 3COO)2(条件:乙醇/4-10℃)实验3)4NH 4Cl+Mg 2Si——SiH 4+2MgCl 2+4NH 3(条件:-20℃液氨/0.2MPa)工业4)4NH 4Br+Mg 2Si——SiH 4+2MgBR 2+4NH 3(条件:常压、液氨/<-33℃)实验5)4NH 4SCN+Mg 2Si——SiH 4+2Mg(SCN)2+4NH 3(条件:常温,常压,液氨)实验6)4N 2H 5Cl+Mg 2Si——SiH 4+2MgCl 2+4N 2H 4[条件:常温,常压/N 2H 4(联氨)]实验二、以四氯化硅为硅源(SiCl 4)LiAlH 4+SiCl 4——SiH 4↑+AlCl 3+AlCl (条件:乙醚,常温,常压)无高阶硅烷80%~96%4NaH +SiCl 4——SiH4↑+4NaCl (条件:乙醚,催化/或NaCl 90℃)93%Ca(AlH 4)2+SiCl 4——2SiH 4↑+2CaCl 2+2AlCl 3(条件:乙醚,四氢呋喃)2Na+2K+2H 2+SiCl 4——SiH 4↑+2AnCl+2KCl (条件:高温/熔融)不锈钢器皿95%4Al+6H 2+SiCl 4——SiH 4↑+4ALCl 3(条件:90MPa,175℃)2Na 3AlH 6+SiCl 4——3SiH 4↑6NaCl+2AlCl 3(条件:四氢呋喃,80℃)87%4LiH +SiCl 4——SiH 4↑+4LiCl (条件:400℃/LiCl:KCl=1:1质量)90%H 2+SiCl 4——SiHCl 3(歧化/催化)——Sih 2Cl(歧化/催化)——SiH 4UCC三、以三氯氢硅为硅源(SiHCl 3)3LiH+SiHCl 3——SiH 4↑+3LiCl (条件:315℃~425℃/LiCl:KCl=1:1质量)工业3C 2H 5OH+SiHCl 3——SiH(OC 2H 5)3+3HCl (条件:20~80℃)4SiH(OC 2H 5)3+SiHCl 3——SiH 4↑+3Si(OC 2H 5)4(条件:歧化/Na 催化)副产有机硅,10%四、以四氟化硅为硅源(SiF 4)SiF 4+NaAlH 4——SiH 4↑+NaAlF 4(条件:常温,常压/液体介质)MeMc五、以硅为硅源(Si)Si+2H 2——SiH 4(条件:Si 熔于Al/Ni 催化,高压)多认为不可能,日专利六、以二氧化硅为硅源(SiO 2)3SiO 2+4Al+2AlCl 3+6H 2——3SiH 4↑+6/n(AlOCl)n (条件:90MPa,400℃/AlCl 3催化)上述生成硅烷的化学反应,有的已用于实验室制备或不同规模的工业生产,有的尚无实分子式分子量熔点沸点气体密度(0℃1atm)点介温度临介压力SiH 432.12-185.0℃-111.5℃ 1.42kg/m 3-3.4℃48.4atm用价值。


硅烷是一种无色、与空气反应、有窒息性的气体。
遇空气燃烧,放出浓密的二氧化硅白烟。
硅烷主要的健康危害在于因接触硅烷自燃产生的热量而导致严重的热灼伤。
高温撞击气瓶的某一部位也可能导致气瓶在没有触动释放装置的情况下爆炸。
如果高压或高流量释放硅烷,可能会听到延迟的爆炸声。
释放出来没有燃烧的硅烷也较为危险,紧急救护必须配备个人防护设备和防火措施。
由于硅烷具有下面几个特点,使硅烷法引起人们的注意。
a.硅烷提纯时,由于硼以复盐的形势溶于液氨中,故除B效果好。
b.硅烷和杂质氢化物性质差别很大,易于提纯。
c.硅烷热分解无需还原剂,避免了还原剂的污染。
d.硅烷热稳定差,分解温度低,电耗小。
e.硅烷热分解反应进行得比较彻底,尾气无需回收。
硅烷用途十分广泛,纯度3N~4N称为工业级硅烷,主要用在玻璃工业,用于镀膜、制造节能玻璃、单向透光玻璃,这些玻璃主要用于高档建筑和高级轿车,工业级硅烷有时候也应用于中小规模集成电路领域。
纯度在5N以上的称为电子级硅烷,主要用途为:特大规模或超大规模集成电路等电子行业、平板显示器行业、硅基薄膜太阳能电池行业、高纯多晶硅、用于制备高纯碳化硅/氮化硅微粉等。
(1)硅烷制备技术硅烷(SiH4)的制备方法主要是以四氯化硅氢化法、硅合金分解法、氢化物还原法、硅的商接氢化法等方法制取。
早在20世纪50年代,业界就开始研究使用硅烷制备多晶硅,然后将制得的硅烷气提纯后在热分解炉生产纯度较高的棒状多晶硅。
它主要由3个基本步骤组成:硅烷的制备、硅烷的提纯和硅烷热分解。
因硅烷制备方法不同,硅烷法可被分为日本Komatsu 发明的硅化镁法、美国UnionCarbide发明的歧化法、美国MEMC采用的NaAlH4与SiF4反应方法等。
硅烷的生产方法很多,但是目前大规模工业化生产的方法仍以UCC法和Ethyl法为主。
1)硅化镁法该法也称为小松法,是日本小松电子公司在20世纪60年代在世界上首次使用而得名。
主要原理是将硅化镁与干燥的氯化铵粉末按一定比例在混合器内混合后装入加料储罐,在送入硅烷反应器的同时加入液氨,液氨与硅化镁和氯化铵粉末组成的硅粉接触开始反应,主要反应方程式如下所示,反应式(2-3)在氢气的保护和550℃的高温环境反应至少24h。

高纯硅的制备硅在地壳中的含量为27%,主要来源是石英砂(SiO2)和硅酸盐(Na2SiO3) 。
1.2.1粗硅的制备方法:石英砂与焦炭在碳电极的电弧炉中还原,可制得纯度为97%的硅,称为“粗硅”或“工业硅”。
粗硅的制备反应式:SiO2 + 3C ====== SiC + 2 CO (1)2SiC + SiO2 ====== 3Si + 2 CO (2)总反应SiO2 + 2C =====Si + 2 CO(1)高纯硅的化学制备方法1、三氯氢硅还原法:产率大,质量高,成本低,是目前国内外制备高纯硅的主要方法。
2、硅烷法优点:可有效地除去杂质硼和其它金属杂质,无腐蚀性,不需要还原剂,分解温度低,收率高,是个有前途的方法。
缺点:安全性问题3、四氯化硅还原法:硅的收率低。
三氯氢硅还原法制备纯硅的工艺过程:(三氯氢硅:室温下为无色透明、油状液体,易挥发和水解。
在空气中剧烈发烟,有强烈刺激味。
比SiCl4活泼,易分解。
沸点低,容易制备,提纯和还原。
)一、三氯氢硅的制备:原料:粗硅+ 氯化氢流程:粗硅→ 酸洗(去杂质) → 粉碎→ 入干燥炉→ 通入热氮气→ 干燥→ 入沸腾炉→ 通干HCl → 三氯氢硅主反应:Si + 3HCl = SiHCl3 + H2(副反应生成的杂质1、SiCl4 2、SiH2Cl2 )为增加SiHCl3的产率,必须控制好工艺条件,使副产物尽可能的减少。
较佳的工艺条件:1、反应温度280-300℃2、向反应炉中通一定量的H2,与HCl气的比值应保持在1:3~5之间。
3、硅粉与HCl在进入反应炉前要充分干燥,并且硅粉粒度要控制在0.18-0.12mm之间。
4、合成时加入少量铜、银、镁合金作催化剂,可降低合成温度和提高SiHCl3的产率。
二、氯氢硅的提纯目的:除去SiHCl3中含有的SiCl4和多种杂质的氯化物。
提纯方法:精馏精馏提纯:是利用混合液中各组分的沸点不同来达到分离各组分的目的。
三、三氯氢硅还原主反应:SiHCl3 + 3H2 →Si + 3HCl 副反应:4SiHCl3 + 3H2 = Si + 3SiCl4 + 2H2 SiCl4 + H2 = Si + 4HCl升高温度,有利于SiHCl3的还原反应,还会使生成的硅粒粗大而光亮。
硅烷法多晶硅生产方法评述作者:陈发挥来源:《中国化工贸易·下旬刊》2018年第10期摘要:本文介绍硅烷法生产多晶硅工艺。
石英砂、硫酸和氟化钙反应器中生产四氟化硅;液体钠和铝粉在溶剂中与氢气反应生成四氢化钠铝;四氟化硅和四氢化钠铝在溶剂中反应生成硅烷;硅烷精制后进入CVD炉分解沉积成多晶硅棒。
本文介绍硅烷法生产多晶硅技术,采用正硅烷工艺与CVD炉结合,将硅烷气提纯后在反应炉中生产纯度很高的棒状多晶硅。
关键词:石英砂、四氟化硅、四氢化钠铝、硅烷、CVD炉、多晶硅1 硅烷的制备采用石英砂转化成高纯多晶硅的主要工艺过程包括:四氢化钠铝制备、四氟化硅制备、硅烷制备、硅烷热解制多晶硅。
四氢化钠铝(SAH)、四氟化硅(STF)和硅烷的生产过程如下:①四氢化钠铝NaAlH4(SAH)是由其组成的元素铝,钠和氢合成的。
Na(L)+Al(S)+2H2(G)→NaAlH4(S)铝、钠、催化剂预先悬浮在溶剂中,通入高压的氢气,生成SAH浆液,经过沉降、倾析和清洗,固体SAH溶于溶剂中。
②石英砂(SiO2)和氟化钙(CaF2)在硫酸的作用下制备四氟化硅(STF)。
2 CaF2(S)+SiO2(S)+2 H2SO4 →2 CaSO4(S)+SiF4(G)+2 H2O(G)氟化钙和石英砂预先混合,与硫酸反应,生成四氟化硅和硫酸钙。
四氟化硅遇水发生反应生成二氧化硅和氟化氢:SiF4(G)+2 H2O(L)→SiO2(S)+4 HF(G)③四氢化钠铝(SAH)与四氟化硅(STF)在溶剂中反应生成硅烷和四氟化钠铝(SAF)。
NaAlH4(S)+ SiF4(G)→SiH4(G)+NaAlF4(S)反应生成的粗硅烷通过脱轻、脱重、吸附等得到纯度很高的硅烷产品。
2 多晶硅生产多晶硅的生产采用硅烷在CVD(化学气相沉积,Chemical Vapor Deposition)反应炉内热解并沉积在硅芯表面。
NaAlH4(S)+ SiF4(G)→SiH4(G)+NaAlF4(S)不同于三氯氢硅只有在硅芯附近才能得到较高的分解率的特点,硅烷可以在较低的温度、任何空间中进行分解。
高纯硅的制备与硅烷法概述高纯硅是一种纯度较高的硅材料,具有优异的物理、化学和电学性能。
它广泛应用于集成电路、太阳能电池、光纤和半导体领域。
硅烷法是一种常用的高纯硅制备方法,通过控制化学反应条件,可以制备出高纯度的硅材料。
硅烷法的原理硅烷法是利用硅烷化合物在高温条件下分解生成高纯硅的一种方法。
一般使用的硅烷化合物主要有氯硅烷和烷基硅烷两类。
在反应过程中,硅烷化合物被分解生成氯化氢或烷烃,并放出纯净的硅元素。
硅烷法的步骤1.材料准备:需要准备高纯度的硅烷化合物和适量的载气。
硅烷化合物的纯度越高,制备的高纯硅也会越高。
2.反应装置:一般采用石英管或石英舟作为反应装置,因为石英具有较好的耐高温性能。
3.反应条件控制:反应过程中需要控制温度、气氛和反应时间等参数。
通常的反应温度为800-1200摄氏度,反应气氛一般为惰性气体,如氢气。
4.反应过程:将硅烷化合物和载气输入反应装置,加热到反应温度,控制一定时间后,硅烷化合物会发生分解反应生成高纯硅。
反应产物可以通过后续的处理步骤进一步提高纯度。
硅烷法的优点1.制备高纯度:硅烷法可以制备出高纯度的硅材料,可以满足各种应用的需求。
2.可控性好:通过调节反应条件和反应时间,可以控制硅烷法制备的硅材料的纯度和晶粒大小。
3.简便易用:硅烷法操作简单,设备相对简单,易于实施。
4.适应性广:硅烷法不仅适用于小批量制备,也适用于大规模生产,可以满足不同规模的生产需求。
硅烷法的应用1.半导体领域:高纯硅是集成电路和微电子器件的重要材料,硅烷法制备的高纯硅可以满足半导体设备的高纯度要求。
2.太阳能电池领域:高纯硅作为太阳能电池的基本材料之一,硅烷法可以制备高纯度的硅材料,提高太阳能电池的效率。
3.光纤领域:高纯硅可以用于制备光纤的芯材,硅烷法的高纯度硅材料可以提高光纤的传输性能。
4.其他领域:高纯硅还可以用于制备薄膜材料、氢氧化硅、硅胶等材料,广泛应用于化工、材料科学和医药领域。
年产3500吨硅烷生产线碳排放量核算摘要:歧化法生产硅烷是我国常用的一种硅烷生产工艺,由于歧化法生产过程中,能源消耗量大,在国家能耗双控战略转向碳排放双控下,了解歧化法生产工艺的碳排放情况对于项目节能降耗,优化工艺具有较好的指导意义。
本文采用全生命周期法对某企业年产3500吨硅烷生产线碳排放进行了核算,结果表明年产3500吨硅烷生产线在项目达产年碳排放量为92732.25tCO2,单位工业增加值碳排放量为3.30 tCO2/万元。
关键词:歧化法;碳排放;硅烷硅烷(silane)在现代高科技中被广泛应用并且越来越重要,首先是与它的特性有关,同时也与现代高技术的特殊需求有关。
硅烷已成为半导体微电子工艺中使用的最主要的特种气体,用于各种微电子薄膜制备,包括单晶膜、微晶、多晶、氧化硅、氮化硅、金属硅化物等。
硅烷生产过程中会消耗大量的能量,属于高耗能行业之一。
随着国家战略布局发生变化,国家从能源双控指标转向碳排放双控指标,在此背景下,研究硅烷生产企业的碳排放量具有重要的意义。
本文以某企业年产3500吨硅烷生产线为例从全生命周期研究其碳排放情况[1-4]。
1、硅烷生产工艺三氯氢硅歧化法,该工艺主要是硅烷的制备方法。
四氯化硅氢化生成三氯氢硅,然后三氯氢硅歧化生成二氯二氢硅,二氯二氢硅再次歧化生成硅烷。
高氯化硅烷通过带有催化床的反应器逐步发生歧化反应,最终得到SiH4和SiCI4。
制备歧化四硅的关键设备是催化床反应器。
由于歧化反应的转化率受化学平衡的制约,这种情况要求及时将反应物与未反应的原料分离,以达到整个过程完全转化的目的。
其反应方程式为:年产3500吨/年硅烷生产线整个生产工艺分为冷氢化单元与歧化单元,其中冷氢化单元主要包括:硅粉干燥、流化床反应、急冷系统、精馏系统、氢压系统、渣浆处理系统。
歧化单元主要包括歧化反应系统、粗硅烷压缩系统、硅烷精馏系统和公用工程系统。
收稿日期:修回日期:作者简介:杜朝军(1978- )副教授河南南阳人主要从事节能降碳研究图1流程简图(硅粉干燥、流化床反应、急冷系统、氢压系统)图2 流程简图(歧化装置)2、项目碳排放量核算按照《中国化工生产企业温室气体排放核算方法与报告指南(试行)》计算年温室气体排放量核算如下:(1)、化石燃料燃烧排放表1化石燃料燃烧排放表排放因子数据:焦炉煤气单位热值含碳量为0.0121tC/GJ、碳氧化率为99%。
硅烷安全条件评价报告全文共四篇示例,供读者参考第一篇示例:硅烷是一类重要的有机硅化合物,在工业生产和科研领域中被广泛应用。
硅烷具有许多良好的特性,例如化学稳定性高、抗热性好等,因此在各行各业都有所应用。
硅烷也存在一定的安全隐患,需要进行安全条件评价以确保其在生产和使用过程中不会对人体健康和环境造成危害。
一、硅烷的基本性质硅烷是由硅原子和氢原子构成的的有机硅化合物,通式为SiHnCl4-n(n=1~4)。
硅烷具有较高的反应性,常在高温下和氧气、水蒸气等发生反应,生成硅酸盐、硅氧化物等产物。
硅烷的挥发性也比较高,易于挥发成为气态,因此在储存和使用过程中需要采取相应的安全措施。
二、硅烷的安全风险1. 硅烷具有较高的反应活性,在与氧气、水蒸气等发生反应时会产生剧烈的化学反应,释放出大量的热量和气体。
这样的反应可能引起火灾或爆炸,给人员和设备造成严重的伤害。
2. 硅烷是一种有毒的物质,吸入或接触高浓度硅烷会导致呼吸道、眼睛和皮肤等部位的损伤。
长期暴露于硅烷中会引起慢性中毒,危害人体健康。
3. 硅烷在空气中的浓度过高时,可能形成爆炸性混合物,一旦遇到明火或高温点火源,容易发生爆炸事故。
三、硅烷的安全条件评价1. 对硅烷进行物理性质的测试,包括密度、相对湿度、沸点、熔点等,以了解其在不同环境条件下的行为和特性。
2. 对硅烷进行化学性质的分析,研究其与氧气、水蒸气等常见物质的反应机制,评估其可能产生的危险性。
3. 进行毒性评价,研究硅烷对人体的毒性和慢性效应,制定相应的暴露限值和安全操作规程。
4. 进行爆炸危险性评估,评估硅烷在不同工艺和条件下可能引起的爆炸性危险,设计相应的防护和应急措施。
5. 制定硅烷的安全操作规程和应急预案,培训操作人员和应急救援人员,确保他们了解硅烷的危险性和安全操作方法。
四、硅烷的安全管理措施1. 在生产、储存和使用硅烷时,应采取相应的安全措施,包括通风设备、防爆措施、个人防护装备等,确保无毒气泄漏和爆炸发生。
硅烷生产方法评价吕夺英
(核工业理化工程研究院,天津亚核科技发展有限公司,天津300180)
硅产业链中,硅烷生产显得越来越重要,本次会议提出单硅烷——中国硅产业需重视的产业方向,这一定格是很准确的。
本文对生成硅烷的化学反应,生产方法做一介绍,并加简评。
硅烷的理化性质:
硅烷是常温下为有烂稻草味的气体,无色,易着火,但热值不高。
与理想气体偏离较大。
15℃,45atm 时压缩系数为0.652,43升高压气瓶装10kg。
125kg/445升罐。
压力70~80atm。
(一)生成硅烷的反应
一、以硅化镁为硅源(Mg 2Si)注1)4HCl+Mg 2Si——SiH 4+2MgCl 2(条件:常温、常压)实验2)4CH 3COOH+Mg 2Si——SiH 4+2Mg(CH 3COO)2(条件:乙醇/4-10℃)实验3)4NH 4Cl+Mg 2Si——SiH 4+2MgCl 2+4NH 3(条件:-20℃液氨/0.2MPa)工业4)4NH 4Br+Mg 2Si——SiH 4+2MgBR 2+4NH 3(条件:常压、液氨/<-33℃)实验5)4NH 4SCN+Mg 2Si——SiH 4+2Mg(SCN)2+4NH 3(条件:常温,常压,液氨)实验6)4N 2H 5Cl+Mg 2Si——SiH 4+2MgCl 2+4N 2H 4[条件:常温,常压/N 2H 4(联氨)]实验
二、以四氯化硅为硅源(SiCl 4)
LiAlH 4+SiCl 4——SiH 4↑+AlCl 3+AlCl (条件:乙醚,常温,常压)无高阶硅烷80%~96%4NaH +SiCl 4——SiH4↑+4NaCl (条件:乙醚,催化/或NaCl 90℃)93%Ca(AlH 4)2+SiCl 4——2SiH 4↑+2CaCl 2+2AlCl 3(条件:乙醚,四氢呋喃)
2Na+2K+2H 2+SiCl 4——SiH 4↑+2AnCl+2KCl (条件:高温/熔融)不锈钢器皿95%4Al+6H 2+SiCl 4——SiH 4↑+4ALCl 3(条件:90MPa,175℃)
2Na 3AlH 6+SiCl 4——3SiH 4↑6NaCl+2AlCl 3(条件:四氢呋喃,80℃)87%4LiH +SiCl 4——SiH 4↑+4LiCl (条件:400℃/LiCl:KCl=1:1质量)90%H 2+SiCl 4——SiHCl 3(歧化/催化)——Sih 2Cl(歧化/催化)——SiH 4UCC
三、以三氯氢硅为硅源(SiHCl 3)
3LiH+SiHCl 3——SiH 4↑+3LiCl (条件:315℃~425℃/LiCl:KCl=1:1质量)工业3C 2H 5OH+SiHCl 3——SiH(OC 2H 5)3+3HCl (条件:20~80℃)
4SiH(OC 2H 5)3+SiHCl 3——SiH 4↑+3Si(OC 2H 5)4(条件:歧化/Na 催化)副产有机硅,10%
四、以四氟化硅为硅源(SiF 4)
SiF 4+NaAlH 4——SiH 4↑+NaAlF 4(条件:常温,常压/液体介质)MeMc
五、以硅为硅源(Si)
Si+2H 2——SiH 4(条件:Si 熔于Al/Ni 催化,高压)多认为不可能,日专利
六、以二氧化硅为硅源(SiO 2)
3SiO 2+4Al+2AlCl 3+6H 2——3SiH 4↑+6/n(AlOCl)n (条件:90MPa,400℃/AlCl 3催化)上述生成硅烷的化学反应,有的已用于实验室制备或不同规模的工业生产,有的尚无实分子式
分子量熔点沸点气体密度(0℃1atm)点介温度临介压力SiH 432.12-185.0℃-111.5℃ 1.42kg/m 3-3.4℃48.4atm
用价值。
随科学技术的发展,某些反应的实用价值会被发现。
硅产业是一个复杂的产业领域,不同领域的接合,有可能使某些没有独立应用价值的反应,在综合开发利用中找到其重要应用价值。
(二)硅烷的工业生产方法及其特点
硅烷的工业生产方法主要有以下几种
(1)硅化镁制备硅烷。
早期普遍采用的方法,中国、日本小松用此法。
(2)氢化锂还原三氯氢硅制备硅烷。
美国方法,86年转移到中国。
(3)氢化铝纳还原四氟化硅制备硅烷。
MeMe专有。
(4)氯硅烷经氢化,然后二次歧化反应制备硅烷。
VCC法。
1、硅化镁制备硅烷。
该方法用硅化镁与氯化铵在-20℃左右的液氨中进行反应产生硅烷。
Mg2Si+4NH4Cl(-20℃液氨/0.0MPa)SiH4↑+4NH3↑+2MgCl2
方法工艺流程如图1-1,主要技术参数如图标示。
图1-1:硅化镁制硅烷工艺流程图
生产过程:
Ⅰ、原料准备系统,主要是合成硅化镁,设备如图1-2。
2Mg+Si——Mg2Si+△H(条件:500~550℃)
图1-2:硅化镁合成炉
Ⅱ、硅烷制备系统,工艺流程图1-3,主要反应如下:
Mg2Si+4NH4Cl(-20℃液氨/0.2MPa)4NH3↑+SiH4↑+2MgCl2
图1-3:硅烷发生流程图
Ⅲ、硅烷提纯系统,4A分子筛吸附NH3,5A分子筛吸附Ⅲ、Ⅴ族元素的氢化物、碳氢化合物。
SiH4用液N2液化,分离出氢、空气等。
方法特点:生产系统紧凑、投资省、能耗低,无污染。
此法限于中小规模生产、难以形成大规模生产能力。
2、氢化锂还原三氯氢硅(或四氯化硅)
SiHCl3(或SiCl4)+3LiH——SiH4+3LiCl(条件:KCl,LiCl熔融/315~425℃)工艺包括硅烷制备系统、硅烷提纯系统,硅烷汽化压缩装瓶系统,工艺流程如图。
图1-4:硅烷提纯流程图
图1-5:硅烷液化-汽化流程图
生产过程是把SiHCl3(或SiCl4)通入熔融的KCl-LiCl和LiH的混合盐中制得SiH4。
反应中LiH不断转化为LiCl,必须补充KCl以保持LiCl与KCl之间1:1的比例。
SiH4反应器外壳为钢板(φ127cm、H102cm)内衬耐火材料,反应室φ61cm,H91cm;SiHCl3供给器,不锈钢村质,φ57,H69cm。
初始反应,反应器中要有近100kg LiCl-KCl的熔盐。
一次加LiH10kg,KCl57kg混匀,置于反应器熔融的熔盐上面,500℃温度下,以He载带SiHCl3(或SiCl4)缓缓注入反应器,即有SiH4产生。
过滤器内装硅铝陶瓷纤维,再径分级冷凝纯化,应该有两套硅烷反应器,使反应器间歇工作。
本方法特点是:
Ⅰ、占地面积小,设备简单。
Ⅱ、转化率高(90%以上),能耗低。
Ⅲ、硅烷纯度高(有害物可<10-9)、安全、无污染。
图2-1:氢化钾还原三氯氢硅制备硅烷流程图
3、氢化铝纳(NaAlH4)还原SiF4
NaAlH4+SiF4———SiH4+NaAlF4
该方法生产过程无氯,可以免受氯硅烷的玷污。
生产系统包括:1.四氯化硅生产车间;2.氢化铝纳生产车间;3.硅烷生产线。
四氯化硅生产:Na2SiF6+H2SO4——H2SiF6+Na2SO4
H2SiF4——SiF4+2HF
氢化铝纳生产:Na(熔融)+Al(粉状)+H2——NaAlH4
本工业化生产方法是美国MeMc公司专有技术,其产物NaAlH4为一种人工合成的良好助熔剂,在制铝及金属熔炼工业中有多种用途。
本方法工艺流程如图3-1。
图3-1四氟化硅制备硅烷工艺流程图
本方法特点:
Ⅰ.适于大规模生产电子级产品,硅烷多晶硅年产可达1000顿以上;
Ⅱ.纯度可>6N,且质量稳定,一致性好;
Ⅲ.安全、无污染环保性好;
Ⅳ.投资巨大,设备多,原料NaAlH4偏高,SiF4强腐蚀,提纯装置复杂。
4、氯硅烷经氢化和二次歧化(UCC法)
本方法工艺流程如图4-1,该方法所需初始原材料SiCl4或SiHCl3,可来自其他工业副产品或中间产品,也可预先制好SiCl4。
Si+2Cl2——SiCl4(条件:500℃)
工业过程中,氢化炉中发生的反应为:3SiCl4+2H2+Si——4SiHCl3(条件:500℃3MPa)此反应即为“氢化”。
第一精馏塔作用是:冷凝未被氢化的SiCl4,使其返回氢化炉,蒸出SiHCl3及由后面反应塔返回的SiH2Cl2。
第一歧化塔的作用是:进行第一次歧化,使SiHCl3歧化产生SiH2Cl2。
2SiHCl3(歧化/催化剂)SiH2Cl2+SiCl4
第二精馏塔作用是:冷凝SiHCl3,使其返回前级,使SiH2Cl2蒸出进入反应塔2(第二歧化塔)。
第二反应塔(二次歧化塔)作用。
3SiH2Cl2(歧化/催化剂)——SiH4↑+2SiHCl3
第三精馏塔作用:顶部流出高纯SiH4产品,SiH2Cl2、SiHCl3冷凝返回第二精馏塔。
UCC法的特点是:
Ⅰ.适用于大规模生产,年产量可达3000~4000吨;
Ⅱ.原材料可以反复循环使用,初始原材料易得;
Ⅲ.转化率高、杂质含量极低;
Ⅳ.投资巨大,设备要求高(耐强腐蚀、低温、高压)、纯化复杂。