必修一第二章第二节离子反应及其发生条件
- 格式:ppt
- 大小:229.50 KB
- 文档页数:30


高中化学必修一:离子反应发生的条件高中化学必修一:离子反应发生的条件一、离子反应发生的条件离子反应的本质是反应前后离子的种类发生变化。
我们所学过的离子反应有复分解反应和置换反应两种类型。
(1)复分解反应在溶液中进行的复分解反应都属于离子反应。
对于在溶液中的复分解反应,由于生成物中必须有气体、难溶物或水中的一种产生,才能使反应物的某些离子浓度减少。
所以复分解反应这类离子反应发生的条件是:生成气体、难溶物或难电离物质(如水)中的一种产生。
(2)置换反应在溶液中进行的置换反应也属于离子反应。
如锌与硫酸铜溶液混合,硫酸铜溶液中电离出的铜离子会减少,其离子方程式可以表示成:________________________。
金属单质与盐发生置换反应的条件是:金属活动性顺序表前面的金属单质(K、Ca、Na除外)可以把后面的金属元素从其化合物中置换出来;金属单质与酸发生置换反应的条件是:金属活动顺序表排在氢前面的金属单质可以把酸中的氢元素从其化合物中置换出来。
二、离子共存问题所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
(1)能发生离子反应的不能共存①结合生成难溶物质的离子不能大量共存,如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等②发生氧化还原反应、水解反应的离子不能大量共存(待学)③结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
④结合生成气体或易挥发性物质的离子不能大量共存,如H+和CO32-、HCO3-、SO32等(2)隐含条件的应用规律①如无色溶液应排除有色离子:常见有色离子有:Fe2+(黄色)、Fe3+(浅绿色)、Cu2+(蓝色)、MnO4-(紫色)等离子。
②酸性则应考虑所给离子组外,还有大量的H+,如OH-、CO32-、HCO3-、SO32- 、HSO3- 、S2- 、HS- 等在酸性条件下不能大量存在。

化学必修一离子反应离子反应二、离子反应及其发生的条件ⅠⅡ实验现象没有明显变化,溶液仍为蓝色有白色沉淀生成Ba2++SO42-==BaSO4↓Cu2+、Cl-没参加反应没有发生反应,溶结论与解释液中仍为Na+、ClCu2+、SO42-一、离子反应有离子的参加的反应称作离子反应。
(酸、碱、盐在水溶液中发生的复分解反应都属于离子反应)二、离子方程式(1)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
(写、改、删、查)(2)书写离子方程式的步骤:①写出反应的化学方程式:CuSO4+BaCl2==CuCl2+BaSO4↓②把易溶于水、易电离的物质写成离子形式,把难溶的、难电离的物质、气体和水等仍用化学式表示。
上述化学方程式可改写成:Cu2++SO42-+Ba2++2Cl-==Cu2++2Cl-+BaSO4↓③删去方程式两边不参加反应的离子:Ba2++SO42-==BaSO4↓④检查离子方程式两边各元素的原子个数和电荷总数是否相等。
写出下列反应的离子方程式:①、AgNO3溶液中滴加稀盐酸:AgNO3+HCl==AgCl↓+HNO3Ag++Cl-==A gCl↓②Ba(OH)2与稀H2SO4溶液反应:Ba(OH)2+H2SO4==BaSO4↓+2H2OBa2++2OH-+2H++SO42-==BaSO4↓+2H2O③醋酸CH3COOH与NaOH溶液反应:CH3COOH+NaOH==CH3COONa+H2OCH3COOH+OH-==CH3COO-+H2O(3)酸碱中和的实质化学方程式HCl+NaOH==NaCl+H2OHCl+KOH==KCl+H2OH2SO4+2NaOH==Na2SO4+2H2OH2SO4+ 2KOH==K2SO4+2H2O离子方程式H++OH-==H++OH-==H++OH-==H++OH-==H2OH2OH2OH2O酸与碱发生中和反应的实质:由酸电离出来的H+与由碱电离出来的OH-结合生成了H2O;可用电离方程式表示:H++OH-==H2O(4)离子方程式的意义:离子方程式跟化学方程式一样,都能描述化学反应,但前者的描述更加本质,离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应。



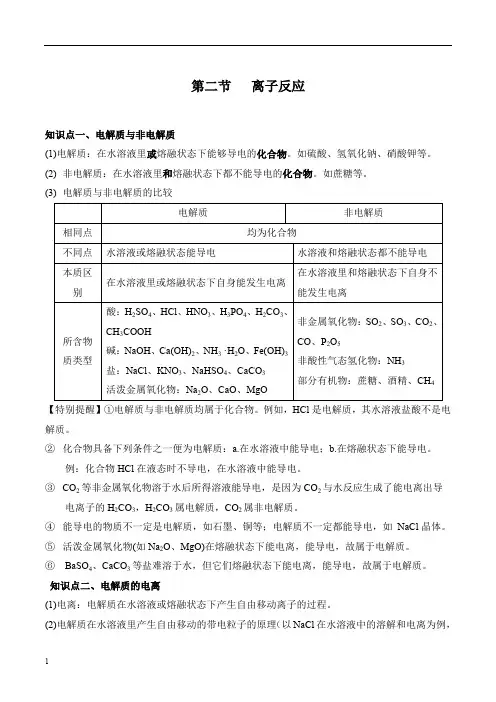
第二节离子反应知识点一、电解质与非电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
如硫酸、氢氧化钠、硝酸钾等。
(2) 非电解质:在水溶液里和熔融状态下都不能导电的化合物。
如蔗糖等。
(3) 电解质与非电解质的比较电解质非电解质相同点均为化合物不同点水溶液或熔融状态能导电水溶液和熔融状态都不能导电本质区别在水溶液里或熔融状态下自身能发生电离在水溶液里和熔融状态下自身不能发生电离所含物质类型酸:H2SO4、HCl、HNO3、H3PO4、H2CO3、CH3COOH碱:NaOH、Ca(OH)2、NH3 ·H2O、Fe(OH)3盐:NaCl、KNO3、NaHSO4、CaCO3活泼金属氧化物:Na2O、CaO、MgO非金属氧化物:SO2、SO3、CO2、CO、P2O5非酸性气态氢化物:NH3部分有机物:蔗糖、酒精、CH4【特别提醒】①电解质与非电解质均属于化合物。
例如,HCl是电解质,其水溶液盐酸不是电解质。
②化合物具备下列条件之一便为电解质:a.在水溶液中能导电;b.在熔融状态下能导电。
例:化合物HCl在液态时不导电,在水溶液中能导电。
③CO2等非金属氧化物溶于水后所得溶液能导电,是因为CO2与水反应生成了能电离出导电离子的H2CO3,H2CO3属电解质,CO2属非电解质。
④能导电的物质不一定是电解质,如石墨、铜等;电解质不一定都能导电,如NaCl晶体。
⑤活泼金属氧化物(如Na2O、MgO)在熔融状态下能电离,能导电,故属于电解质。
⑥BaSO4、CaCO3等盐难溶于水,但它们熔融状态下能电离,能导电,故属于电解质。
知识点二、电解质的电离(1)电离:电解质在水溶液或熔融状态下产生自由移动离子的过程。
(2)电解质在水溶液里产生自由移动的带电粒子的原理(以NaCl在水溶液中的溶解和电离为例,如下图所示):(3)电解质导电的原因电解质导电的前提条件是电解质能产生自由移动的离子,还必须具备一定的外因条件,就是溶于水或受热使电解质呈熔融状态。


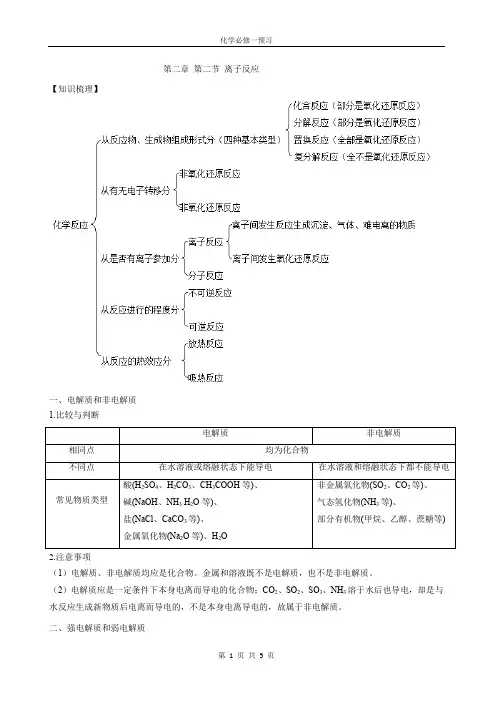
第二章第二节离子反应【知识梳理】一、电解质和非电解质1.比较与判断2.注意事项(1)电解质、非电解质均应是化合物。
金属和溶液既不是电解质,也不是非电解质。
(2)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
二、强电解质和弱电解质1.比较与判断2(1)强电解质六大强酸:H2SO4、HNO3、HCl、HBr、HI、HClO4四大强碱:NaOH、KOH、Ba(OH)2盐:盐不论难溶、易溶,大多数盐都是强电解质(2)弱电解质弱酸:CH3COOH、HClO、HF、HCN、H2SO3、H2S、H2CO3、H3PO4弱碱:NH3·H2O水及少数盐,如(CH3COO)2Pb3.电离方程式的书写(1)电离:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离方程式①强电解质完全电离,用“===”表示。
H2SO4:H2SO4===2H++SO2-4;NaOH:NaOH===Na++OH-;(NH4)2SO4:(NH 4)2SO4===2NH+4+SO2-4;BaSO4:BaSO4===Ba2++SO2-4;KAl(SO4)2:KAl(SO4)2===K++Al3++2SO2-4。
②弱电解质部分电离,用“”表示,多元弱酸的电离分步书写,多元弱碱的电离一步完成。
NH3·H2O:NH3·H2O NH+4+OH-;H2CO3:H2CO3H++HCO-3、HCO-3H++CO2-3。
③酸式盐的电离。
多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同。
NaHSO4:NaHSO4===Na++H++SO2-4;NaHCO3:NaHCO3===Na++HCO-3、HCO-3H++CO2-3。
三、离子反应1.定义:有离子参加或有离子生成的反应统称为离子反应。
2.发生条件:在稀H2SO4中分别加入下列物质,能发生反应的请写出有关反应的离子方程式:A.加入BaCl2溶液:Ba2++SO2-4===BaSO4↓,B.加入CH3COONa溶液:CH3COO-+H+===CH3COOH,C.加入Na2CO3溶液:CO2-3+2H+===CO2↑+H2O,D.加入Zn粒:Zn+2H+===H2↑+Zn2+,E.加入NaOH溶液:H++OH-===H2O。
高一化学必修一离子反应笔记
以下是高一化学必修一离子反应的笔记:
1. 离子反应的概念:在溶液中有离子参加的化学反应。
2. 离子反应的本质:反应物的某些离子浓度的减小。
3. 离子反应发生的条件:
- 生成难溶物,如生成BaSO4、AgCl、CaCO3 等沉淀。
- 生成难电离的物质,如生成H2O、CH3COOH、NH3·H2O 等弱电解质。
- 生成气体,如生成CO2、SO2、H2S 等气体。
- 发生氧化还原反应,如Cl2+2Br- === 2Cl-+Br2。
4. 离子方程式的书写步骤:
- 写:写出反应的化学方程式。
- 拆:把易溶于水、易电离的物质拆写成离子形式。
- 删:删去方程式两边不参加反应的离子。
- 查:检查方程式两边各元素的原子个数和电荷总数是否相等。
5. 离子方程式的意义:离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
6. 离子共存问题:
- 离子间能发生反应,则不能大量共存。
- 注意题干中的条件,如“无色溶液”、“酸性溶液”、“碱性溶液”等。