必修1第二章·第二节《离子反应》
- 格式:doc
- 大小:17.50 KB
- 文档页数:4

新人教版高中化学必修一第二章第二节《离子反应》精品教案第一讲:酸、碱、盐在水溶液中的电解教案方案(设计)课题酸、碱、盐在水溶液中的电解课型新课授课教师教材版本普通高中课程标准实验教科书(必章节第二章第二节第一讲修)Ⅰ学生情况(分析)在初中化学(第十章)中,学生已做过溶液的导电性实验,对溶液导电原因有一定得了解。
在此基础上,介绍氯化钠、硝酸钾、氢氧化钠等固体分别加热至熔化后能导电,结合这些固体在水溶液中能导电这两个特点,就可以很顺利的引出电解质的概念。
在此之前,学生刚刚学过物质的分类这一节课,对分类的方法有了一定得了解,这样子就能够更为清楚得了解电解质与非电解质的概念及其分类,同时可以认识物质除了电解质与非电解质外,还有其他类型,使电解质之概念了解更为完整,进而对之后电解的知识能够比较容易得接受。
学生能够归纳收集自己通过相关途径积累的知识,结合新课标的学习和教学评价,积极参与课堂活动,积极提出疑问,进行交流、讨论、辩论,初步具备化学知识积累研究的能力。
教学内容(分析处理)本节内容节选自本节内容选自《普通高中课程标准实验教科书(必修)Ⅰ》第二章第二节的内容。
在介绍离子反应及其发生的条件以前,需要介绍电解质的概念,以及电解质的电力方程式。
因此,本节内容分为两部分:“酸、碱、盐在水溶液中的电离“和”离子反应及其发生的条件”。
本节课介绍前者。
在初中化学中,学生已做过溶液的导电实验。
再次基础上,介绍氯化钠、硝酸、氢氧化钠固体分别加热至熔化后能导电,这样很顺利地引出电解质概念。
然后,通过介绍氯化钠在水中的溶解和电离,引出氯化钠电离方程式的书写,以及氯化氢、硫酸、硝酸三种酸的电离方程式,从电离的角度得出酸的定义。
最后安排“思考与交流”活动,引导学生从电离角度概括出碱和盐的本质。
本节课的教学重点是:电解质的概念;难点是:电解质的概念,探究碱和盐的定义。
教学目标(设计)知识与技能:1、知道酸、碱、盐在溶液中能发生电离;2、了解电解质和非电解质的概念;3、培养学生通过实验现象分析、探究化学反应实质的能力;过程与方法:1、通过对比实验“几组物质的导电实验”,初步学会形成概念的析方法。



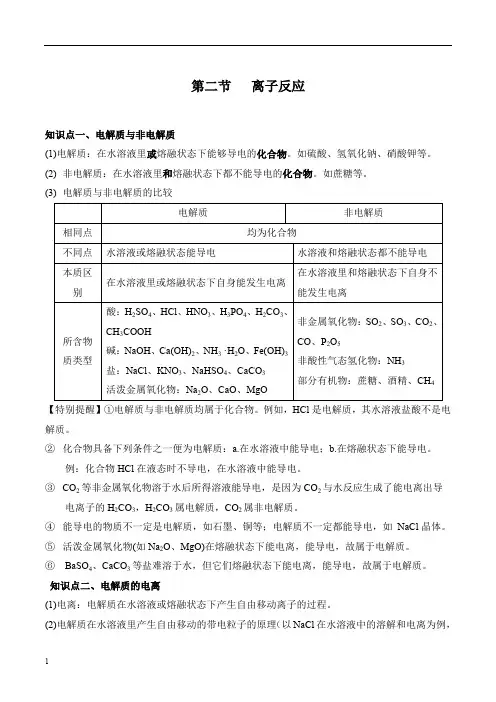
第二节离子反应知识点一、电解质与非电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
如硫酸、氢氧化钠、硝酸钾等。
(2) 非电解质:在水溶液里和熔融状态下都不能导电的化合物。
如蔗糖等。
(3) 电解质与非电解质的比较电解质非电解质相同点均为化合物不同点水溶液或熔融状态能导电水溶液和熔融状态都不能导电本质区别在水溶液里或熔融状态下自身能发生电离在水溶液里和熔融状态下自身不能发生电离所含物质类型酸:H2SO4、HCl、HNO3、H3PO4、H2CO3、CH3COOH碱:NaOH、Ca(OH)2、NH3 ·H2O、Fe(OH)3盐:NaCl、KNO3、NaHSO4、CaCO3活泼金属氧化物:Na2O、CaO、MgO非金属氧化物:SO2、SO3、CO2、CO、P2O5非酸性气态氢化物:NH3部分有机物:蔗糖、酒精、CH4【特别提醒】①电解质与非电解质均属于化合物。
例如,HCl是电解质,其水溶液盐酸不是电解质。
②化合物具备下列条件之一便为电解质:a.在水溶液中能导电;b.在熔融状态下能导电。
例:化合物HCl在液态时不导电,在水溶液中能导电。
③CO2等非金属氧化物溶于水后所得溶液能导电,是因为CO2与水反应生成了能电离出导电离子的H2CO3,H2CO3属电解质,CO2属非电解质。
④能导电的物质不一定是电解质,如石墨、铜等;电解质不一定都能导电,如NaCl晶体。
⑤活泼金属氧化物(如Na2O、MgO)在熔融状态下能电离,能导电,故属于电解质。
⑥BaSO4、CaCO3等盐难溶于水,但它们熔融状态下能电离,能导电,故属于电解质。
知识点二、电解质的电离(1)电离:电解质在水溶液或熔融状态下产生自由移动离子的过程。
(2)电解质在水溶液里产生自由移动的带电粒子的原理(以NaCl在水溶液中的溶解和电离为例,如下图所示):(3)电解质导电的原因电解质导电的前提条件是电解质能产生自由移动的离子,还必须具备一定的外因条件,就是溶于水或受热使电解质呈熔融状态。



【课题】:第二节离子反应(高一化学必修1 第二章化学物质及其变化)
【教学目标】:1.了解电解质的概念,知道酸、碱、盐在水中能发生电离;
2.通过实验事实认识离子反应及其发生的条件
【教学重点】:离子反应发生的条件
【教学难点】:电离、电解质等概念的建立
【教材分析】:本节包括紧密联系的两个部分“酸、碱、盐在水中的电离”和“离子反应发生的条件”。
如何引导学生正确而深刻的理解电解质的电离,是本节的关键,在此基础上引出电解质溶液中的离子反应就是顺理成章的事情了,但要找出电解质溶液中真正是哪些离子参加了反应,仍是需要突破的难点。
【设计意图】:高一新生的程度参差不齐,化学基础差别较大,而本节的概念又比较抽象,所以本节--中的起点比较低,适当增加了实验和电脑动画以使微观离子的活动变得直观。
新课程标准的核心是要学生参与到知识学习的整个过程中来,亲历学习探究的过程,这也是本节--的目的。
【教学方法】:边讲边实验
【教具】:多媒体电脑投影设备、必须的实验仪器和药品(本节在实验室上)
【课时安排】:第一课时酸、碱、盐在水中的电离
第二课时离子反应及其发生的条件
【教学过程】:
第一课时酸、碱、盐在水中的电离
教师活动
学生活动
设计意图
2. 请同学们用药匙各取少量在滤纸上将它们混合,观察有什么现象。
3. 请同学们将上述混合物倒入小烧杯中,加入适量蒸馏水,用玻璃棒搅拌,静置,观察有什么现象。
4. 猜想发生了什么反应,试一试写出化学方程式
2. 学生操作后:没有现象
3. 学生操作后:有蓝色固体
使学生初步认识到固体间不能反应物质,在溶于水后能反应
2. 请同学们将上述两个烧杯中的溶液混合,观察现象。
2. 学生操作后:有蓝色固体生成
3. 学生有各种各样的回答
(教师进行分析和总结)
使学生认识到物质溶于水时发生了一些变化。
2. 电脑演示动画,氯化钠固体溶于水变成自由移动离子的过程
3. 讲解:物质在溶液中,离解成自由移动离子的过程,就是电离
5. 指导学生将氯化钠溶液分别换成盐酸、氢氧化钠溶液、氯化铜溶液、硫酸钠溶液、氯化钡溶液、酒精溶液等做导电实验
6. 讲解:由于发生电离后,生成的离子以水合的离子的形式存在,有些水合离子能显示出不同于化合物的颜色,如,水合铜离子是蓝色的,水合铁离子是黄色的等。
7. 讨论:哪些物质能发生电离我们是否有必要对每一种物质都做导电性实验呢(提醒化学中的分类意义)
1.学生操作后:氯化钠溶液导电、蔗糖溶液不导电
2.学生思考溶液导电的实质
3.学生讨论
4.学生练习
naoh = na+ + oh-
na2so4 = 2na+ + so42-
6. 学生议论后:知道氯化铜溶液的颜色是由于含有水合铜离子的原因,氯化铁溶液的颜色是由于含有水合铁离子的原因。
7. 学生讨论:酸、碱、盐能电离;蔗糖、酒精不能电离
(教师分析和总结)
从宏观实验转入微观电离的认识。
强调水子可以将一些物质“拆”开。
使学生认识到一些物质溶于水被“拆”成了阴、阳离子。
使学生熟悉电离方程式的书写形式,注意纠正一些错误写法。
使学生深刻认识到科学分类的意义
1.讲解:不是所有物质都能在水中发生电离,我们把这些能电离的化合物叫电解质,不能电
离的化合物叫非电解质。
电解质的水溶液中由于存在电离出的阴、阳离子,所以能导电。
非电解质由于不能向溶液中提供阴、阳离子,所以溶液不导电。
2.讨论:根据我们刚才所做的实验,我们所学过的哪些类的化合物是电解质
3.讨论:我们给出的电解质的概念和课本有什么不同
4.讲解:象baso4这样的盐由于难溶于水,其水溶液中电离出的阴、阳离子极少,所以几
乎不能导电。
但我们将其融化后,baso4仍能电离导电。
所以,baso4仍属于电解质。
5.讨论用树状分类法画出物质的的分类图
7.作业:(略)
1.学生理解
2.学生讨论后:酸、碱、盐是电解质;蔗糖、酒精是非电解质
3.学生讨论后:书上还有熔融的条件
4.学生写出电离方程式baso4=ba2+ +so42-
5.学生练习
6.学生练习
(教师分析指导)
这一部分虽然属于概念的讲解,但由于做了很多实验,有了先前的铺垫,所以这样的结论也不显得突兀。
【教学后记】:本课时的教学内容分为紧密联系、层次递进的四个模块来进行:1.物质间的反应是怎样实现的→2.物质在水中的反应→3.物质的电离→4.电解质。
概念虽然抽象,但以实验为基础,从实验得结论就显得很自然,整个学习过程使学生主动参与进来,教师不是告诉学生概念,而是由学生自己得出结论,教师负责使其准确而科学。
整个学习过程体现了新课程标准的要求。