原发性醛固酮增多症专家共识
- 格式:ppt
- 大小:3.17 MB
- 文档页数:31


原发性醛固酮增多症诊断中CXCR4受体显像的临床应用专家共识(2022)原发性醛固酮增多症(下文简称“原醛症”)是指肾上腺皮质自主分泌过量醛固酮,以致肾素-血管紧张素系统活性被抑制,患者出现以高血压伴或不伴低血钾为主要特征的临床综合征[1]。
醛固酮瘤(APA)和特发性醛固酮增多症(IHA)是原醛症最主要的亚型,分别约占原醛症的35%和60%。
其他少见类型包括原发性肾上腺皮质增生、家族性醛固酮增多症、分泌醛固酮的肾上腺皮质癌及异位醛固酮分泌瘤或癌[2]。
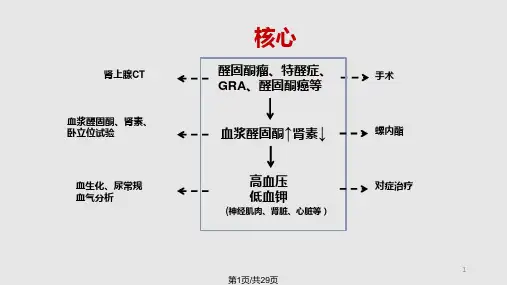
原醛症的分型诊断,尤其APA与IHA的鉴别,一直是原醛症诊疗过程中的重点和难点。
现阶段对于原醛症的分型诊断主要依据肾上腺影像学及肾上腺静脉插管采血(AVS)判断病灶位置及功能性。
CT 是首选的肾上腺影像学检查手段,有助于明确单侧/双侧肾上腺病变及病灶位置。
国际指南指出,合并自发性低钾血症、醛固酮明显高分泌且CT检查结果符合单侧肾上腺皮质腺瘤的年轻患者(年龄<35岁),可直接手术而无需行AVS检测[1]。
国内研究显示,对于伴低钾血症的患者,如CT提示单侧孤立性低密度腺瘤(CT值<20 Hu),诊断APA的特异度达95%[3]。
但CT易漏诊长径<1 cm的小腺瘤或结节,且该检查不能提供功能信息,无法鉴别分泌醛固酮的功能性病灶和肾上腺无功能瘤。
总体而言,CT对于原醛症分型诊断的准确度为60%~70%。
AVS被认为是原醛症分型的“金标准”,可明确是否存在单侧优势分泌,其识别优势分泌侧的灵敏度为95%,特异度为100%[4]。
但AVS属于有创检查,且价格昂贵、需要住院检查、操作难度较大、插管有失败和术后并发症风险,故很难在各级医院大规模开展。
此外,目前国内外尚缺乏统一的AVS评估标准,不同研究中心在AVS操作方式、结果判读方面存在差异;且虽然AVS 可区分单侧和双侧病变,但单侧醛固酮优势分泌并非APA的特异性表现,如单侧肾上腺增生、不对称分泌的双侧肾上腺增生,在AVS检测中均可呈现为单侧优势分泌。

原发性醛固酮增多症的病因、表现、诊断及治疗(一)定义原发性醛固酮增多症(primary aldosteronism,PA)以高血压、低血钾、低血浆肾素及高血浆醛固酮水平为主要特征,因肾上腺皮质肿瘤或增生等原因引起的醛固酮分泌过多所致的继发性高血压。
(二)病因目前已知有以下类型,即肾上腺皮质醛固酮分泌腺瘤(APA)、肾上腺皮质球状带增生(特发性醛固酮增多症,idiopathic hyperaldosteronism,IHA)、分泌醛固酮的肾上腺皮质癌、原发性肾上腺增生症、家族性醛固酮增多症(包括糖皮质激素可抑制性醛固酮增多症,GRA等)、异位醛固酮分泌腺瘤或癌等,其中以APA(35%)及IHA(60%)最为常见。
(三)临床表现1.高血压(1)最早出现的症状,几乎见于每一病例的不同阶段。
(2)中等度血压增高,以舒张压升高为著。
(3)对常规降压药疗效差。
2.低血钾、高尿钾可能只存在于较严重的病例中。
只有50%的腺瘤和17%的增生患者血钾小于3.5mmol/L,是病程相对较长的提示,因此没有低血钾不代表不是原醛症!血钾3.0~3.5mmol/L时,尿钾大于25mmol/24h;或血钾小于3.0mmol/L时,尿钾大于20mmol/24h,提示肾性失钾。
临床上表现为肌无力、发作性软瘫及周期性瘫痪等。
长期低钾血症可引起肾小管空泡变性,可表现为口渴、多尿、夜尿增多等。
心脏方面可表现为心律失常,心电图示U波或ST-T波改变。
3.其他低钾血症可导致细胞外液碱中毒→游离钙减少,促进肾脏排镁、排钙增加,均可导致手足抽搐、肢体麻木。
(四)诊断1.需满足如下条件(1)高醛固酮:醛固酮分泌增多并且不被高钠负荷引起的血容量增加所抑制。
(2)低肾素:肾素分泌受抑制并且不因立位及低钠刺激而分泌增加。
(3)皮质醇水平正常。
2.诊断分为两个步骤首先明确是否有高醛固酮、低肾素血症;然后确定其病因类型,即先定性,后定位。
(1)定性检查1)选择需要进行筛查的患者:当高血压患者有如下表现时要注意筛查有无原发性醛固酮增多症。


原发性醛固酮增多症诊断中CXCR4受体显像的临床应用专家共识(2022)中国医师协会泌尿外科医师分会肾上腺性高血压外科协作组;中华医学会内分泌学分会肾上腺学组;中华医学会核医学分会PET学组;张玉石;童安莉;霍力;丁洁;郑国洋;高寅洁【期刊名称】《协和医学杂志》【年(卷),期】2022(13)6【摘要】原发性醛固酮增多症的分型诊断是临床工作的重点和难点,越来越多的临床证据表明,靶向CXCR4的^(68)Ga-Pentixafor PET/CT核素显像可辅助原发性醛固酮增多症的分型。
基于国内外最新研究证据,经多学科专家组深入讨论,在核素显像方法和结果判读,以及其对治疗方案的指导和预后评估方面达成了一致意见。
本共识为规范国内^(68)Ga-Pentixafor PET/CT显像,提高我国原发性醛固酮增多症诊疗水平提供了重要依据。
【总页数】6页(P986-991)【作者】中国医师协会泌尿外科医师分会肾上腺性高血压外科协作组;中华医学会内分泌学分会肾上腺学组;中华医学会核医学分会PET学组;张玉石;童安莉;霍力;丁洁;郑国洋;高寅洁【作者单位】不详;中国医学科学院北京协和医院泌尿外科;中国医学科学院北京协和医院内分泌科;中国医学科学院北京协和医院核医学科;北京协和医院核医学科;北京协和医院泌尿外科;北京协和医院内分泌科【正文语种】中文【中图分类】R586.24【相关文献】1.应用ROC曲线评价醛固酮肾素比值对原发性醛固酮增多症诊断的临床意义2.探讨血浆醛固酮肾素活性比值(ARR)在原发性醛固酮增多症(PA)诊断中的临床价值3.血浆醛固酮/肾素活性比值与血清钾在原发性醛固酮增多症诊断中的临床意义4.原发性醛固酮增多症的功能分型诊断:肾上腺静脉采血专家共识5.整合素RGD受体显像临床应用专家共识(2022版)因版权原因,仅展示原文概要,查看原文内容请购买。

2021年原发性醛固酮增多症指南解读(全文)原醛并非良性高血压,危害更为严重原醛的定义为肾上腺皮质自主分泌醛固酮,导致体内潴钠排钾,血容量增多,肾素-血管紧张素系统活性受抑制,临床主要表现为高血压和低血钾。
醛固酮过多是导致心肌肥厚、心力衰竭和肾功能受损的重要危险因素,与原发性高血压患者相比,原醛症患者心脏、肾脏等高血压靶器官损害更为严重,来自我国台湾省的研究显示:在相同血压水平下,原醛患者较原发性高血压患者:➤脑卒中风险增加2.2-4.2倍;➤心律失常风险增加5.0-12.1倍;➤心衰风险增加2.9-10.3倍。
因此,对原醛的早期诊断、早期治疗非常重要。
原醛在高血压人群中的患病率超过5%国外报道中,在1、2、3级高血压患者中,原醛患病率分别为1.99%、8.02%和13.2%;而在难治性高血压患者中,其患病率更高约为17%~23%。
在亚洲普通高血压人中,其患病率约为5%。
2010年由中华医学会内分泌学分会牵头,在全国11个省19个中心对1656例难治性高血压患者进行了原醛症的筛查,报道其患病率为7.1%。
李启富教授团队发表的研究表明,原醛症在新诊断高血压中的发生率超过4.0%。
综合来看,原醛在高血压人群中的患病率为5%-10%。
国内外指南/共识解读与对比接下来,窦教授就筛查对象、方法、确诊实验、分型和治疗方法选择方面,对2020年中国CSE共识、2020年欧洲高血压学会共识、2017年台湾省共识和2016年美国指南作出了解读对比。
一、筛查对象表1 筛查对象窦教授指出,在筛查对象方面,我国共识与国外指南很大不同一点在于:我国将新诊断的高血压患者纳入到原醛筛查人群,这是因为,我国原醛症在新诊断高血压中的发生率已超过4.0%。
二、筛查方法及影响因素管控1.筛查方法与切点主要为放射免疫法、化学发光免疫分析法检测ARR。
但各版本指南、共识切入点不一。
表2 不同指南/共识推荐的ARR阳性切点2.对影响因素管控年龄、性别、饮食、服用药物、体位、血钾及肌酐等都有可能影响ARR 数值,导致假阳性或假阴性结果,尤其需对使用的药物进行关注。
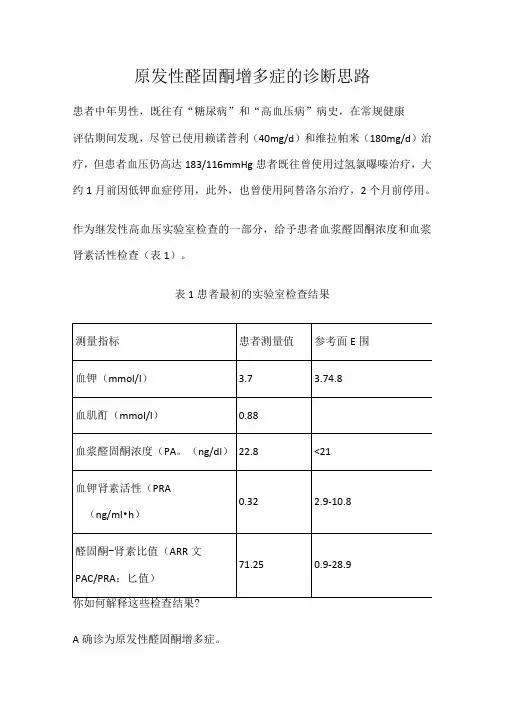
原发性醛固酮增多症的诊断思路患者中年男性,既往有“糖尿病”和“高血压病”病史,在常规健康评估期间发现,尽管已使用赖诺普利(40mg/d)和维拉帕米(180mg/d)治疗,但患者血压仍高达183/116mmHg患者既往曾使用过氢氯曝嗪治疗,大约1月前因低钾血症停用,此外,也曾使用阿替洛尔治疗,2个月前停用。
作为继发性高血压实验室检查的一部分,给予患者血浆醛固酮浓度和血浆肾素活性检查(表1)。
表1患者最初的实验室检查结果你如何解释这些检查结果?A确诊为原发性醛固酮增多症。
B提示为原发性醛固酮增多症,但仍需进一步影像学检查来确诊。
C提示为原发性醛固酮增多症,但确诊需要进行醛固酮抑制试验。
D这个结果不可靠,ARRE在停用赖诺普利1月后再测量。
答案是C,提示为原发性醛固酮增多症,但确诊需要进行醛固酮抑制试验。
原发性醛固酮增多症的实验室检查特点原发性醛固酮增多症是以醛固酮过度分泌为特征,所有高血压患者中5%-13%!能为原发性醛固酮增多症。
当前推荐的筛查试验是测量血浆醛固酮浓度(PAC和血浆肾素活性(PRA,计算醛固酮-肾素比值(AR破PAC/PRA:匕值)。
尽管尚无异常PAC/PRA:匕值的确切阈值,目前最常采用患者PAC>15ng/dl时,PAC/PRA:匕值>30来筛查原发性醛固酮增多症。
这些阈值是基于1993年一项回顾性研究,该研究显示,在高血压患者中使用这些阈值筛查肾上腺腺瘤的敏感性为90%特异性为91%然而,由于PA5口ARRS多种因素的影响,包括药物、性别、月经周期、体位、时辰、饮食和是否有肾脏疾病等,因此,美国内分泌协会指南推荐临床医师结合患者临床背景评估这些检查数据,同时,他们也认识到低肾素水平会增加PAC/PR妣值假阳性升高的可能性。
表2可能会影响PAC/PRAt匕值的临床条件同时,美国内分泌协会指南强调,如果需要,患者应补钾,而且,根据专家意见共识,停用可影响肾素-血管紧张素-醛固酮系统的药物至少2周。



原发性醛固酮增多症诊断治疗的专家共识前言为了规范原发性醛固酮增多症(primary aldostero-nism,简称原醛症)的诊断和治疗,中华医学会内分泌学分会肾上腺学组经专家讨论,完成了本专家共识。
本共识采用国际上通用的表述推荐强度及证据质量的方法。
强烈推荐使用'推荐'和数字1,较弱推荐使用'建议'和数字2表示。
证据质量:●○○○,表示极低质量证据;●●○○,表示低质量证据;●●●○,表示中等质量证据;●●●●,表示高质量证据。
通常按照强的推荐规范进行处理利大于弊,'弱推荐'则需要依据患者个体情况来决定最佳方案。
原醛症概况一、定义原醛症指肾上腺皮质分泌过量醛固酮,导致体内潴钠排钾,血容量增多,肾素-血管紧张素系统活性受抑。
临床主要表现为高血压伴低血钾。
研究发现,醛固酮过多是导致心肌肥厚、心力衰竭和肾功能受损的重要危险因素,与原发性高血压患者相比,原醛症患者心脏、肾脏等高血压靶器官损害更为严重。
因此,早期诊断、早期治疗就显得至关重要。
二、患病率过去几十年,原醛症一直被认为是少见病,在高血压人群中不到1%。
随着诊断技术的提高,特别是将血浆醛固酮与肾素活性比值(ARR)作为原醛症筛查指标后,使相当一部分血钾正常的原醛症患者得以发现并确诊。
国外报道在1、2、3级高血压患者中原醛症患病率分别为1.99%、8.02%和13.2%[1];而在难治性高血压患者中,其患病率更高,约为17%~23%[2]。
国内相关研究报道较少,在亚洲普通高血压人群中其患病率约为5%[3]。
2010年由中华医学会内分泌分会牵头在全国11个省19个中心对1 656例难治性高血压患者进行了原醛症的筛查,首次报道其患病率为7.1%[4]。
由此可见,对高血压特别是难治性高血压人群进行原醛症的筛查对临床工作有着现实的指导意义。
三、病因分类原醛症主要分为5型,即醛固酮瘤(aldosterone-producing adenoma)、特发性醛固酮增多症(idiopathic hyperaldosteronism,特醛症)、原发性肾上腺皮质增生(primary adrenal hyperplasia)、家族性醛固酮增多症(familial hyperaldosteronism)、分泌醛固酮的肾上腺皮质癌(aldosterone-producing adrenocortical carcinoma)及异位醛固酮分泌瘤或癌(ectopic aldosterone-producing adenoma or carcinoma,表1)。
《高血压患者中原发性醛固酮增多症检出、诊断和治疗的指导意见》(2021)要点原发性醛固酮增多症(PA)是由于肾上腺皮质病变分泌过多醛固酮,导致潴钠排钾、容量负荷增加,以高血压、低血钾、低肾素、高醛固酮为典型表现的临床症候群,是一种常见的内分泌性高血压。
有荟萃分析显示:与原发性高血压相比,PA可增加脑卒中患病风险2.58倍、冠状动脉疾病1.77倍、心房颤动3.52倍、心力衰竭2.05倍,使糖尿病、代谢综合征及左心室肥厚的风险分别增加1.33、1.53及2.29倍。
要点1:PA在高血压中的患病率为4%~13%,是十分常见的继发性高血压;常表现为难治性高血压,更易于引起主动脉夹层、严重心律失常、脑卒中、肾功能衰竭等严重并发症。
醛固酮分泌瘤(APA)、特发性醛固酮增多症(IHA)是其最常见的类型;高血压、低血钾和肾上腺肿瘤或增生是典型PA的重要临床表现,但低血钾和肾上腺CT的阳性报告率均不足50%,因此所有高血压患者都应警惕PA的可能性。
1PA在高血压患者中的患病率及检出现状以往认为PA是一种少见的内分泌性高血压,在高血压患者中不足1%,随着认识水平和诊断技术的提高,近40年来PA的检出率增加了近10倍。
2 病因分类PA的分型及病因构成见表1,以APA和IHA最为常见,单侧肾上腺增生次之,其余亚型少见。
3PA的临床表现PA好发于20~60岁的成人,绝大多数以高血压为首发症状,往往血压早期尚可控制,逐渐进展为中重度高血压或难治性高血压,对常用的降压药物治疗反应差。
低血钾是PA的重要生化表现,但所占比例不足40%;长期低血钾可导致烦渴、多尿、夜尿增多,严重时可引起周期性肌无力、呼吸肌麻痹;当合并代谢性碱中毒时可出现肢端麻木、手足搐搦及肌肉痉挛等表现。
肾上腺肿瘤或增生是PA的典型影像学表现,CT可识别直径>6mm的典型腺瘤,直径<6mm的微腺瘤容易漏诊,CT表现为典型腺瘤的比例为25%~50%;超声仅可显示直径>1.0cm的腺瘤,难以发现肾上腺微小腺瘤和增生。