激活剂与抑制剂对酶促反应的影响
- 格式:ppt
- 大小:236.00 KB
- 文档页数:6

激活剂和抑制剂对酶活性影响实验报告
影响酶作用的因素:影响酶促反应的因素常有酶的浓度、底物浓度、pH值、温度、抑制剂、激活剂等。
其变化规律有以下特点:
1、酶浓度对酶促反应的影响:在底物足够,其它条件固定的条件下,反应系统中不含有抑制酶活性的物质及其它不利于酶发挥作用的因素时,酶促反应的速度与酶浓度成正比。
2、底物浓度对酶促反应的影响:在底物浓度较低时,反应速度随底物浓度增加而加快,反应速度与底物浓度近乎成正比,在底物浓度较高时,底物浓度增加,反应速度也随之加快,但不显著,当底物浓度很大且达到一定限度时,反应速度就达到一个最大值,此时即使再增加底物浓度,反应也几乎不再改变。
3、酶的活性受激活剂或抑制剂的影响。
氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂,激活剂使酶的活性升高,抑制剂使酶活性降低。
注意事项:
激活剂和抑制剂对于酶活性的影响,常常分不清激活剂,因为加入蒸馏水、NaCl、Na2SO4这3支试管的颜色一致,都是黄色。
出现这种现象的原因是酶活性太高了,需要稀释唾液,唾液稀释至加入蒸馏水的试管呈浅红色即可。
这样一来,这3支试管的颜色分别是浅红、黄、浅红,就可以断定Cl-是激活剂。
偶尔也有分不清抑制剂的就是加入蒸馏水、CuSO4、
Na2SO4这三支试管的颜色一致,都是蓝色。
因为酶活性太低,需要提高酶活性,只要重新制备唾液淀粉酶就行(但是新酶的活性不可太高,否则又分不清激活剂)。
最后3支试管的颜色应该是浅红、蓝、浅红,可以断定Cu2+是抑制剂。

影响酶促反应的因素——温度,ph,激活剂及抑制剂,生化实验报告(共8篇) 影响酶促反应速度的因素生化实验实验二影响酶促反应速度的因素【目的】观察温度、PH、激活剂、抑制剂对酶促反应速度的影响。
【原理】唾液淀粉酶催化淀粉水解,生成一系列水解产物,即糊精、麦芽糖和葡萄糖等。
淀粉及其水解产物遇碘会呈现不同的颜色。
在不同温度,不同PH值下,唾液淀粉酶活性不同,催化淀粉水解程度不一,生成的产物也就不同。
此外,激活剂、抑制剂也能影响淀粉酶活性,影响淀粉的水解。
因此可根据在不同反应条件下,溶液加碘呈现的不同颜色来判断淀粉的水解程度,从而验证了温度、pH、激活剂、抑制剂对酶促反应速度的影响。
淀粉I2 【操作】1. 温度对酶促反应速度的影响取3支试管,编号,按下表操作:2. PH对酶促反应速度的影响取3支试管,编号,按下表操作:3.激活剂与抑制剂对酶促反应速度的影响取4支试管,编号,按下表操作:【结果及分析】观察各管颜色变化,说明温度、pH、激活剂、抑制剂对酶促反应的影响。
【实验注意事项】篇二:生化实验思考题参考答案生化实验讲义思考题参考答案实验一淀粉的提取和水解1、实验材料的选择依据是什么?答:生化实验的材料选择原则是含量高、来源丰富、制备工艺简单、成本低。
从科研工作的角度选材,还应当注意具体的情况,如植物的季节性、地理位置和生长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和生理状态等,微生物材料要注意菌种的代数和培养基成分的差异等。
2、材料的破碎方法有哪些?答:(1) 机械的方法:包括研磨法、组织捣碎法;(2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等;(3) 化学与生物化学方法:包括溶胀法、酶解法、有机溶剂处理法等。
实验二总糖与还原糖的测定1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定方法各有何优缺点?答: 我们采用的是碱性铜试剂法中的间接法测定还原糖的含量。
间接法的优点是操作简便、反应条件温和,缺点是在生成单质碘和转移反应产物的过程中容易引入误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。

实验八酶促反应的影响因素一、目的要求1.了解温度、pH、激活剂、抑制剂对酶促反应速度的影响。
2.学习检定温度、pH、激活剂、抑制剂影响酶促反应速度的方法。
二、实验原理在酶促反应中,酶的催化活性与环境温度、 pH有密切关系,通常各种酶只有在一定的温度、pH范围内才表现它的活性,一种酶表现其活性最高时的温度、pH值称为该酶的最适温度、最适pH。
在酶促反应中,酶的激活剂和抑制剂可加速或抑制酶的活性,如氯化钠在低浓度时为唾液淀粉酶的激活剂,而硫酸铜则是它的抑制剂。
本实验利用淀粉水解过程中不同阶段的产物与碘有不同的颜色反应,定性观察唾液淀粉酶在酶促反应中各种因素对其活性的影响。
淀粉(遇碘呈蓝色)→紫色糊精(遇碘呈紫色)→红色糊精(遇碘呈红色)→无色糊精(遇碘不呈色)→麦芽糖(遇碘不呈色)→葡萄糖(遇碘不呈色)。
所以淀粉被唾液淀粉酶水解的程度,可由水解混合物遇碘呈现的颜色来判断,以此反映淀粉酶的活性,由此检定温度、pH、激活剂、抑制剂对酶促反应的影响。
三、实验器材试管和试管架、恒温水浴、冰浴、吸量管(1 mL6支、2 mL4支、5 mL4支)、滴管、量筒、玻棒、白瓷板、秒表、烧杯、棕色瓶。
四、实验试剂1.新鲜唾液稀释液(唾液淀粉酶液):每位同学进实验室自己制备,先用蒸馏水漱口,以清除食物残渣,再含一口蒸馏水,0.5 min后使其流入量筒并稀释至200倍(稀释倍数可因人而异)混匀备用。
2.1%淀粉溶液A(含0.3%NaCl):将1 g可溶性淀粉及0.3 g氯化钠混悬于5 mL蒸馏水中,搅动后,缓慢倒入沸腾的60 mL蒸馏水中,搅动煮沸1 min,冷却至室温,加水至100 mL,置冰箱中保存。
3.1%淀粉溶液B(不含NaCl)4.碘液:称取2 g碘化钾溶于5 mL蒸馏水中,再加入1 g碘,待碘完全溶解后,加蒸馏水295 mL,混匀贮于棕色瓶中。
5.1%NaCl溶液6.1%CuSO溶液47.缓冲溶液系统按下表混合配制。




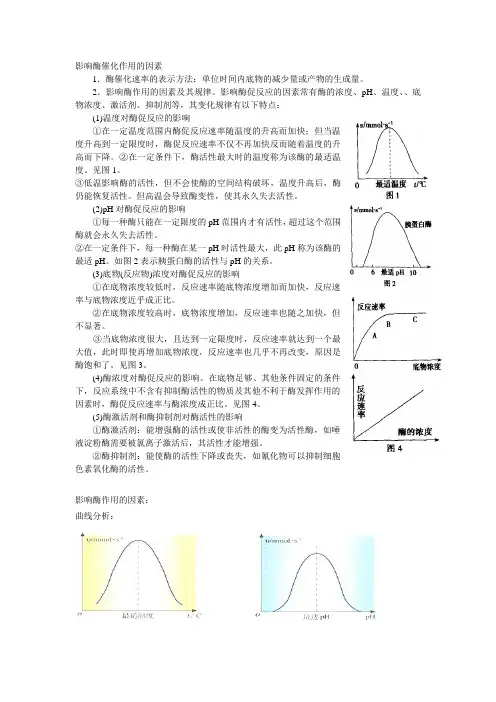
影响酶催化作用的因素1.酶催化速率的表示方法:单位时间内底物的减少量或产物的生成量。
2.影响酶作用的因素及其规律。
影响酶促反应的因素常有酶的浓度、pH、温度、、底物浓度、激活剂、抑制剂等,其变化规律有以下特点:(1)温度对酶促反应的影响①在一定温度范围内酶促反应速率随温度的升高而加快;但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而下降。
②在一定条件下,酶活性最大时的温度称为该酶的最适温度。
见图1。
③低温影响酶的活性,但不会使酶的空间结构破坏,温度升高后,酶仍能恢复活性。
但高温会导致酶变性,使其永久失去活性。
(2)pH对酶促反应的影响①每一种酶只能在一定限度的pH范围内才有活性,超过这个范围酶就会永久失去活性。
②在一定条件下,每一种酶在某一pH时活性最大,此pH称为该酶的最适pH。
如图2表示胰蛋白酶的活性与pH的关系。
(3)底物(反应物)浓度对酶促反应的影响①在底物浓度较低时,反应速率随底物浓度增加而加快,反应速率与底物浓度近乎成正比。
②在底物浓度较高时,底物浓度增加,反应速率也随之加快,但不显著。
③当底物浓度很大,且达到一定限度时,反应速率就达到一个最大值,此时即使再增加底物浓度,反应速率也几乎不再改变,原因是酶饱和了。
见图3。
(4)酶浓度对酶促反应的影响。
在底物足够、其他条件固定的条件下,反应系统中不含有抑制酶活性的物质及其他不利于酶发挥作用的因素时,酶促反应速率与酶浓度成正比。
见图4。
(5)酶激活剂和酶抑制剂对酶活性的影响①酶激活剂:能增强酶的活性或使非活性的酶变为活性酶,如唾液淀粉酶需要被氯离子激活后,其活性才能增强。
②酶抑制剂:能使酶的活性下降或丧失,如氰化物可以抑制细胞色素氧化酶的活性。
影响酶作用的因素:曲线分析:曲线含义的准确表述:B 点:该酶发挥催化作用的最适温度或最适pH 值AB 段:达到最适温度(pH 值)前,随着温度(pH 值)升高,酶的催化效率提高酶的最适pH 值往往随底物种类、浓度等的变化而不同,因此,并不是一个常数,只是在一定条件下才有意义。

温度、pH、激活剂、抑制剂对酶活性的影响(间接碘量法)(effects of temperature pH activitor and inhibitor to activity of enzyme)一、目的1.了解温度、pH、激活剂、抑制剂对酶活性的影响2.学习酶活性的判定二、原理酶活性大小可以用反应速度来表示,即在单位时间内,酶所催化底物的消耗量或产物的生成量来衡量。
酶活性大,反应速度就快。
反之则慢。
酶促反应速度受多种因素的影响。
如温度、pH、激活剂、抑制剂等。
本实验是观察在不同温度,pH,以及缺乏激活剂或有抑制剂的条件下唾液淀粉酶的活性大小。
借以验证各种因素对酶活性的影响。
唾液中含有唾液淀粉酶,此酶可以使淀粉逐步水解,最后生成麦芽糖。
麦芽糖具有还原性。
根据淀粉被唾液淀粉酶水解后产物的生成量(即还原性麦芽糖的多少)判定酶活性的大小。
用碘的反滴定法测定还原物的量,还原物多,酶活性大。
具体反应如下:1、试剂成分(S、H、S试剂):CuSO4、Na2CO3、NaHCO3、KI、KIO3、酒石酸钾钠、草酸钾。
2、判定酶活性大小的化学反应过程:Na2CO3 +2H2O —→2NaOH + H2CO3CuSO4+2NaOH —→Cu(OH)2↓+Na2SO45KI +KIO3 + 3H2SO4—→3I2+3K2SO4 +3H2O酶淀粉———→麦芽糖麦芽糖+Cu++—→麦芽糖氧化产物+Cu+Cu++ I2—→Cu++ + 2I-COO- 草酸钾COO-Cu+++|—————→| >CuCOO- 防止逆反应COO-剩余I2+Na2S2O3—→2I- +Na2S4O6(与淀粉呈兰色) (与淀粉无色)3、判定酶活性大小的标志酶活性大→麦芽糖多→Cu+ 生成量多→I2消耗量多→剩余I2少→Na2S2O3消耗量少酶活性越大,Na2S2O3消耗量越少。
空白实验无酶活性,因此Na2S2O3消耗量最多。
与空白实验进行对比,差值越大,说明此条件下酶活性越大。

酶的激活剂和抑制剂实验报告一、实验目的本实验旨在探究酶的激活剂和抑制剂对酶催化反应速率的影响,进一步了解酶的调节机制。
二、实验原理1. 酶的激活剂酶的激活剂是指能够增加酶催化反应速率的物质。
它们通常与酶结合后改变了酶分子构象,使其更容易与底物结合并产生催化作用。
常见的激活剂包括金属离子、辅因子等。
2. 酶的抑制剂酶的抑制剂是指能够降低或阻止酶催化反应速率的物质。
它们通常与酶结合后影响了其分子构象或活性中心,使其不能正常地与底物结合并发挥催化作用。
常见的抑制剂包括竞争性抑制剂、非竞争性抑制剂等。
三、实验步骤1. 预处理样品:将所需样品放入离心管中,并加入适量缓冲液进行混匀。
2. 加入试剂:根据不同实验要求,加入不同的酶激活剂或抑制剂。
3. 反应条件:将样品放入恒温水浴中,在适当的时间内进行反应。
4. 结果分析:通过检测反应产物的生成量或底物消耗量,计算酶催化反应速率,并比较不同实验条件下的结果。
四、实验结果1. 酶的激活剂实验通过添加金属离子(如Mg2+)等激活剂,可以明显提高酶催化反应速率。
例如,在酯水解反应中,加入Mg2+后,反应速率可增加数倍以上。
这是因为金属离子能够促进底物结合和酶分子构象变化,从而增强了催化作用。
2. 酶的竞争性抑制剂实验通过添加竞争性抑制剂(如甲状腺素)等,可以明显降低酶催化反应速率。
例如,在乳糖酸脱氢酶催化反应中,加入甲状腺素后,底物转化率可降低50%以上。
这是因为甲状腺素与底物结构相似,能够与酶结合并占据活性中心,从而阻止底物结合和酶催化反应。
3. 酶的非竞争性抑制剂实验通过添加非竞争性抑制剂(如草酸)等,同样可以降低酶催化反应速率。
例如,在过氧化氢酶催化反应中,加入草酸后,反应速率可降低30%以上。
这是因为草酸能够与酶结合并改变其分子构象,从而影响底物结合和催化作用。
五、实验结论本实验结果表明,不同的酶激活剂和抑制剂对酶催化反应速率有着显著的影响。
通过调节这些因素,可以有效地控制酶的活性和功能,并为生物学研究和工业生产提供重要的理论基础。

种因素。
在探讨各种因素对酶促反应速度的影响时,通常测定其初始速度来代表酶促反应速度,即底物转化量<5%时的反应速度。
影响酶促反应速度的因素包括:1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率影响的作图时呈矩形双曲线。
底物足够时,酶浓度对反应速率的影响呈直线关系。
2. 底物浓度:在其他因素不变的情况下,随着底物浓度的增加,反应速率也会相应增加。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对反应速率的影响具有双重性。
在适宜的温度范围内,随着温度的升高,反应速率加快。
但当温度过高时,酶的活性会受到抑制,反应速率反而下降。
5. 抑制剂和激活剂:抑制剂可逆或不可逆的降低酶促反应速率,而激活剂可加快酶促反应速率。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
酶促反应的动力学研究与探讨的是酶促反应的速率及影响酶促反应速率的各种因素。
其中,主要的因素包括酶浓度、底物浓度、pH值、温度、激活剂和抑制剂等。
1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率的影响呈矩形双曲线。
当底物浓度足够时,酶浓度对反应速率的影响则呈直线关系。
2. 底物浓度:在酶浓度不变的情况下,底物浓度的增加会促进反应速度的增加,但当底物浓度达到一定值后,再增加底物浓度对反应速度的影响不大。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对酶促反应速率的影响具有双重性。
在低温条件下,由于分子运动速度较慢,反应速度比较慢;随着温度的升高,分子运动速度加快,反应速度也会加快;但当温度升高到一定值后,过高的温度会使酶变性,反应速度反而下降。
5. 激活剂和抑制剂:激活剂可以加快酶促反应速度,而抑制剂可以降低酶促反应速度。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
实验四实验四 酶促反应动力学酶促反应动力学————pH pH pH、、温度温度、、激活剂激活剂、、抑制剂对酶促反应速度的影响抑制剂对酶促反应速度的影响目的目的::1.了解pH、温度、激活剂和抑制剂对酶活力的影响。
2.学习测定酶最适pH 的方法。
(一) pH 对酶活力的影响对酶活力的影响1.1.实验原理实验原理实验原理对环境酸碱度敏感是酶的特点之一。
对每一种酶来说,只能在一定pH 范围内才表现其活力,否则酶即失活。
另外,在这个有限pH 范围内,酶的活力也随着环境pH 的改变有所不同。
酶通常在某一pH 时,才表现最大活力。
酶表现最大活力时的pH 称为酶的最适pH。
一般酶的最适pH 在4~8之间。
淀粉遇碘呈蓝色。
糊精按其分子大小,遇碘可呈蓝色、紫色、暗褐色或红色。
最简单的糊精和麦芽糖遇碘不呈色。
在不同条件下,淀粉被唾液淀粉酶水解的程度可由水解混合物是遇碘呈现的颜色来判断。
本实验观察pH 对唾液淀粉酶活力的影响,唾液淀粉酶的最适pH 约为6.8。
2实验器材实验器材恒温水浴锅、试管、试管架、锥形瓶(50ml 或100ml)、吸量管(1、2、5、10ml)、秒表、白瓷板、pH 试纸、稀释50倍的新鲜唾液(在漏斗内塞入少量脱脂棉,下接洁净试管,嗽口后含一小口蒸馏水,半分钟后收集过滤唾液。
取滤液2ml 放入锥形瓶内,加蒸馏水稀释至100ml,充分混匀)。
3实验试剂实验试剂(1)新配制的溶于0.3%NaCl 的0.5%淀粉溶液称取可溶性淀粉0.5g,先用少量0.3%NaCl 溶液加热调成糊状,再用热的0.3%NaCl 溶液稀释至100ml。
(2)0.2mol/L Na 2HPO 4溶液称取Na 2HPO 4·7H 2O 53.65g(或Na 2HPO 4·12H 2O 71.7g),溶于少量蒸馏水中,移入1000ml 容量瓶,加蒸馏水稀释到刻度。
(3)0.1mol/L 柠檬酸溶液称取含一个水分子的柠檬酸21.01g,溶于少量蒸馏水中,移入1000ml 容量瓶,加蒸馏水至刻度。
酶的反应速率影响因素
酶促反应又称酶催化或酵素催化作用,指的是由酶作为催化剂进行催化的化学反应。
生物体内的化学反应绝大多数属于酶促反应。
酶促反应的影响因素主要有温度、酶浓度、底物浓度、抑制剂及激活剂等。
1.其他条件不变,酶促反应在最适温度范围内,反应速率随着温度的增加而加快,当温度增加到最适温度时,酶促反应达到最快反应速率,此时不会随着温度的升高而变化。
2.其他条件不变,酶的浓度越高,酶促反应速率越快,在底物充足的条件下,酶促反应速率随着酶浓度的增加而加快。
3.其他条件不变,酶促反应速率在一定底物浓度范围内,随着底物浓度的增加而加快,当底物浓度增加到最适浓度时,此时反应速率已达到最快,不会再变化。
4.抑制剂能够抑制酶的活性从而降低酶促反应速率;激活剂能够激活酶的活性从而加快酶促反应速率。
实验酶促反应的影响因素此实验可以根据酶的特性,设计影响酶促反应的各种因素,并进行实验检验。
(一)酶的激活剂和抑制剂一、实验目的1.了解酶促反应的激活与抑制。
2.学习鉴定激活剂和抑制剂影响酶反应的方法和原理。
二、实验原理酶的活性常受某些物质的影响,有些物质能使酶的活性增加,称为酶的激活剂;有些物质能使酶的活性降低,称为酶的抑制剂。
例如,氯化钠为唾液淀粉酶的激活剂,硫酸铜为其抑制剂。
通常少量的激活剂或抑制剂就会影响酶的活性,而且常具有特异性。
但是,值得注意的是激活剂和抑制剂不是绝对的,有些物质在低浓度时为某种酶的激活剂,而在高浓度时则为该酶的抑制剂。
例如氯化钠达到1/3饱和度时就可抑制唾液淀粉酶的活性。
三、器材1.试管及试管架 2.烧杯、椎形瓶和量筒(100mL)3.玻璃漏斗 4.吸管 5.滤纸 6.恒温水浴锅四、试剂1. 1% 淀粉溶液2.稀释100~200倍的新鲜唾液3. 1%氯化钠溶液4.0.1 %硫酸铜溶液5.碘化钾-碘溶液:将碘化钾20g 和碘10g 溶于100 mL水中,使用前稀释10倍。
五、操作方法取3支试管,向第一支试管中加入1%氯化钠溶液1 mL,向第二支试管中加入 0.1%硫酸铜溶液1 mL,向第3支试管中加入蒸馏水1mL作对照。
再向每支试管各加入 0.1%淀粉溶液3 mL和稀释的唾液1 mL。
摇匀各管,充分混合,一起放入37℃恒温水浴中保温10~15分钟后取出。
冷却后,各滴入2-3滴碘化钾-碘溶液。
混匀。
观察比较3支试管颜色的深浅,并解释之。
如果激活剂或抑制剂的作用不明显,主要可能原因是唾液淀粉酶的活性不够高,可以适当延长反映时间或者降低唾液稀释的倍数。
思考题1.激活剂可以分为哪几类?本实验中氯化钠属于其中的哪一类?2.抑制剂和变性剂有什么不同?试举例说明。
3.酶反应的抑制作用有哪些类型?根据什么划分的?它们都有什么特点?(二)温度对酶活性的影响一、实验目的通过检验不同温度下唾液淀粉酶的活性,了解温度对酶活性的影响。