抑制剂对酶促反应的影响
- 格式:ppt
- 大小:708.50 KB
- 文档页数:43

激活剂和抑制剂对酶活性影响实验报告
影响酶作用的因素:影响酶促反应的因素常有酶的浓度、底物浓度、pH值、温度、抑制剂、激活剂等。
其变化规律有以下特点:
1、酶浓度对酶促反应的影响:在底物足够,其它条件固定的条件下,反应系统中不含有抑制酶活性的物质及其它不利于酶发挥作用的因素时,酶促反应的速度与酶浓度成正比。
2、底物浓度对酶促反应的影响:在底物浓度较低时,反应速度随底物浓度增加而加快,反应速度与底物浓度近乎成正比,在底物浓度较高时,底物浓度增加,反应速度也随之加快,但不显著,当底物浓度很大且达到一定限度时,反应速度就达到一个最大值,此时即使再增加底物浓度,反应也几乎不再改变。
3、酶的活性受激活剂或抑制剂的影响。
氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂,激活剂使酶的活性升高,抑制剂使酶活性降低。
注意事项:
激活剂和抑制剂对于酶活性的影响,常常分不清激活剂,因为加入蒸馏水、NaCl、Na2SO4这3支试管的颜色一致,都是黄色。
出现这种现象的原因是酶活性太高了,需要稀释唾液,唾液稀释至加入蒸馏水的试管呈浅红色即可。
这样一来,这3支试管的颜色分别是浅红、黄、浅红,就可以断定Cl-是激活剂。
偶尔也有分不清抑制剂的就是加入蒸馏水、CuSO4、
Na2SO4这三支试管的颜色一致,都是蓝色。
因为酶活性太低,需要提高酶活性,只要重新制备唾液淀粉酶就行(但是新酶的活性不可太高,否则又分不清激活剂)。
最后3支试管的颜色应该是浅红、蓝、浅红,可以断定Cu2+是抑制剂。


实验八酶促反应的影响因素一、目的要求1.了解温度、pH、激活剂、抑制剂对酶促反应速度的影响。
2.学习检定温度、pH、激活剂、抑制剂影响酶促反应速度的方法。
二、实验原理在酶促反应中,酶的催化活性与环境温度、 pH有密切关系,通常各种酶只有在一定的温度、pH范围内才表现它的活性,一种酶表现其活性最高时的温度、pH值称为该酶的最适温度、最适pH。
在酶促反应中,酶的激活剂和抑制剂可加速或抑制酶的活性,如氯化钠在低浓度时为唾液淀粉酶的激活剂,而硫酸铜则是它的抑制剂。
本实验利用淀粉水解过程中不同阶段的产物与碘有不同的颜色反应,定性观察唾液淀粉酶在酶促反应中各种因素对其活性的影响。
淀粉(遇碘呈蓝色)→紫色糊精(遇碘呈紫色)→红色糊精(遇碘呈红色)→无色糊精(遇碘不呈色)→麦芽糖(遇碘不呈色)→葡萄糖(遇碘不呈色)。
所以淀粉被唾液淀粉酶水解的程度,可由水解混合物遇碘呈现的颜色来判断,以此反映淀粉酶的活性,由此检定温度、pH、激活剂、抑制剂对酶促反应的影响。
三、实验器材试管和试管架、恒温水浴、冰浴、吸量管(1 mL6支、2 mL4支、5 mL4支)、滴管、量筒、玻棒、白瓷板、秒表、烧杯、棕色瓶。
四、实验试剂1.新鲜唾液稀释液(唾液淀粉酶液):每位同学进实验室自己制备,先用蒸馏水漱口,以清除食物残渣,再含一口蒸馏水,0.5 min后使其流入量筒并稀释至200倍(稀释倍数可因人而异)混匀备用。
2.1%淀粉溶液A(含0.3%NaCl):将1 g可溶性淀粉及0.3 g氯化钠混悬于5 mL蒸馏水中,搅动后,缓慢倒入沸腾的60 mL蒸馏水中,搅动煮沸1 min,冷却至室温,加水至100 mL,置冰箱中保存。
3.1%淀粉溶液B(不含NaCl)4.碘液:称取2 g碘化钾溶于5 mL蒸馏水中,再加入1 g碘,待碘完全溶解后,加蒸馏水295 mL,混匀贮于棕色瓶中。
5.1%NaCl溶液6.1%CuSO溶液47.缓冲溶液系统按下表混合配制。



温度、pH、激活剂、抑制剂对酶活性的影响(间接碘量法)(effects of temperature pH activitor and inhibitor to activity of enzyme)一、目的1.了解温度、pH、激活剂、抑制剂对酶活性的影响2.学习酶活性的判定二、原理酶活性大小可以用反应速度来表示,即在单位时间内,酶所催化底物的消耗量或产物的生成量来衡量。
酶活性大,反应速度就快。
反之则慢。
酶促反应速度受多种因素的影响。
如温度、pH、激活剂、抑制剂等。
本实验是观察在不同温度,pH,以及缺乏激活剂或有抑制剂的条件下唾液淀粉酶的活性大小。
借以验证各种因素对酶活性的影响。
唾液中含有唾液淀粉酶,此酶可以使淀粉逐步水解,最后生成麦芽糖。
麦芽糖具有还原性。
根据淀粉被唾液淀粉酶水解后产物的生成量(即还原性麦芽糖的多少)判定酶活性的大小。
用碘的反滴定法测定还原物的量,还原物多,酶活性大。
具体反应如下:1、试剂成分(S、H、S试剂):CuSO4、Na2CO3、NaHCO3、KI、KIO3、酒石酸钾钠、草酸钾。
2、判定酶活性大小的化学反应过程:Na2CO3+2H2O —→2NaOH + H2CO3CuSO4+2NaOH —→Cu(OH)2↓+ Na2SO45KI +KIO3 + 3H2SO4—→3I2+3K2SO4 +3H2O酶淀粉———→麦芽糖麦芽糖+Cu++—→麦芽糖氧化产物+Cu+ Cu++ I2—→Cu++ + 2I-COO- 草酸钾COO-Cu+++|—————→| >CuCOO- 防止逆反应COO-剩余I2 + Na2S2O3—→2I- + Na2S4O6(与淀粉呈兰色) (与淀粉无色)3、判定酶活性大小的标志酶活性大→麦芽糖多→Cu+ 生成量多→I2消耗量多→剩余I2少→Na2S2O3消耗量少酶活性越大,Na2S2O3消耗量越少。
空白实验无酶活性,因此Na2S2O3消耗量最多。
与空白实验进行对比,差值越大,说明此条件下酶活性越大。
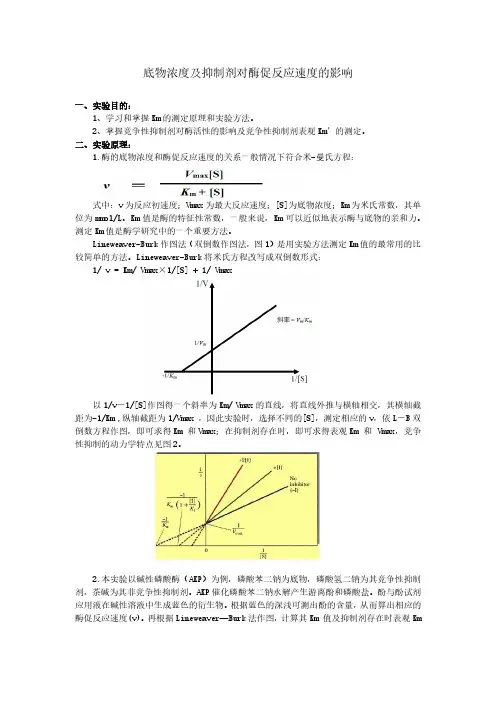
底物浓度及抑制剂对酶促反应速度的影响一、实验目的:1、学习和掌握Km的测定原理和实验方法。
2、掌握竞争性抑制剂对酶活性的影响及竞争性抑制剂表观Km’的测定。
二、实验原理:1.酶的底物浓度和酶促反应速度的关系一般情况下符合米-曼氏方程:式中:v为反应初速度;Vmax为最大反应速度;[S]为底物浓度;Km为米氏常数,其单位为mmol/L。
Km值是酶的特征性常数,一般来说,Km可以近似地表示酶与底物的亲和力。
测定Km值是酶学研究中的一个重要方法。
Lineweaver-Burk作图法(双倒数作图法,图1)是用实验方法测定Km值的最常用的比较简单的方法。
Lineweaver-Burk将米氏方程改写成双倒数形式:1/ v = Km/ Vmax×1/[S] + 1/ Vmax以1/v-1/[S]作图得一个斜率为Km/ Vmax的直线,将直线外推与横轴相交,其横轴截距为-1/Km ,纵轴截距为1/Vmax ,因此实验时,选择不同的[S],测定相应的v,依L-B双倒数方程作图,即可求得Km 和Vmax;在抑制剂存在时,即可求得表观Km 和 Vmax,竞争性抑制的动力学特点见图2。
2.本实验以碱性磷酸酶(AKP)为例,磷酸苯二钠为底物,磷酸氢二钠为其竞争性抑制剂,茶碱为其非竞争性抑制剂。
AKP催化磷酸苯二钠水解产生游离酚和磷酸盐。
酚与酚试剂应用液在碱性溶液中生成蓝色的衍生物。
根据蓝色的深浅可测出酚的含量,从而算出相应的酶促反应速度(v)。
再根据Lineweaver—Burk法作图,计算其Km 值及抑制剂存在时表观Km值的改变。
三、实验步骤:1.米氏常数测定按下表操作:2.抑制剂对酶促反应速度的影响按下表操作:3.计算以1/A660-1/[S]作图,求出Km及表观Km。
四、结果与分析:实验数据处理表格:1.米氏常数Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.206 0.318 0.412 0.496 0.5532.抑制剂存在时表观Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.170 0.185 0.275 0.376 0.389作图:计算:1.Km计算:由直线方程y=7.0999x+0.9662知,当y=0时,x=-0.1361,即-1/Km=-0.1361,所以Km=7.35mmol/L,纵截距为0.96622.表观Km计算:由直线方程y=10.895x+0.9662知,当y=0时,x=-0.08868,即-1/Km=-0.08868,所以Km=11.28mmol/L,纵截距为0.9662表观Km>Km,,且纵截距相等,所以抑制剂是竞争性抑制剂。

温度、pH、激活剂、抑制剂对酶活性的影响(间接碘量法)(effects of temperature pH activitor and inhibitor to activity of enzyme)一、目的1.了解温度、pH、激活剂、抑制剂对酶活性的影响2.学习酶活性的判定二、原理酶活性大小可以用反应速度来表示,即在单位时间内,酶所催化底物的消耗量或产物的生成量来衡量。
酶活性大,反应速度就快。
反之则慢。
酶促反应速度受多种因素的影响。
如温度、pH、激活剂、抑制剂等。
本实验是观察在不同温度,pH,以及缺乏激活剂或有抑制剂的条件下唾液淀粉酶的活性大小。
借以验证各种因素对酶活性的影响。
唾液中含有唾液淀粉酶,此酶可以使淀粉逐步水解,最后生成麦芽糖。
麦芽糖具有还原性。
根据淀粉被唾液淀粉酶水解后产物的生成量(即还原性麦芽糖的多少)判定酶活性的大小。
用碘的反滴定法测定还原物的量,还原物多,酶活性大。
具体反应如下:1、试剂成分(S、H、S试剂):CuSO4、Na2CO3、NaHCO3、KI、KIO3、酒石酸钾钠、草酸钾。
2、判定酶活性大小的化学反应过程:Na2CO3 +2H2O —→2NaOH + H2CO3CuSO4+2NaOH —→Cu(OH)2↓+Na2SO45KI +KIO3 + 3H2SO4—→3I2+3K2SO4 +3H2O酶淀粉———→麦芽糖麦芽糖+Cu++—→麦芽糖氧化产物+Cu+Cu++ I2—→Cu++ + 2I-COO- 草酸钾COO-Cu+++|—————→| >CuCOO- 防止逆反应COO-剩余I2+Na2S2O3—→2I- +Na2S4O6(与淀粉呈兰色) (与淀粉无色)3、判定酶活性大小的标志酶活性大→麦芽糖多→Cu+ 生成量多→I2消耗量多→剩余I2少→Na2S2O3消耗量少酶活性越大,Na2S2O3消耗量越少。
空白实验无酶活性,因此Na2S2O3消耗量最多。
与空白实验进行对比,差值越大,说明此条件下酶活性越大。
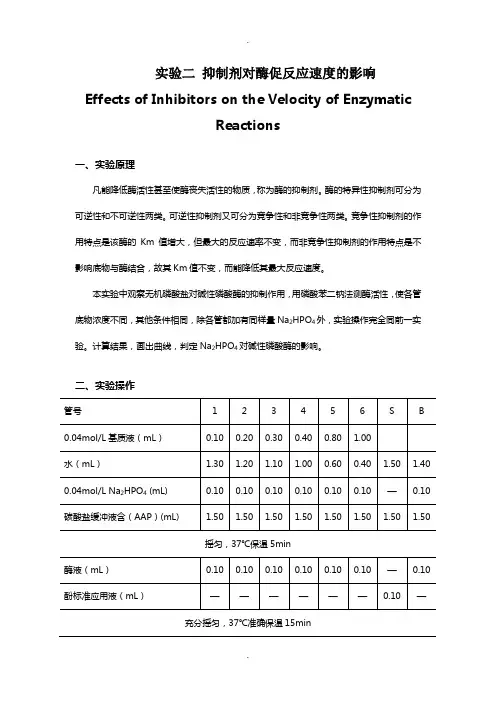
实验二抑制剂对酶促反应速度的影响Effects of Inhibitors on the Velocity of Enzymatic
Reactions
一、实验原理
凡能降低酶活性甚至使酶丧失活性的物质,称为酶的抑制剂。
酶的特异性抑制剂可分为可逆性和不可逆性两类。
可逆性抑制剂又可分为竞争性和非竞争性两类。
竞争性抑制剂的作用特点是该酶的Km值增大,但最大的反应速率不变,而非竞争性抑制剂的作用特点是不影响底物与酶结合,故其Km值不变,而能降低其最大反应速度。
本实验中观察无机磷酸盐对碱性磷酸酶的抑制作用,用磷酸苯二钠法测酶活性,使各管底物浓度不同,其他条件相同,除各管都加有同样量Na2HPO4外,实验操作完全同前一实验。
计算结果,画出曲线,判定Na2HPO4对碱性磷酸酶的影响。
二、实验操作
摇匀,37℃保温5min
充分摇匀,37℃准确保温15min
充分摇匀,室温放置10min
在510nm,以B管调零时读取各管光密度值。
计算并作图要领同实验一,求出Km值,判定结果,Na2HPO4属于哪种抑制剂。
三、思考题
联系实验结果,讨论抑制剂对酶活性的影响。
四、英语关键词
最大反应速度:Maximum velocity
米—曼式方程:Michaelis—Menten Equation
特性常数:Characteristic constant
绘图:Plot
直线:Straight Line
截距:Intercept
斜率:Slope
磷酸苯二钠:Disodium Phenylphosphate
4-氨基安替比林:4-Aminoantipyrine。


酶练习题一.单项选择题1. 竞争性抑制剂对酶促反应的影响是:A. Km增大,Vm减小B. Km不变,Vm增大C. Km减小,Vm减小D. Km增大,Vm不变2. 泛酸是下列哪种辅酶的组成成分A. CoA-SHB. TPPC. FADD. FMN3. Km值与底物亲和力大小的关系是A. Km值越小,亲和力越大B. Km值越大,亲和力越大C. Km值的大小与亲和力无关D. Km值越小,亲和力越小4. 磺胺类药物的类似物是:A. 四氢叶酸B. 二氢叶酸C. 对氨基苯甲酸D. 叶酸5. 酶能加速化学反应的进行是由于A. 向反应体系提供能量B. 降低反应的活化能C. 降低反应底物的能量水平D. 提高反应底物的能量水平6. NADPH分子中含有哪种维生素A. 磷酸吡哆醛B. 核黄素C. 叶酸D. 尼克酰胺7.维生素B2是下列哪种辅酶的组成成分?A. FH4B. NADP+C. TPPD. FAD8. 当酶促反应[S]=0.5Km,则V值是A. 0.25VmB. 0.33VmC. 0.50VmD. 0.65Vm9. 有机磷杀虫剂对胆碱酯酶的抑制作用是:A. 可逆性抑制作用B. 竞争性抑制作用C. 非竞争性抑制作用D. 不可逆性抑制作用10. 关于pH值对酶活性的影响,下列哪项不对?A. 影响必需基团的解离状态B. 影响底物的解离状态C. 破坏酶蛋白的一级结构D. 影响酶与底物结合11. 维生素D3的主要活性形式是:A. 25-(OH)-D3B. 1-(OH)-D3C. 1,25-(OH)2-D3D. 1,24-(OH)2-D312. 丙二酸对琥珀酸脱氢酶的影响属于:A. 变构调节B. 底物抑制C. 竞争性抑制D. 非竞争性抑制13. 乳酸脱氢酶有几种同工酶A. 2B. 3C. 4D. 514. 有关同工酶的概念正确的是:A. 催化相同的化学反应,酶蛋白的分子结构、理化性质不同,电泳行为不同B. 催化不同的化学反应C. 催化不同的化学反应,酶蛋白的分子结构、理化性质相同,电泳行为相同D. 催化相似的化学反应15. 关于Km值的叙述正确的是:A. 与酶和底物的浓度有关B. 是达到Vm 时的底物浓度C. 与酶和底物的亲和力无关D. 是V达到1/2Vm 时的底物浓度16. 酶在催化反应中决定酶专一性的部分是:A. 辅酶B. 辅基C. 金属离子D. 酶蛋白17. 非竞争性抑制剂对酶促反应的影响是:A. Km减小,Vm增大B. Km不变,Vm减小C. Km增大,Vm减小D. Km增大,Vm不变18. 反竞争性抑制剂对酶促反应的影响符合下列哪项特征?A. Km减小,Vm减小B. Km不变,Vm增大C. Km增大,Vm减小D. Km增大,Vm不变19. 某一酶促反应速度为0.8Vm时,Km等于:A. [S]B.0.5[S]C. 0.25[S]D. 0.8[S]20. 关于维生素的叙述,正确的是:A. 维生素是组成机体组织细胞的成分之一B. 其化学本质为小分子有机化合物C. 引起维生素缺乏的唯一原因是摄入量不足D. 维生素可氧化供能21.下列有关酶的论述正确的是:A.体内所有具有催化活性的物质都是酶B.酶在体内不能更新C.酶的底物都是有机化合物D.酶是活细胞内合成的具有催化作用的蛋白质22. 酶蛋白变性后其活性丧失,这是因为:A.酶蛋白被完全降解为氨基酸B.酶蛋白的一级结构受破坏C.酶蛋白的空间结构受破坏D.酶蛋白不再溶于水23. 酶的辅酶是A.与酶蛋白结合紧密的金属离子B.分子结构中不含维生素的小分子有机化合物C.在催化反应中不与酶的活性中心结合D.在反应中起传递质子、电子或其他基团的作用24.含有维生素B1的辅酶是A.NAD+B.FADC.TPPD.CoA25.下图是几种抑制作用的双倒数作图,其中直线X代表无抑制剂时的作图,那么非竞争性抑制作用的作图是:A. AB. BC. CD. D26.酶促反应动力学研究的是:A.酶分子的空间构象B.酶的电泳行为C.酶的活性中心D.影响酶促反应速度的因素27.影响酶促反应速度的因素不包括:A.底物浓度B.酶的浓度C.反应环境的pH和TD.酶原的浓度28.有关竞争性抑制剂的论述,错误的是:A.结构与底物相似B.与酶非共价结合C.与酶的结合是可逆的D.抑制程度只与抑制剂的浓度有关29. 有关非竞争性抑制作用的论述,正确的是:A.不改变酶促反应的最大速度B.改变表观Km值C.酶与底物、抑制剂可同时结合,但不影响其释放出产物D.抑制剂与酶结合后,不影响酶与底物的结合30. 有关酶的活性中心的论述,正确的是:A.酶的活性中心专指能与底物特异性结合的必需基团B.酶的活性中心是由一级结构上相互邻近的基团组成的C.酶的活性中心在与底物结合时不应发生构象改变D.没有或不能形成活性中心的蛋白质不是酶31. 温度对酶促反应速度的影响是:A.温度升高反应速度加快,与一般催化剂完全相同B.低温可使大多数酶发生变性C.最适温度是酶的特性常数,与反应进行的时间无关D.最适温度不是酶的特性常数,延长反应时间,其最适温度降低32. 关于pH对酶促反应速度影响的论述中,错误的是:A. pH影响酶、底物或辅助因子的解离度,从而响酶促反应速度B.最适pH是酶的特性常数C. 最适pH不是酶的特性常数D. pH过高或过低可使酶发生变性33. 关于酶原与酶原激活,正确的是A.体内所有的酶在初合成时均以酶原的形式存在B.酶原的激活没有什么意义C.酶原的激活过程也就是酶被完全水解的过程D.酶原激活过程的实质是酶的活性中心形成或暴露的过程34. 有关别构酶的论述哪一种不正确A.别构酶是受别构调节的酶B.正协同效应例如,底物与酶的一个亚基结合后使此亚基发生构象改变,从而引起相邻亚基发生同样的改变,增加此亚基对后续底物的亲和力C.正协同效应的底物浓度曲线是矩形双曲线D.构象改变使后续底物结合的亲和力减弱,称为负协同效应35. 国际酶学委员会将酶分为六类的依据是:A.酶的物理性质B.酶的结构C.酶的来源D.酶促反应的性质二.填空题1. 结合酶由与相结合才具有活性。
酶促反应速率的影响因素
酶促反应速率是生命体系中一种十分重要的化学反应,它能够加
速化学反应的速率并且在许多生物体系中扮演着重要的角色。
这种反
应速率的影响因素有许多,比如温度、pH值、底物浓度、酶浓度和抑
制剂等。
首先,温度是酶促反应速率的最大影响因素之一。
一般来说,较
高的温度会增加化学反应的速率,但是如果过度升高温度,会使酶变
性失活,因此需要在温度控制范围内进行实验。
其次,pH值也是酶促反应速率的重要影响因素。
大多数酶都对特
定的pH值非常敏感,并且具有最适宜的酸碱度范围。
所以,如果酶处
于不适宜的pH值环境中,它们的反应速率就会显著降低。
除此之外,底物浓度也影响着酶促反应速率。
在开始的阶段内,
增加底物浓度会增加反应速率。
但是在酶的底物浓度达到一定程度后,反应速率逐渐趋于饱和。
另外,酶浓度也是反应速率的影响因素之一。
增加酶浓度会增加
反应速率,反之则会减少反应速率。
最后,抑制剂也是影响酶促反应速率的因素之一。
抑制剂能够减
缓或抑制酶的活性,从而影响反应速率。
抑制剂可以是竞争性的,即
与底物竞争酶结合,也可以是非竞争性的,即通过改变酶的构象或化
学性质来抑制反应速率。
总的来说,了解酶促反应速率的影响因素对于研究生命体系中的化学反应非常重要。
在实验或者研究中,需要针对不同的影响因素进行控制和实验,以获得准确的结果,并且可以为生物技术和医疗研究提供指导意义。