二、酶浓度对酶促反应速度的影响
- 格式:ppt
- 大小:1.95 MB
- 文档页数:76

影响酶促反应的因素实验报告影响酶促反应的因素实验报告引言:酶是一类生物催化剂,能够加速化学反应的速率。
酶促反应在生物体内起着至关重要的作用,调控着许多生理过程。
然而,酶促反应的速率受到许多因素的影响。
本实验旨在探究影响酶促反应速率的因素,并通过实验数据进行分析和讨论。
材料与方法:1. 实验材料:淀粉溶液、淀粉酶溶液、试管、滴管、温度计、加热装置、试管架等。
2. 实验方法:a. 准备一组试管,每个试管中加入相同体积的淀粉溶液。
b. 将试管分成几组,每组分别加入不同浓度的淀粉酶溶液。
c. 将试管放置在恒温水浴中,分别设置不同温度。
d. 在一定时间间隔内,取出一小部分淀粉溶液,加入碘液进行观察。
颜色由深蓝色变为淡黄色代表淀粉被酶降解。
e. 记录每组试管中淀粉被降解的时间。
结果与讨论:1. 温度对酶促反应的影响:实验中我们分别设置了不同温度下的试验组。
结果显示,在较低温度下,酶的活性较低,淀粉的降解速率较慢。
随着温度的升高,酶的活性增加,淀粉的降解速率也随之增加。
然而,当温度过高时,酶的活性会受到破坏,导致淀粉的降解速率下降。
因此,温度是影响酶促反应速率的重要因素,但过高或过低的温度都会对酶的活性产生不利影响。
2. 酶浓度对酶促反应的影响:实验中我们分别设置了不同浓度的酶溶液。
结果显示,随着酶浓度的增加,淀粉的降解速率也随之增加。
这是因为酶浓度的增加会提供更多的酶分子,从而增加了酶与底物淀粉分子的碰撞频率,加速了反应速率。
然而,当酶浓度过高时,酶分子之间会发生竞争,导致淀粉的降解速率不再增加。
因此,酶浓度也是影响酶促反应速率的重要因素。
3. 底物浓度对酶促反应的影响:实验中我们分别设置了不同浓度的淀粉溶液。
结果显示,随着淀粉浓度的增加,淀粉的降解速率也随之增加。
这是因为底物浓度的增加会提供更多的底物分子,增加了酶与底物分子的碰撞频率,加速了反应速率。
然而,当底物浓度过高时,酶分子与底物分子的碰撞频率已经达到饱和,淀粉的降解速率不再增加。


图底物浓度对反应速度的影响2-5酶促反应特点酶促反应动力学研究各种因素对酶反应速度的影响。
主要因素有:作用物浓度,酶浓度,pH ,温度,激动剂及抑制剂。
Km 值是当反应速度为最大速度的一半时的底物浓度,它表示酶与底物的亲和力,Km 值越大,亲和力越小,反之Km 值越小亲和力越大。
酶促反应动力学的研究有助于阐明酶的结构与功能的关系,也可为酶作用机理的研究提供数据;有助于寻找最有利的反应条件,以最大限度地发挥酶催化反应的高效率;有助于了解酶在代谢中的作用或某些药物作用的机理等,因此对它的研究具有重要的理论意义和实践意义。
酶促反应动力学是研究各种因素对酶促反应速度的影响及其反应规律。
影响酶促反应速度的因素有酶浓度、温度、pH 、作用物浓度、激动剂及抑制剂等。
一、底物浓度对反应速度的影响在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线。
在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系。
随着底物浓度的升高,反应速度不再呈正比例加快,反应速度增加的幅度不断下降。
如果继续加大底物浓度,反应速度不再增加。
此时,无论底物浓度增加多大,反应速度也不再增加,说明酶已被底物所饱和。
所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。
在一定的温度和pH 条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系。
作用物浓度对酶促反应速度的影响可用米氏方程来表示。
Km 为米氏常数。
Km 值是酶学研究中一个重要特征性常数,有着重要意义。
Km值是当反应速度为最大速度一半时的底物浓度,它表示酶与底物的亲和力,Km值愈大亲和力愈小,反之Km值愈小亲和力愈大。
二、酶浓度对反应速度的影响在一定的温度和pH条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系。
在一个连续的酶促反应中,若能确定各种酶催化反应底物的Km值及相应的底物浓度时,其中Km值最大的一步酶促反应是该连续反应中的限速反应,该酶为限速酶。


《酶浓度对酶促反应速度的影响曲线》一、概述酶是一种生物催化剂,能够在生物体内促进化学反应的进行。
酶促反应速度受到多种因素的影响,其中酶浓度是一个重要的因素。
本文将探讨酶浓度对酶促反应速度的影响曲线,以及这个现象背后的生物学意义。
二、酶浓度对酶促反应速度的影响1. 定义酶浓度指的是单位体积中的酶分子数,通常以单位体积中的酶质量或酶分子数来表示。
而酶促反应速度是指在一定温度和pH条件下,酶对底物转化的速度。
在一定底物浓度下,酶浓度对酶促反应速度的影响可以用一条曲线来表示。
2. 影响曲线的特点当酶浓度很低时,酶促反应速度随着酶浓度的增加呈线性增加。
这是因为在低浓度下,底物与酶的结合位点很多时,酶的催化作用受到底物浓度的限制。
随着酶浓度的增加,反应速度呈指数型增加,但当酶浓度达到一定程度后,酶促反应速度不再增加,达到了最大值。
这是因为在酶浓度过高时,底物的浓度成为了限制酶促反应速度的因素。
3. 生物学意义酶浓度对酶促反应速度的影响曲线反映了生物体内酶的动态平衡状态。
在细胞内,酶的浓度会受到基因表达、蛋白合成等多种因素的调控,以适应不同生理条件下的代谢需求。
了解酶浓度对酶促反应速度的影响曲线有助于我们更好地理解细胞内代谢调控的机制。
三、个人观点和理解从酶浓度对酶促反应速度的影响曲线可以看出,酶浓度在一定范围内能够显著影响酶促反应速度,但也存在着饱和现象。
这提示我们在研究酶的催化机制时,需要综合考虑底物浓度、酶浓度和其他影响因素,以更全面地理解酶的功能。
四、总结通过本文的探讨,我们了解到了酶浓度对酶促反应速度的影响曲线和其生物学意义,以及对细胞内代谢调控的启示。
酶浓度的变化会直接影响酶促反应速度,而这种调控是细胞内代谢活动能够动态适应不同生理条件的重要基础之一。
在写这篇文章的过程中,我对酶浓度对酶促反应速度的影响曲线有了更深刻的理解。
希望这篇文章也能帮助您更好地理解这一生物学现象,并为您的学习和研究提供一些启发。

影响酶活力的因素:米契里斯(Michaelis)和门坦(Menten)根据中间产物学说推导出酶促反应速度方程式,即米-门公式(具体参考《环境工程微生物学》第四章微生物的生理)。
由米门公式可知:酶促反应速度受酶浓度和底物浓度的影响,也受温度、pH、激活剂和抑制剂的影响。
1酶浓度对酶促反应速度的影响从米门公式和酶浓度与酶促反应速度的关系图解可以看出:酶促反应速度与酶分子的浓度成正比。
当底物分子浓度足够时,酶分子越多,底物转化的速度越快。
但事实上,当酶浓度很高时,并不保持这种关系,曲线逐渐趋向平缓。
根据分析,这可能是高浓度的底物夹带夹带有许多的抑制剂所致。
2底物浓度对酶促反应速度的影响在生化反应中,若酶的浓度为定值,底物的起始浓度较低时,酶促反应速度与底物浓度成正比,即随底物浓度的增加而增加。
当所有的酶与底物结合生成中间产物后,即使在增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加。
还可以得出,在底物浓度相同条件下,酶促反应速度与酶的初始浓度成正比。
酶的初始浓度大,其酶促反应速度就大。
在实际测定中,即使酶浓度足够高,随底物浓度的升高,酶促反应速度并没有因此增加,甚至受到抑制。
其原因是:高浓度底物降低了水的有效浓度,降低了分子扩散性,从而降低了酶促反应速度。
过量的底物聚集在酶分子上,生成无活性的中间产物,不能释放出酶分子,从而也会降低反应速度。
3温度对酶促反应速度的影响各种酶在最适温度范围内,酶活性最强,酶促反应速度最大。
在适宜的温度范围内,温度每升高10℃,酶促反应速度可以相应提高1~2倍。
不同生物体内酶的最适温度不同。
如,动物组织中各种酶的最适温度为37~40℃;微生物体内各种酶的最适温度为25~60℃,但也有例外,如黑曲糖化酶的最适温度为62~64℃;巨大芽孢杆菌、短乳酸杆菌、产气杆菌等体内的葡萄糖异构酶的最适温度为80℃;枯草杆菌的液化型淀粉酶的最适温度为85~94℃。
可见,一些芽孢杆菌的酶的热稳定性较高。

酶浓度对酶促反应速度的影响曲线在生物化学领域,酶是一类具有高度专一性和高效催化作用的蛋白质,对于维持生命活动和代谢平衡起着至关重要的作用。
酶促反应是生物体内许多化学反应发生的关键驱动力之一,而酶浓度对酶促反应速度的影响是一个备受关注的重要课题。
在本文中,我们将探讨酶浓度对酶促反应速度的影响曲线,并尝试从多个角度解析这一复杂而重要的关系。
1. 酶促反应速度的基本概念在开始讨论酶浓度对酶促反应速度的影响之前,让我们先回顾一下酶促反应速度的基本概念。
酶促反应速度是指在单位时间内,酶催化下底物转化为产物的速率。
根据米氏动力学理论,酶促反应速度与底物浓度之间存在一定的关系,通常可以用米氏方程来描述。
米氏方程的一般形式为V = (Vmax* [S]) / (Km + [S]),其中Vmax为最大反应速率,[S]为底物浓度,Km为米氏常数。
这个方程揭示了酶促反应速度与底物浓度之间的非线性关系,而酶浓度也可以通过类似的方程来描述其与反应速率之间的关系。
2. 酶浓度对酶促反应速度的影响曲线根据米氏方程,可以推导出酶浓度对酶促反应速度的影响曲线。
一般来说,当酶浓度较低时,酶促反应速度随着酶浓度的增加而呈指数增长的趋势。
这是因为在低浓度下,底物与酶的结合位点尚未完全饱和,酶浓度的增加能够大大提高底物与酶分子之间的碰撞频率,从而促进反应速率的增加。
然而,当酶浓度持续增加到一定程度后,酶促反应速度将会趋于饱和,不再呈现出指数增长的趋势。
这是因为在高浓度下,底物与酶的结合位点已经大部分饱和,酶浓度的增加对反应速率的影响逐渐减弱,最终导致反应速率的饱和状态。
3. 个人观点和理解对于酶浓度对酶促反应速度的影响曲线,我个人认为其背后蕴含着许多深刻而值得探讨的生物化学规律。
这一曲线展现了酶促反应速度与酶浓度之间的复杂非线性关系,这为我们理解生物体内代谢调节和适应能力提供了重要线索。
通过对这一曲线的深入研究,我们可以揭示酶活性受调控的机制和规律,为开发新型酶制剂和药物提供理论指导。

酶促反应影响因素酶促反应影响因素1. 温度:温度高于酶的最适活性温度,会加速酶分子的活性,而酶活性过高则可导致酶烧伤或破坏,从而降低反应的速率,所以保持合适的温度是影响酶促反应的重要因素之一。
2. 酶浓度:酶浓度是影响酶促反应速率的主要因素,它直接影响反应中酶与底物之间的接触次数,当酶浓度增加时,酶与底物越多,接触次数越多,反应速率自然越快,反之,当酶浓度过低时,反应速率就变慢。
3. pH值:pH值也会影响酶促反应,每种酶都有自己最适宜的pH值,若pH值过高或过低,酶活性可能会下降,甚至在一定的极端条件下可能造成酶的解离,因此需要控制反应的pH值。
4. 辅助因子:对于一些特定的酶,还需要加入某些激活剂或辅助因子,才能促进反应,引起酶活性。
例如,维生素是不可缺少的辅助因子,它们可能和一些酶结合形成介质型酶,影响酶促反应的反应速率。
5. 抑制剂:在生理反应过程中,也需要抑制酶的活性,而一些有机分子可以抑制酶的活性,从而降低反应的速率。
抑制剂的效果受其类型、浓度和pH值等影响,如果抑制剂的浓度过高,将会完全抑制酶活性,从而降低反应的速率。
6. 氧化剂和还原剂:氧化剂和还原剂都会影响酶促反应,氧化剂可以促进酶的反应速率,而还原剂则可以降低酶的反应速率。
例如,苯酚可以作为氧化剂加速酶促反应,而过氧化氢则可以作为还原剂,降低酶促反应的速率。
7. 金属离子:一些金属离子也可以影响酶的反应速率,其中锰、铜、铁等离子可能介导酶的正向活性,而硫酸钙、硫酸镁、硫酸铝等离子可能起抑制作用,降低酶的反应速率。
因此,温度、酶浓度、pH值、辅助因子、抑制剂、氧化剂和还原剂以及金属离子等都是影响酶促反应速率的重要因素。
基于此,实验室工作者可以在有效控制这些条件条件的基础上,改善反应的质量和效率,从而获得更佳的实验结果。

酶浓度对酶促反应速度的影响曲线酶是生物体内一类催化剂,能够加速生物体内化学反应的进行,提高反应速度。
酶浓度是指单位体积内酶的数量,一般以酶活性单位(U)表示。
酶浓度的改变会对酶促反应速度产生影响,即酶浓度对反应速率有一定的关系。
本文将通过实验数据和理论分析来探讨酶浓度对酶促反应速度的影响曲线。
一、实验介绍为了研究酶浓度对酶促反应速度的影响,我们选择了一种常用的酶——过氧化氢酶进行实验。
过氧化氢酶是一种催化过氧化氢分解的酶,能够将过氧化氢分解成氧气和水,反应式如下:2H2O2 -> 2H2O + O2实验采用一种比色法来检测反应速度,即通过测量反应过程中产生的氧气量来评价酶促反应速度的变化。
二、实验步骤1.实验所需材料:(1)过氧化氢酶溶液(2)过氧化氢底物溶液(H2O2)(3)缓冲液(4)酶测色液2.制备一系列不同浓度的酶溶液,浓度范围通常选择10U/mL至100U/mL,并用适量的缓冲液稀释。
3.将酶溶液各取一定体积如1mL分别加入试管中,然后加入适量的H2O2底物溶液。
4.在反应开始和结束时,分别加入适量的酶测色液,使反应液显色。
5.根据显色程度可以定量测量出释放的氧气量,从而推测出反应速度。
6.重复实验,取多组数据,得出酶浓度对酶促反应速度的影响曲线。
三、结果与讨论通过实验数据的分析,可以得出如下结论:1.当酶浓度较低时,反应速度较慢,随着酶浓度的增加,反应速度逐渐增加,但增速逐渐趋缓。
2.在一定范围内,酶浓度和反应速度之间存在着正相关关系,即酶浓度越高,反应速度越快。
3.当酶浓度达到一定阈值后,继续增加酶浓度已经不再能够显著提高反应速度,此时酶的量已经足够催化全部反应。
通过以上结果可以得出酶浓度对酶促反应速度的影响曲线,大致呈现一个类似于饱和曲线的形状。
当酶浓度较低时,酶的活性物质较少,反应速度受限于酶活性物质的数量,因此反应速度较慢。
随着酶浓度的增加,酶活性物质的数量增加,反应速度逐渐增加,但增速逐渐减缓。
种因素。
在探讨各种因素对酶促反应速度的影响时,通常测定其初始速度来代表酶促反应速度,即底物转化量<5%时的反应速度。
影响酶促反应速度的因素包括:1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率影响的作图时呈矩形双曲线。
底物足够时,酶浓度对反应速率的影响呈直线关系。
2. 底物浓度:在其他因素不变的情况下,随着底物浓度的增加,反应速率也会相应增加。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对反应速率的影响具有双重性。
在适宜的温度范围内,随着温度的升高,反应速率加快。
但当温度过高时,酶的活性会受到抑制,反应速率反而下降。
5. 抑制剂和激活剂:抑制剂可逆或不可逆的降低酶促反应速率,而激活剂可加快酶促反应速率。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
酶促反应的动力学研究与探讨的是酶促反应的速率及影响酶促反应速率的各种因素。
其中,主要的因素包括酶浓度、底物浓度、pH值、温度、激活剂和抑制剂等。
1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率的影响呈矩形双曲线。
当底物浓度足够时,酶浓度对反应速率的影响则呈直线关系。
2. 底物浓度:在酶浓度不变的情况下,底物浓度的增加会促进反应速度的增加,但当底物浓度达到一定值后,再增加底物浓度对反应速度的影响不大。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对酶促反应速率的影响具有双重性。
在低温条件下,由于分子运动速度较慢,反应速度比较慢;随着温度的升高,分子运动速度加快,反应速度也会加快;但当温度升高到一定值后,过高的温度会使酶变性,反应速度反而下降。
5. 激活剂和抑制剂:激活剂可以加快酶促反应速度,而抑制剂可以降低酶促反应速度。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
实验二十一外界因素对酶活性的影响一、实验目的1.了解外界因素对酶活性及酶促反应速度的影响。
2.加深对酶特性的认识。
二、实验原理酶的化学本质是蛋白质,它极易受外界条件的影响而改变它的构象及性质,因而也必然会影响到它的催化活性。
酶对温度、pH值、酶浓度及某些离子浓度等变化很敏感。
(一)pH值对酶活性的影响酶的活性受环境pH的影响极为显著,通常各种酶只有在一定的pH范围内才能表现它的活性。
一种酶表现其最高活性时的pH值称为该酶的最适pH。
高于或低于最适pH值时,酶的活性降低。
酶的最适pH值受酶的纯度、底物的种类和浓度、缓冲液的种类和浓度以及环境温度等条件影响。
(二)温度对酶活性的影响每种酶都有其最适温度,高于或低于此温度酶的活性都降低。
一般而言,若酶处于过高的温度环境中,会使酶活性永久地丧失;而若处于极低温度的环境中只会使酶活性受到抑制,一旦温度适宜,酶又会全部或部分地恢复其活性。
(三)酶浓度对酶促反应速度的影响在其它条件不变的情况下,若反应物浓度大大高于酶浓度时,则反应速度随酶浓度增加而增加,两者间成正比关系,即:V=k[E]但若反应底物浓度较低,而且酶的浓度足够高时,增加酶浓度,反应速度基本不变。
(四)离子对酶活性的影响就唾液淀粉酶而言,低浓度Cl- 可以增加酶活性,高浓度的Cl- 或者低浓度2-等对酶活性没有影响。
不同的酶的Cu2+则会抑制酶的活性,而低浓度的Na+、SO4对不同的离子具有不同的效应。
三、实验用品(一)材料淀粉、唾液淀粉酶。
(二)器材冰箱、电炉、恒温水浴锅和铜水浴锅、试管架及试管、移液管架及移液管、锥形瓶。
(三)试剂1. 0.2 mol/L磷酸氢二钠溶液称取35.61g含2个结晶水的磷酸氢二钠,用水定容至1 L。
2. 0.1 mol/L柠檬酸溶液称取21.01g含1个结晶水的柠檬酸,用水定容至1 L。
3. 唾液淀粉酶将唾液分别稀释10倍,50倍和100倍,得三种浓度的酶液。
4. O.5%淀粉的0.5%氯化钠溶液 0.5 g可溶性淀粉和0.5g氯化钠,溶于100 ml蒸馏水(需加热)。
酶的催化反应一、酶的定义与本质1. 定义酶是一类由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质或RNA。
酶能够在温和的条件下(如常温、常压、接近中性的pH等)高效地催化各种生物化学反应。
2. 本质大多数酶是蛋白质,具有蛋白质的一、二、三、四级结构。
蛋白质性质的酶由氨基酸组成,其活性中心的氨基酸残基对于催化反应起着关键作用。
少数酶是RNA,被称为核酶。
核酶具有催化特定RNA切割和连接等反应的能力。
二、酶催化反应的特点(一)高效性1. 表现酶的催化效率通常比非酶催化反应高得多。
例如,过氧化氢分解反应,在没有酶催化时,反应速度很慢;而在过氧化氢酶的催化下,反应速度可以提高10⁷ 10¹³倍。
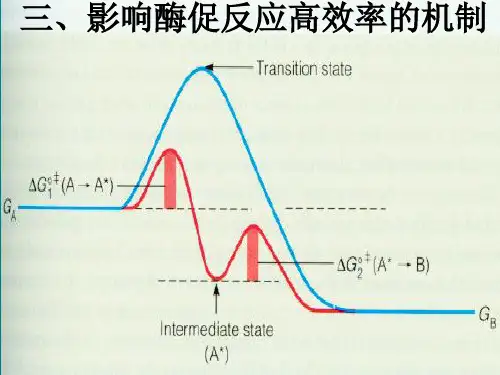
2. 原因酶降低反应的活化能。
活化能是反应物分子从常态转变为容易发生化学反应的活跃状态所需要的能量。
酶通过特定的作用机制,使反应物分子更容易达到反应所需的过渡态,从而大大降低了反应的活化能,加快反应速度。
(二)特异性1. 绝对特异性一种酶只作用于一种特定的底物,进行一种专一的反应,生成一种特定的产物。
例如,脲酶只能催化尿素水解生成氨和二氧化碳,对其他底物则无催化作用。
2. 相对特异性一种酶可作用于一类化合物或一种化学键。
例如,磷酸酶对一般的磷酸酯键都有水解作用,可作用于多种含磷酸酯键的底物。
3. 立体异构特异性酶对底物的立体异构体有高度选择性。
例如,L 乳酸脱氢酶只能催化L 乳酸脱氢生成丙酮酸,而对D 乳酸则无作用。
(三)可调节性1. 酶量的调节细胞可以通过调节酶的合成和降解速度来控制酶的含量。
例如,当细胞内某种代谢产物的浓度较低时,可能会诱导合成催化该代谢产物生成的酶;而当代谢产物浓度过高时,可能会抑制酶的合成或加速酶的降解。
2. 变构调节一些酶具有多个亚基和变构中心。
当变构效应剂(可以是底物、产物或其他小分子物质)与变构中心结合时,会引起酶分子构象的改变,从而影响酶的活性。
例如,磷酸果糖激酶 1是糖酵解途径中的关键酶,它受ATP、柠檬酸等变构抑制剂和AMP、ADP等变构激活剂的调节。