抑制剂对酶促反应的影响共25页
- 格式:ppt
- 大小:2.38 MB
- 文档页数:25


激活剂和抑制剂对酶活性影响实验报告
影响酶作用的因素:影响酶促反应的因素常有酶的浓度、底物浓度、pH值、温度、抑制剂、激活剂等。
其变化规律有以下特点:
1、酶浓度对酶促反应的影响:在底物足够,其它条件固定的条件下,反应系统中不含有抑制酶活性的物质及其它不利于酶发挥作用的因素时,酶促反应的速度与酶浓度成正比。
2、底物浓度对酶促反应的影响:在底物浓度较低时,反应速度随底物浓度增加而加快,反应速度与底物浓度近乎成正比,在底物浓度较高时,底物浓度增加,反应速度也随之加快,但不显著,当底物浓度很大且达到一定限度时,反应速度就达到一个最大值,此时即使再增加底物浓度,反应也几乎不再改变。
3、酶的活性受激活剂或抑制剂的影响。
氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂,激活剂使酶的活性升高,抑制剂使酶活性降低。
注意事项:
激活剂和抑制剂对于酶活性的影响,常常分不清激活剂,因为加入蒸馏水、NaCl、Na2SO4这3支试管的颜色一致,都是黄色。
出现这种现象的原因是酶活性太高了,需要稀释唾液,唾液稀释至加入蒸馏水的试管呈浅红色即可。
这样一来,这3支试管的颜色分别是浅红、黄、浅红,就可以断定Cl-是激活剂。
偶尔也有分不清抑制剂的就是加入蒸馏水、CuSO4、
Na2SO4这三支试管的颜色一致,都是蓝色。
因为酶活性太低,需要提高酶活性,只要重新制备唾液淀粉酶就行(但是新酶的活性不可太高,否则又分不清激活剂)。
最后3支试管的颜色应该是浅红、蓝、浅红,可以断定Cu2+是抑制剂。


口腔执业医师辅导之抑制剂对酶促反应速度年口腔执业医师资格考试辅导:抑制剂对酶促反应速度的影响有些物质(不包括蛋白质变性因子)能减弱或停止酶的作用,此类物质称为酶的抑制剂。
抑制剂多与酶的活性中心内、外的必需基团结合,抑制酶的催化活性。
如果能将抑制剂去除,酶仍表现其原有活性。
1)不可逆抑制作用:抑制剂与酶活性中心的必需基团形成共价结合,不能用简单透析、稀释等方法除去,这一类抑制剂称为不可逆性抑制剂;所引起的抑制作用为不可逆性抑制作用。
化学毒剂,如农药1059、敌百虫等有机磷制剂即属此类。
它们的杀虫或机体中毒作用主要是特异地与胆碱酯酶活性中心的丝氨酸羟基结合,使酶失活。
乙酰胆碱不能被失活的胆碱酯酶水解而蓄积,引起迷走神经持续兴奋发生中毒症状。
2)可逆性抑制:抑制剂以非共价键与酶或中间复合物发生可逆性结合,使酶活性降低或消失,应用简单的透析、稀释等方法可解除抑制,这种抑制剂称为可逆性抑制剂。
可逆性抑制剂引起的抑制作用为可逆性抑制作用。
可逆性抑制作用的类型可分为下列三种。
①竞争性抑制:有些可逆性抑制剂与作用物结构相似,能和作用物竞争酶的活性中心,使酶不能与作用物结合,抑制酶促反应,称为竞争性抑制。
这类抑制剂称为竞争性抑制剂。
因为抑制剂与酶的结合是可逆的,所以酶促反应抑制程度取决于作用物、抑制剂与酶的亲和力及二者浓度的相对比例。
在竞争性抑制过程中,若增加作用物的浓度,则竞争时作用物占优势,抑制作用可以降低,甚至解除,这是竞争性抑制的特点。
②非竞争性抑制:有些非竞争性抑制剂可与活性中心外的必需基团结合,而不影响作用物与酶的结合,两者在酶分子上结合的位点不同。
这样形成的酶一作用物一抑制剂复合物不能释放产物,这种抑制作用不能用增加作用物的浓度消除抑制,故称非竞争性抑制。
③反竞争性抑制:此类抑制剂与非竞争性抑制剂不同,它只能与酶一作用物复合物结合,而不与游离酶结合,这种抑制作用称为反竞争性抑制。


抑制剂和激活剂对酶活性的影响
很少量的激活剂或抑制剂就会影响酶的活性,而且常具有特异。
激活剂和抑制剂不是绝对的,有些物质在低浓度时为某种酶的激活剂,而在高浓度时则成为该酶的抑制剂,NaCl是唾液淀粉酶的激活剂,但NaCl浓度到1/3饱和度时就可抑制唾液淀粉酶的活性。
酶活性
酶活力也称酶活性,是指酶催化一定化学反应的能力。
酶活力的大小可以用在一定条件下,它所催化的某一化学反应的转化速率来表示,即酶催化的转化速率越快,酶的活力就越高;反之,速率越慢,酶的活力就越低。
所以,测定酶的活力就是测定酶促转化速率。
酶转化速率可以用单位时间内单位体积中底物的减少量或产物的增加量来表示。
酶活力的测定既可以通过定量测定酶反应的产物或底物数量随反应时间的变化,也可以通过定量测定酶反应底物中某一性质的变化,如黏度变化来测定。
通常是在酶的最适pH 值和离子强度以及指定的温度下测定酶活力。
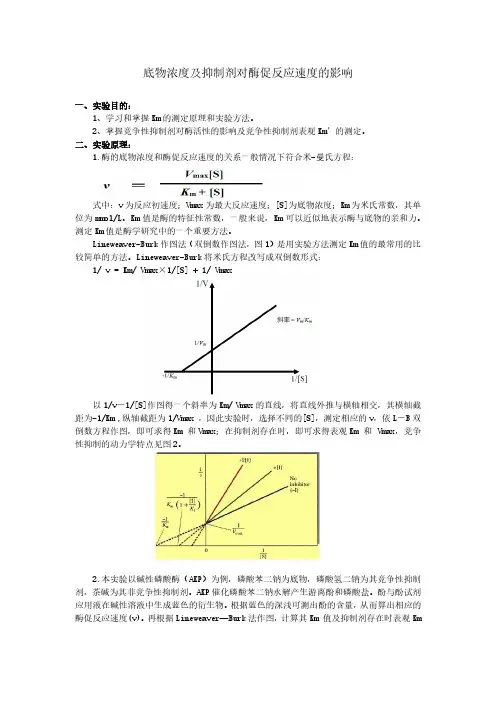
底物浓度及抑制剂对酶促反应速度的影响一、实验目的:1、学习和掌握Km的测定原理和实验方法。
2、掌握竞争性抑制剂对酶活性的影响及竞争性抑制剂表观Km’的测定。
二、实验原理:1.酶的底物浓度和酶促反应速度的关系一般情况下符合米-曼氏方程:式中:v为反应初速度;Vmax为最大反应速度;[S]为底物浓度;Km为米氏常数,其单位为mmol/L。
Km值是酶的特征性常数,一般来说,Km可以近似地表示酶与底物的亲和力。
测定Km值是酶学研究中的一个重要方法。
Lineweaver-Burk作图法(双倒数作图法,图1)是用实验方法测定Km值的最常用的比较简单的方法。
Lineweaver-Burk将米氏方程改写成双倒数形式:1/ v = Km/ Vmax×1/[S] + 1/ Vmax以1/v-1/[S]作图得一个斜率为Km/ Vmax的直线,将直线外推与横轴相交,其横轴截距为-1/Km ,纵轴截距为1/Vmax ,因此实验时,选择不同的[S],测定相应的v,依L-B双倒数方程作图,即可求得Km 和Vmax;在抑制剂存在时,即可求得表观Km 和 Vmax,竞争性抑制的动力学特点见图2。
2.本实验以碱性磷酸酶(AKP)为例,磷酸苯二钠为底物,磷酸氢二钠为其竞争性抑制剂,茶碱为其非竞争性抑制剂。
AKP催化磷酸苯二钠水解产生游离酚和磷酸盐。
酚与酚试剂应用液在碱性溶液中生成蓝色的衍生物。
根据蓝色的深浅可测出酚的含量,从而算出相应的酶促反应速度(v)。
再根据Lineweaver—Burk法作图,计算其Km 值及抑制剂存在时表观Km值的改变。
三、实验步骤:1.米氏常数测定按下表操作:2.抑制剂对酶促反应速度的影响按下表操作:3.计算以1/A660-1/[S]作图,求出Km及表观Km。
四、结果与分析:实验数据处理表格:1.米氏常数Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.206 0.318 0.412 0.496 0.5532.抑制剂存在时表观Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.170 0.185 0.275 0.376 0.389作图:计算:1.Km计算:由直线方程y=7.0999x+0.9662知,当y=0时,x=-0.1361,即-1/Km=-0.1361,所以Km=7.35mmol/L,纵截距为0.96622.表观Km计算:由直线方程y=10.895x+0.9662知,当y=0时,x=-0.08868,即-1/Km=-0.08868,所以Km=11.28mmol/L,纵截距为0.9662表观Km>Km,,且纵截距相等,所以抑制剂是竞争性抑制剂。

激活剂及抑制剂对酶活性的影响酶是一种催化化学反应的生物催化剂。
它可以降低化学反应的活化能,因此可以加速化学反应。
酶在许多生化过程中起着至关重要的作用。
因此,了解酶催化反应的机制以及如何改变酶的活性是非常重要的。
在这篇文章中,我们将讨论激活剂和抑制剂如何影响酶的活性。
激活剂激活剂是一种可以提高酶活性的分子。
它可以通过与酶结合来改变酶的构象,并增强酶的活性。
激活剂通常与酶的活性部位结合,并通过改变酶的构象来影响酶的功能。
激活剂对酶的作用可以是可逆的或不可逆的。
一些激活剂可以增加酶催化反应的速率常数(kcat)。
这意味着,反应的速率可以增加,而反应所需的物质量可以减少。
激活剂可以作用于酶本身或作用于底物。
例如,ATP(三磷酸腺苷)就是一种常见的激活剂,它可以作用于许多酶,并提高它们的活性。
ATP可以通过与酶活性部位结合来影响酶的构象,从而增强酶的催化活性。
抑制剂抑制剂是一种可以减低酶活性的分子。
它可以通过与酶结合来阻碍酶的功能。
抑制剂通常与酶的活性部位结合,并通过改变酶的构象来影响酶的功能。
抑制剂对酶的作用可以是可逆的或不可逆的。
抑制剂可以分为两类:竞争性抑制剂和非竞争性抑制剂。
竞争性抑制剂可以与底物竞争结合酶的活性部位,并阻止底物结合酶。
这可以减慢酶催化反应的速率。
例如,苯丙氨酸羧化酶具有两个基本底物,苯丙氨酸和乙酰辅酶A。
竞争性抑制剂可以与酶的活性部位结合,并阻止苯丙氨酸结合酶,从而减慢反应的速率。
另一方面,非竞争性抑制剂不结合酶的活性部位,而是结合在其他部位上。
这可能会影响酶的构象,从而降低酶的活性。
例如,草酸可以作为异柠檬酸脱氢酶的非竞争性抑制剂。
草酸的结构与该酶的辅酶结合部分相似,因此可以结合在辅酶-酶复合物上,从而降低酶的活性。
激活剂和抑制剂是可以影响酶活性的分子。
激活剂可以通过改变酶的构象来增强酶的催化活性,而抑制剂通过改变酶的构象来减慢酶的催化活性。
竞争性抑制剂和非竞争性抑制剂是两种不同类型的抑制剂,它们对酶的构象影响是不同的。