铝三角及其转化关系
- 格式:pptx
- 大小:427.97 KB
- 文档页数:9
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
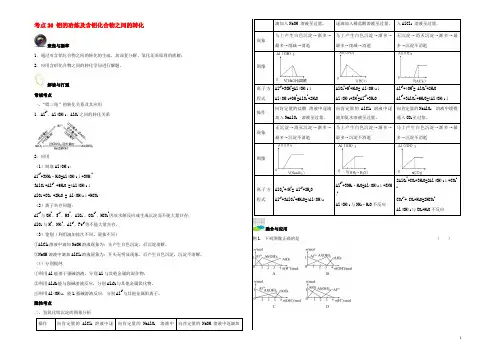
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。

①过量OH —②过量H +③H +④OH —⑤H +⑥OH —镁和铝重要知识点总结一、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式: A 、Al3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+: B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3++ 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存; b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
二、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3++ 3OH —== Al(OH)3↓ Al(OH)3 + OH —== AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3++ 3NH 3·H 2O == Al(OH)3↓ +3NH 4+现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3++ 4OH —== AlO 2—+ 2H 2OAl 3++3 AlO 2—+ 6 H 2O == 4Al(OH)3↓Al 3+Al(OH)3AlO 2—4、向AlCl 3溶液中逐滴滴入NaAlO 2有关反应: Al 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓ 现象:产生白色沉淀,继续滴加,沉淀不变化。


重难点九 铝的化合物之间的相互转化----“铝三角”【要点解读】 1.Al 3+―→Al(OH)3(1)可溶性铝盐与少量NaOH 溶液反应: (2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al 3+:Al(OH)3溶于强酸溶液: 3.Al 3+―→AlO 2-:可溶性铝盐与过量的强碱反应: 4.AlO 2-―→Al 3+:偏铝酸盐溶液与足量的盐酸反应: 5.AlO 2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸: 6.Al(OH)3―→ AlO 2- :Al(OH)3溶于强碱溶液: 【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】 1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO 2-→Al(OH)3最好通入CO 2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质 (1)金属单质:Al 等; (2)两性氧化物:Al 2O 3等; (3)两性氢氧化物:Al(OH)3 等;(4)弱酸的铵盐:(NH 4)2CO 3、CH 3COONH 4、(NH 4)2S 等; (5)弱酸的酸式盐:NaHCO 3、KHS 、NaHSO 3等。
【重难点指数】★★★★【重难点考向一】氢氧化铝的制取和性质探究【例1】实验室制取氢氧化铝的最佳方案是( )A.Al+H2O B.Al2O3+H2O C.AlCl3+NaOH D.Al2(SO4)3+NH3•H2O【重难点考向二】铝及其化合物性质探究【例2】某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的是( ) A.向氯化铝溶液中滴加过氨水,最终得到澄清溶液B.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气C.常温下铝与浓硝酸反应制得大量的NO2D.AlCl3溶液加热蒸干得到无水氯化铝晶体【重难点考向三】铝三角之间的转化【例3】A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)(1)写出化学式:A______,B________,C________,D________,E________;(2)写出下列反应的离子方程式:A→B:___________________________________________________;A→D:___________________________________________________。


第三章铁金属材料考点3 “铝三角”的转化关系及有关氢氧化铝沉淀的图像分析学业测评1.(2021·广东·深圳第二外国语学校高一期末)下列关于铝及其化合物的性质、用途的说法不正确的是A.铝粉和氢氧化钠混合物可用作下水道疏通剂B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3C.铝的氧化膜致密且熔点高,从而能保护内部金属D.铝制品廉价易得,适用于厨房制作和长期存放各类食物【答案】D【解析】A.铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,所以铝粉和氢氧化钠混合物可用作下水道疏通剂,故A正确;B.Al2O3和NaOH溶液反应生成可溶性偏铝酸钠,所以可用NaOH溶液除去Fe2O3粉末中少量的Al2O3,故B正确;C.铝和氧气反应生成的氧化膜致密且熔点高,从而能保护内部金属,故C正确;D.铝能够与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,故D错误;选D。
2.下列关于金属铝及其化合物的叙述不正确的是A.Al2O3不能跟所有的酸碱溶液反应B.铝是活泼的金属,在化学反应中容易失去电子,表现出还原性C.铝箔徃空气中用酒精灯加热可以融化,且发生剧烈燃烧D.铝箔在空气中用酒精灯加热可以观察到铝融化了但并不滴落【答案】C【解析】A.氧化铝和强酸、强碱反应,不能和弱酸弱碱反应,A正确;B.铝是比较活泼的金属,最外层有3个电子,在化学反应中易失去3个电子而达8电子的稳定结构,表现还原性,B正确;C.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,不会出现发生剧烈的燃烧,C错误;D.加热时铝和氧气会反应生成熔点很高的氧化铝,将内部熔化的铝包裹住,铝熔化了但是不会滴落,D正确;故选C。
3.现有MgO、Al2O3、Fe2O3、CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂A.氨水B.浓NaOH溶液C.NaCl溶液D.稀H2SO4【答案】B【解析】A.MgO、Al2O3、Fe2O3、CuO与氨水都不反应,故A不符合题意;B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3、CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;C.MgO、Al2O3、Fe2O3、CuO与NaCl溶液都不反应,故C不符合题意;D.MgO、Al2O3、Fe2O3、CuO与稀H2SO4都反应,故D不符合题意;故答案为B。

第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。


热点突破5 用数形结合思想理解“铝三角"[解题策略] Al3+、Al(OH)3、AlO错误!之间的转化关系(“铝三角”)写出上述转化的离子方程式:(1)①Al3++3NH3·H2O===Al(OH)3↓+3NH错误!;②Al3++3AlO错误!+6H2O===4Al(OH)3↓;③Al3++3OH-===Al(OH)3↓;(2)Al(OH)3+3H+===Al3++3H2O;(3)Al3++4OH-===AlO错误!+2H2O;(4)AlO-,2+4H+===Al3++2H2O;(5)①AlO错误!+CO2+2H2O===Al(OH)3↓+HCO错误!;②AlO -,2+H++H2O===Al(OH)3↓(6)Al(OH)3+OH-===AlO错误!+2H2O授课提示:对应学生用书第45页角度一借助图像理解“铝三角"(四个基本图像)1.可溶性铝盐溶液与NaOH溶液反应的两个图像操作向可溶性铝盐溶液中逐滴加入NaOH溶液至过量向NaOH溶液中逐滴加入可溶性铝盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失图像离子方程式Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO错误!+2H2OAl3++4OH-===AlO错误!+2H2O,3AlO错误!+Al3++6H2O===4Al(OH)3↓2.偏铝酸盐溶液与盐酸反应的两个图像操作向偏铝酸盐溶液中逐滴加入稀盐酸至过量向稀盐酸中逐滴加入偏铝酸盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→无沉淀(有但即溶)→出现沉淀→渐多→最多消失→沉淀不消失图像离子方程式AlO错误!+H++H2O===Al(OH)3↓,Al(OH)3+3H+===Al3++3H2OAlO错误!+4H+===Al3++2H2O,Al3++3AlO-2+6H2O===4Al(OH)3↓题组训练1.模仿上述图像,画出“向MgCl2、AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液至过量”的V(NaOH)沉淀图像.解析:NaOH溶液逐滴滴入含Mg2+、Al3+、H+的溶液时,OH-先与H+反应,然后再与Mg2+、Al3+同时反应生成Mg(OH)2、Al(OH)3,Mg2+和Al3+同时沉淀完全后溶解Al(OH)3。


微专题12 铝三角及其转化关系1.Al3+、Al(OH)3、AlO-2之间的转化关系实现上述各步转化的离子方程式:(1)①Al3++3NH3·H2O===Al(OH)3↓+3NH+4②Al3++3AlO-2+6H2O===4Al(OH)3↓③Al3++3OH-===Al(OH)3↓(2)Al(OH)3+3H+===Al3++3H2O(3)Al3++4OH-===AlO-2+2H2O(4)AlO-2+4H+===Al3++2H2O(5)①AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3②AlO-2+H++H2O===Al(OH)3↓(6)Al(OH)3+OH-===AlO-2+2H2O2.与Al(OH)3沉淀生成有关的图象分析(1)可溶性铝盐溶液与NaOH溶液反应的图象(从上述转化关系中选择符合图象变化的离子方程式,下同)。
操作可溶性铝盐溶液中逐滴加入NaOH溶液至过量NaOH溶液中逐滴加入可溶性铝盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失图象方程式序号AB:(1)③BD:(6) AB:(3)BC:(1)②(2)偏铝酸盐溶液与盐酸反应的图象。
操作偏铝酸盐溶液中逐滴加入稀盐酸至过量稀盐酸中逐滴加入偏铝酸盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀→出现沉淀→渐多→最多→沉淀不消失图象方程式序号AB:(5)②BC:(2)AB:(4)BC:(1)②3.可溶性铝盐与强碱反应的计算规律(1)求产物Al(OH)3的量①当n (OH -)≤3n (Al 3+)时,n [Al(OH)3]=13n (OH -);②当3n (Al 3+)<n (OH -)<4n (Al 3+)时,n [Al(OH)3]= 4n (Al 3+)-n (OH -);③当n (OH -)≥4n (Al 3+)时,n [Al(OH)3]=0,无沉淀。
“铝三角”转换关系与其图象问题一、“铝三角”中相互转化关系Al(OH)3为两性氢氧化物,同时与Al3+和AlO2-又可相互转化,其转化关系可用“铝三角”表示为:1. Al(OH)3+3HCl==AlCl3+3H2O Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4离:Al(OH)3+3H+==Al3++3H2O Al3++3NH3·H2O==Al(OH)3↓+3NH4+(用于制备氢氧化铝)2. AlCl3+3NaOH==Al(OH)3↓(白色胶状)+3NaCl离:Al3++3OH-==Al(OH)3↓3.AlCl3+3NaOH==Al(OH)3↓+3NaCl(强碱过量)AlCl3+4NaOH==NaAlO2+3NaCl+2H2O 离:Al(OH)3+NaOH==NaAlO2+2H2O 离:Al3++4OH-==AlO2-+2H2O4. NaAlO2+HCl+H2O==Al(OH)3↓+NaClNaAlO2+4HCl(过量)==AlCl3+NaCl+2H2O Al(OH)3+3HCl==AlCl3+3H2O 离:AlO2-+4H+==Al3++2H2O5. Al(OH)3+NaOH==NaAlO2+2H2O 离:Al(OH)3+OH-==AlO2-+2H2O6. NaAlO2+HCl(少量)+H2O==Al(OH)3↓+NaCl离:AlO2-+H++H2O==Al(OH)3↓NaAlO2+CO2(少量)+2H2O==Al(OH)3↓+NaHCO3离:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-2NaAlO2+CO2(过量)+3H2O==2Al(OH)3↓+Na2CO3离:2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-附:Al2O3+6HCl==AlCl3+3H20Al2O3+2NaOH==2NaAlO2+H2O 铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑二、“铝三角”转化关系中的图象问题①向AlCl3溶液中滴加NaOH溶液直到过量涉及到的离子方程式:②向NaOH溶液中滴加AlCl3溶液直至过量涉及到的离子方程式:③向AlCl3溶液中滴加稀氨水直至过量涉及到的离子方程式:④向NaAlO2溶液中滴加稀盐酸直至过量涉及到的离子方程式:⑤向稀盐酸中滴加NaAlO2溶液直至过量涉及到的离子方程式:⑥向NaAlO2溶液中通入气体直至过量涉及到的离子方程式:例:准确称取6g 铝土矿(含)样品放入盛有100mL溶液的烧杯中,充分反应后过滤,再后滤液中加入10mol /L NaOH 溶液,产生沉淀质量m(g)与所加NaOH 溶液的体积V(mL)关系如下图所示,试求1.溶液的物质的量浓度。
高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。