铝三角及其图像
- 格式:ppt
- 大小:1.94 MB
- 文档页数:45




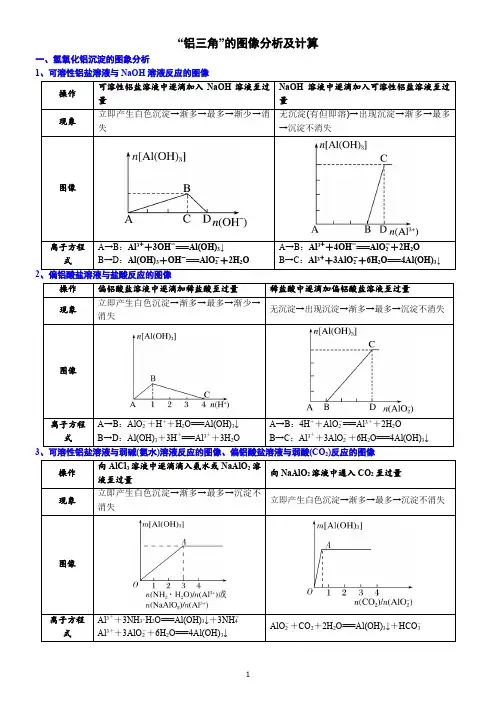
“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。

第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。




铝三角复习Al(OH)3的性质:两性氢氧化物Al(OH)3 + HCl === ;Al(OH)3 + NaOH === 。
一、Al(OH)3的两性电离方程式:()()由电离方程式可推出:二、铝三角(Al3+、Al(OH)3、AlO2-之间的转化关系)涉及到的四个离子方程式:① Al3+ + 3OH- === ② Al(OH)3 + OH- === ③ AlO2- + H+ + H2O === ④ Al(OH)3 + 3H+ ===(1) Al(OH)3 (2) Al(OH)3Al3+ AlO2- Al3+ AlO2-离子方程式:离子方程式:(1)(2)联合推出Al(OH)3Al3+ AlO2-三、与生成Al(OH)3沉淀有关的图像:1.把强碱溶液逐滴加到铝盐(Al3+)溶液中至过量 2. 把铝盐(Al3+)溶液逐滴加到强碱溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:3.把强酸溶液逐滴加到AlO2- 溶液中至过量 4. 把AlO2- 溶液逐滴加到强酸溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:5.把氨水逐滴加到铝盐(Al3+)溶液中至过量 6. 把CO2通入到AlO2- 溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:7.往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量①现象:③图像:②有关反应:四、制备Al(OH)3的方法:方法1:向铝盐溶液中加入化学方程式:离子方程式:方法2:向NaAlO2溶液中通入足量化学方程式:离子方程式:方法3:溶液和溶液混合化学方程式:离子方程式:课堂练习:1.已知某溶液中可能有Mg2+、Al3+、NH4+中的一种或几种,向其中加入NaOH溶液至过量,得到的图像可能如下:由图像分析溶液中的成分:①②③④2.向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。

高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。