铝三角图像专题
- 格式:pdf
- 大小:707.88 KB
- 文档页数:7




专题12突破铝三角的图像和计算提升练习高考化学一轮复习微专题一、单选题,共13小题1.(2022·浙江·金华市曙光学校模拟预测)下列反应的方程式不正确...的是 A .石灰石与醋酸反应:CO 23-+2CH 3COOH=2CH 3COO - +CO 2↑+H 2OB .铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):Ag(阳极)通电Ag(阴极)C .铜与稀硝酸反应:3Cu+2NO 3-+8H +=3Cu 2+ +2NO↑+4H 2OD .明矾溶液中加入少量氢氧化钡溶液:2Al 3+ +3SO 24-+ 3Ba 2++6OH -=2Al(OH)3↓+ 3BaSO 4↓2.(模拟)下列物质之间通过一步反应不能实现如图所示转化的是(部分反应中的2H O 已略去)选项 WX Y Z A2OCCO2COB 2CONaOH23Na CO3Na HCOCNaOH 3AlCl()3Al OH2NaAlOD 2Cl Fe2FeCl3FeClA .AB .BC .CD .D3.(2022·陕西·汉中市龙岗学校高三阶段练习)下列实验对应的离子方程式正确的是A .氢氧化钠溶液中滴入少量硫酸铝溶液:333OH Al Al(OH)-++=↓B .硫化钠溶液中通入过量2222SO :2S SO 2H O 3S 4OH --++=↓+C .次氯酸钙溶液中通入少量的2223CO :ClO H O CO HCO HClO --++=+D .水杨酸溶液中加入足量的碳酸氢钠溶液:+ HCO -3−−→+CO 2↑+H 2O4.(模拟)能正确表示下列变化的离子方程式是A .向次氯酸钙中通入过量的二氧化碳气体:Ca 2++2ClO -+CO 2+H 2O=2HClO+CaCO 3↓B .向硝酸铝溶液中滴加足量氢氧化钡溶液:Al 3+ +4OH -=AlO 2-+2H 2OC .向氯化铜溶液中通入硫化氢气体:S 2- +Cu 2+= CuS↓D .碳酸镁与稀硫酸反应:CO 23-+2H +=CO 2↑+H 2O5.(模拟)为探究Al 2(SO 4)3溶液与Ba(OH)2溶液的反应,取0.1mol·L -1的溶液进行如下实验:下列分析错误的是A .试管1中,当硫酸根离子恰好完全沉淀时,沉淀的质量最大B .试管2中,当钡离子恰好完全沉淀时,铝元素也完全转变为沉淀C .试管l 、2中,沉淀均会先增多后减少D .试管l 、2中,沉淀均含BaSO 46.(模拟)铵明矾()4422NH Al SO 12H O ⎡⎤⋅⎣⎦常用于发酵粉加工、油炸食品、粉条加工等食品工业,其实验室制备流程如图所示,已知:铵明矾的溶解度随温度升高明显增大。
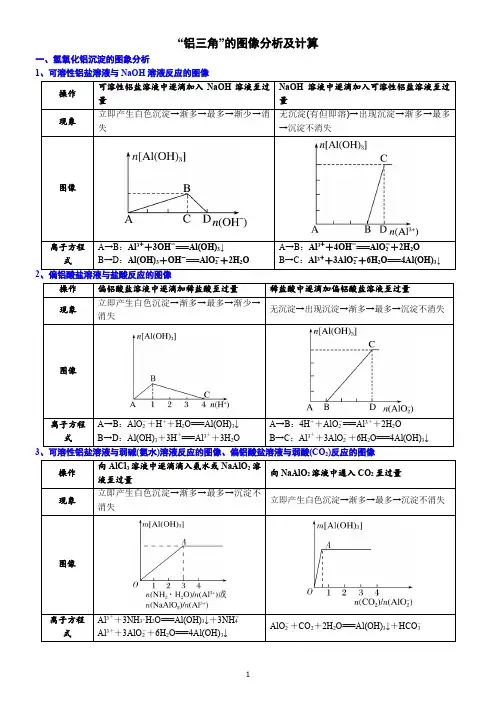
“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。


第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。


实用文档铝及其化合物、铝三角图像问题1、铝(1)物理性质:密度小熔点较低,硬度较小银白色金属。
(3)化学性质:①跟O 2及其它非金属反应:常温下,在空气中因生成氧化膜,具有抗腐蚀能力。
4Al+3O 2−−−→点燃2Al 2O 3 2Al+3S −−−→点燃Al 2S 3 ②跟某些氧化物:2Al+Fe 2O 3−→−∆2Fe+Al 2O 3 (铝热反应) ③跟水反应:2Al+6H 2O → 2Al(OH)3+3H 2↑ (一般不反应,只有氧化膜被破坏后反应)④跟酸的反应:2Al+6H +→ 3Al 3+ + 3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)⑤跟强碱溶液反应:2Al+2NaOH+2H 2O → 2NaAlO 2+3H 2↑2、Al 2O 3(两性氧化物):白色固体、熔点高(1)跟酸反应:Al 2O 3+6H + →2Al 3++3H 2O (2)跟碱反应:Al 2O 3+2OH -→AlO 2—+2H 2O3、Al(OH)3 (两性氢氧化物)Al(OH)3的两性:Al(OH)3 + 3H + → Al 3+ + 3H 2O Al(OH)3 + OH - → AlO 2- + 2H 2OAl(OH)3显两性的在本质是:H 2O + H + + AlO 2-垐?噲?Al(OH)3垐?噲?Al 3+ + 3OH -(1)物理性质:白色胶状物质,难溶于水(2)受热分解:2Al(OH)3−→−∆ Al 2O 3+3H 2O (3)Al(OH)3实验室制法:①可溶性铝盐加氨水:Al 3++3NH 3·H 2O →Al(OH)3↓+3NH 4+②可溶性偏铝酸盐与弱酸:AlO 2—+ H 2CO 3 +H 2O → Al(OH)3↓+ HCO 3—③ 3AlO 2- +Al 3++6H 2O →4Al(OH)3↓4、铝盐(1)Al 3+与碱溶液反应:Al 3++3OH -→Al(OH)3↓(碱不足)Al 3++4OH -→AlO 2-↓+2H 2O (碱过量)(2)Al 3+水解:Al 3++3H 2O 垐?噲?Al(OH)3+3H +(3)明矾:Kal(SO 4)2•12H 2O 是一种复盐。
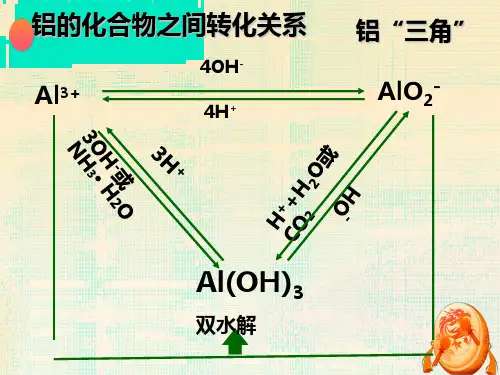
“铝三角”转换关系与其图象问题一、“铝三角”中相互转化关系Al(OH)3为两性氢氧化物,同时与Al3+和AlO2-又可相互转化,其转化关系可用“铝三角”表示为:1. Al(OH)3+3HCl==AlCl3+3H2O Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4离:Al(OH)3+3H+==Al3++3H2O Al3++3NH3·H2O==Al(OH)3↓+3NH4+(用于制备氢氧化铝)2. AlCl3+3NaOH==Al(OH)3↓(白色胶状)+3NaCl离:Al3++3OH-==Al(OH)3↓3.AlCl3+3NaOH==Al(OH)3↓+3NaCl(强碱过量)AlCl3+4NaOH==NaAlO2+3NaCl+2H2O 离:Al(OH)3+NaOH==NaAlO2+2H2O 离:Al3++4OH-==AlO2-+2H2O4. NaAlO2+HCl+H2O==Al(OH)3↓+NaClNaAlO2+4HCl(过量)==AlCl3+NaCl+2H2O Al(OH)3+3HCl==AlCl3+3H2O 离:AlO2-+4H+==Al3++2H2O5. Al(OH)3+NaOH==NaAlO2+2H2O 离:Al(OH)3+OH-==AlO2-+2H2O6. NaAlO2+HCl(少量)+H2O==Al(OH)3↓+NaCl离:AlO2-+H++H2O==Al(OH)3↓NaAlO2+CO2(少量)+2H2O==Al(OH)3↓+NaHCO3离:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-2NaAlO2+CO2(过量)+3H2O==2Al(OH)3↓+Na2CO3离:2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-附:Al2O3+6HCl==AlCl3+3H20Al2O3+2NaOH==2NaAlO2+H2O 铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑二、“铝三角”转化关系中的图象问题①向AlCl3溶液中滴加NaOH溶液直到过量涉及到的离子方程式:②向NaOH溶液中滴加AlCl3溶液直至过量涉及到的离子方程式:③向AlCl3溶液中滴加稀氨水直至过量涉及到的离子方程式:④向NaAlO2溶液中滴加稀盐酸直至过量涉及到的离子方程式:⑤向稀盐酸中滴加NaAlO2溶液直至过量涉及到的离子方程式:⑥向NaAlO2溶液中通入气体直至过量涉及到的离子方程式:例:准确称取6g 铝土矿(含)样品放入盛有100mL溶液的烧杯中,充分反应后过滤,再后滤液中加入10mol /L NaOH 溶液,产生沉淀质量m(g)与所加NaOH 溶液的体积V(mL)关系如下图所示,试求1.溶液的物质的量浓度。
- 1 -【高三复习专题总结】有关Al(OH)3的图像问题青海师大附中 郭丙银一、课程目标:(一)知识与技能掌握与Al(OH)3有关反应的定量关系,巩固Al(OH)3 沉淀形成及溶解的离子方程式(二)过程与方法:运用化学平衡移动原理分析氢氧化铝的两性掌握解图像题的方法,培养学生分析图像的能力。
(三)情感、态度、价值观:渗透量变引起质变和矛盾的哲学观点。
二、教学重点: 运用化学平衡移动原理分析氢氧化铝的两性三、教学难点:掌握解图像题的方法,培养学生分析图像的能力四、教学方法:多媒体演示、演示实验、知识点归纳总结五、教学内容:(一).有关Al(OH)3的图像问题1.【演示实验一】将NaOH 溶液逐滴滴入到AlCl 3溶液中,至过量;分析现象: ; 离子反应方程式: 。
2.【演示实验二】将AlCl 3溶液逐滴滴入到NaOH 溶液中,至过量;分析现象: ; 反应方程式: 。
沉淀质量 V NaOH沉淀质量 V AlCl3- 2 - 3.【演示实验三】学生自主分析、总结:将氨水逐滴加入到AlCl 3溶液中,至过量;现象: ;反应方程式: 。
4.【演示实验四】将盐酸逐滴滴入到NaAlO 2溶液中,至过量。
现象: ; 反应方程式: 。
5.【演示实验五】将NaAlO 2溶液逐滴滴入到盐酸中,至过量。
现象: ; 反应方程式: 。
6.【演示实验六】学生自主分析、总结:将CO 2通入NaAlO 2溶液中,至过量。
现象: ; 反应方程式: 。
7.【演示实验七】学生自主分析、总结:将AlCl 3溶液逐滴滴入到NaAlO 2溶液中,至过量现象: ; 反应方程式: 。
沉淀质量V HCl 沉淀质量 NH3•H2O 沉淀质量 V NaAlO2沉淀质量V CO2 沉淀质量 V AlCl3(二).离子共存问题:Al3+与因相互促进水解而不能大量共存;AlO2-与等也不能大量共存。
(三).氢氧化铝的制备1.用AlCl3选用的碱是,离子反应方程式是,可否选用KOH 、NaOH?并说明原因。
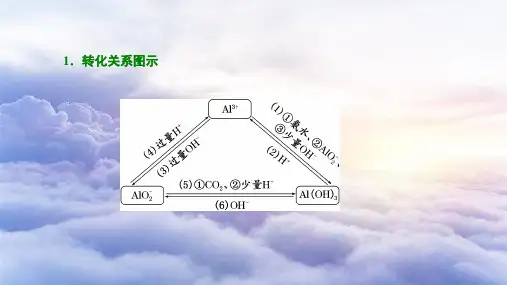
高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
铝及其化合物【学习目标】1.铝及其化合物的性质及用途2.铝三角及图像问题3.铝热反应◆感知高考1. [2020·江苏]下列有关物质的性质与用途具有对应关系的是A. 铝的金属活泼性强,可用于制作铝金属制品B. 氧化铝熔点高,可用作电解冶炼铝的原料C. 氢氧化铝受热分解,可用于中和过多的胃酸D. 明矾溶于水并水解形成胶体,可用于净水【答案】D【解析】A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;故选D。
2.[2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是()A. 明矾可用作净水剂和消毒剂B. 利用铝热反应可冶炼高熔点金属C. 铝可用作包装材料和建筑材料D. 氢氧化铝可用作治疗胃酸过多的药物【答案】A【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。
C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
◆核心知识1.铝的结构和存在铝位于元素周期表,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
【答案】第3周期ⅢA族,。
2.金属铝及其化合物的化学性质(1)转化关系①理清知识主线Al→Al2O3←Al(OH)3→⎩⎪⎨⎪⎧NaAlO2AlCl3Al2(SO4)3KAl(SO4)2·12H2O②形成网络构建(2)重要反应方程式(用方程式回答下列问题)①用化学方程式表示除去铁粉中的铝粉。
“铝三角”的图像及有关计算
【“铝三角”】
写出有关转化离子方程式。
【图像分析】“铝三角”转化关系中的图象问题
①向AlCl3溶液中滴加NaOH溶液直到过量
②向NaOH溶液中滴加AlCl3溶液直至过量
③向NaAlO2溶液中滴加稀盐酸直至过量
④向AlCl3溶液中滴加稀氨水直至过量
⑤向稀盐酸中滴加NaAlO2溶液直至过量
⑥向NaAlO2溶液中通入CO2气体直至过量
例1向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到
的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回
答下列问题:
(1)图中A点表示的意义是
(2)图中B点表示的意义是
(3)上述两步反应用总的离子方程式可表示为:
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(1)生成Al(OH)3沉淀的最大值 (2)Al(OH)3沉淀完全溶解于NaOH溶液成为NaAlO2溶液
(3)Al3++4OH-=AlO2-+2H2O (4)7.5 mL或17.5 mL
例2某研究学习小组对铝热反应实验展开研究。
高中教材必修2(人教
版)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发
出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅
《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质Al Al2O3Fe Fe2O3
熔点/℃660205415351462
沸点/℃246729802750-
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。
理由是:该
反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔
合形成铁铝合金。
你认为他的解释是否合理?答:
_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属
铝。
该实验所用试剂是_______________,反应的离子方程式为
_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应
还原产物中氮元素的化合价越低。
某同学取一定量上述的熔融物与一定
量很稀的硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液
中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积
(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
试回答下列问
题:
⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
___________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
__________;
上述现象说明溶液中_________________结合OH-的能力比_______强
(填离子符号)。
B与A的差值为_________mol。
B点对应的沉淀的物质的量为
________mol,C点对
应的氢氧化钠溶液的体积为___________mL
Ⅰ⑴合理 ⑵NaOH溶液 2Al+2NaOH+H2O=2NaAlO2+3H2↑ ⑶B
Ⅱ⑴H++OH-=H2O ⑵ NH4++OH-=NH3·H2O Al3+、Fe3+、 H+ , NH4+; (3)0.008 0.032mol 7mL
【巩固练习】
1.已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。
向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
2.在含1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4 D.最后的沉淀为2mol BaSO4、1mol
Al(OH)3
3.Al2(SO4)3和MgSO4混和,加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是( )
A. 2:1
B. 1:2
C. 1:1
D. 1:3
4.向10mL 0.1mol·溶液中,滴加等浓度溶液x mL,下列叙述正确的是()
A.x=10时,溶液中有、、,且
B.x=10时,溶液中有、、,且
C.x=30时,溶液中有、、,且
D.x=30时,溶液中有、、,且
5.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
______.
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B______;沉淀D______;溶液E______和_______.
(3)写出①、②、④三个反应的离子方程式,不是离子反应的写出其化学方程式.
①______;②______;④______.
(1)过滤;(2)Al2O3;Fe2O3;K2SO4;(NH4)2SO4、NH3.H2O;
(3)Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;Al(OH3 = Al2O3+3H2O
6.将一定质量的镁铝合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得如图关系
(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
(1)3.6g、2.7g (2)1.4mol/L
7.在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问:
(1)此溶液中同时含有____ mol____离子;
(2)用离子方程式表示MN段发生的反应是 ;
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)= ;
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL (1)0.02mol;OH- (2)Al(OH)3+3H+=Al3++3H2O (3)1mol (4)60ml
8.现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为
0.10mol,在此溶液中加入90mL 4.0mol/L的NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算x =0.4时,溶液中产生的沉淀是什么?物质的量是多少?
(2)计算沉淀中只有Fe(OH)3时x的取值范围,请在下图中画出沉淀总量(mol)随x(0 →1.0)变化的曲线。
0.10
沉淀总量/mol
1.0 x
(3)若Al3+和Fe3+的物质的量之和为nmol(n为合理值),其它条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
(1)0.06 mol Fe(OH)3 (2)0≤x≤0.6 (3)(0.36/n)-3<x<1。