第二讲“铝三角”及其图像
- 格式:doc
- 大小:216.50 KB
- 文档页数:6




高一化学必修一学问点:铝三角铝是高中化学重要的金属,也是我们日常生活中经常用到的金属材料,今日我要和大家共享的是〔高一化学〕必修一学问点:铝三角,期望能够关怀到大家好好学习并把握这局部学问,赶快学习起来吧。
高一化学必修一学问点:铝三角铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反响,也可以与碱反响。
点击图片可在新窗口翻开铝三角主要表达了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反响,同时具有自己特有的性质,可以与碱反响。
铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反响铝可以与大多数非金属单质反响,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2点击图片可在新窗口翻开2Al2O3;2Al+3S点击图片可在新窗口翻开Al2S3;2Al+3Cl2点击图片可在新窗口翻开2AlCl3;2.铝与酸反响这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
留意钝化也属于化学转变。
2Al+6HCl=2AlCl3+3H2;2Al+3H2SO4=Al2(SO4)3+3H2;3.铝与强碱反响大多数金属不与碱反响,与强碱反响,是铝特有的性质,(锌也可以发生类似的反响,了解即可)2Al+2NaOH+2H2O==2NaAlO2+3H2;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2;该反响的本质是铝首先与水反响,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2;然后,氢氧化铝与氢氧化钠反响,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要留意。
4.铝热反响铝热反响是指铝在高温条件下复原金属氧化物,置换金属单质的一种反响,不是特指与铝与氧化铁的反响。



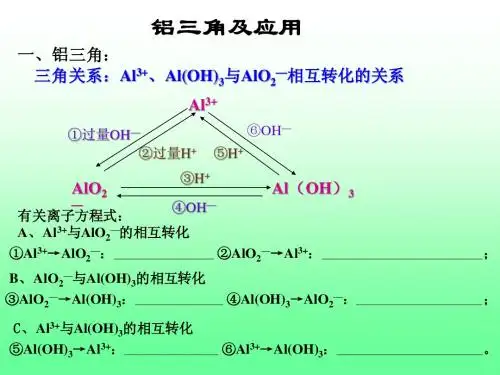
“铝三角”的图像及有关计算【“铝三角”】写出有关转化离子方程式。
【图像分析】“铝三角”转化关系中的图象问题①向AlCl3溶液中滴加NaOH溶液直到过量②向NaOH溶液中滴加AlCl3溶液直至过量③向NaAlO2溶液中滴加稀盐酸直至过量④向AlCl3溶液中滴加稀氨水直至过量⑤向稀盐酸中滴加NaAlO2溶液直至过量⑥向NaAlO2溶液中通入CO2气体直至过量例1向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
(1)生成Al(OH)3沉淀的最大值 (2)Al(OH)3沉淀完全溶解于NaOH溶液成为NaAlO2溶液(3)Al3++4OH-=AlO2-+2H2O (4)7.5 mL或17.5 mL例2某研究学习小组对铝热反应实验展开研究。
高中教材必修2(人教版)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:物质Al Al2O3Fe Fe2O3熔点/℃660 2054 1535 1462沸点/℃2467 2980 2750 -I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。
理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。
你认为他的解释是否合理?答:_________________(填“合理”或“不合理)⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。
该实验所用试剂是_______________,反应的离子方程式为_________________________________。


铝三角复习Al(OH)3的性质:两性氢氧化物Al(OH)3 + HCl === ;Al(OH)3 + NaOH === 。
一、Al(OH)3的两性电离方程式:()()由电离方程式可推出:二、铝三角(Al3+、Al(OH)3、AlO2-之间的转化关系)涉及到的四个离子方程式:① Al3+ + 3OH- === ② Al(OH)3 + OH- === ③ AlO2- + H+ + H2O === ④ Al(OH)3 + 3H+ ===(1) Al(OH)3 (2) Al(OH)3Al3+ AlO2- Al3+ AlO2-离子方程式:离子方程式:(1)(2)联合推出Al(OH)3Al3+ AlO2-三、与生成Al(OH)3沉淀有关的图像:1.把强碱溶液逐滴加到铝盐(Al3+)溶液中至过量 2. 把铝盐(Al3+)溶液逐滴加到强碱溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:3.把强酸溶液逐滴加到AlO2- 溶液中至过量 4. 把AlO2- 溶液逐滴加到强酸溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:5.把氨水逐滴加到铝盐(Al3+)溶液中至过量 6. 把CO2通入到AlO2- 溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:7.往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量①现象:③图像:②有关反应:四、制备Al(OH)3的方法:方法1:向铝盐溶液中加入化学方程式:离子方程式:方法2:向NaAlO2溶液中通入足量化学方程式:离子方程式:方法3:溶液和溶液混合化学方程式:离子方程式:课堂练习:1.已知某溶液中可能有Mg2+、Al3+、NH4+中的一种或几种,向其中加入NaOH溶液至过量,得到的图像可能如下:由图像分析溶液中的成分:①②③④2.向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。

高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
第二讲铝三角及其图像
【相互转化】
①
A l3+AlO2-
②
④③⑤⑥
Al(OH)3
【图像分析】
(1) 向Al3+的溶液中加入强碱(OH―)
现象:先出现白色溶液后消失
方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:
(2) 向强碱溶液中加入Al3+
现象:先没有沉淀后出现并不消失
方程式:Al3++4OH―==AlO2―+2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
(3) 向AlO2―溶液中加入H+
现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓
A l(O H)3+3H+==Al3++3H2O
图像:
(4) 向H+溶液中加入AlO2―
现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解
方程式:AlO2―+4H+==Al3++2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
作业:
例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?
解:(1) 设原合金中Mg的质量为X,Al的质量为y
Mg -----M g(O H)2Al-----A l(O H)3
24 58 27 78
x 11.6 y 19.4-11.6==7.8
x=4.8 g y == 2.7 g
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)
则c(HCl)== 5*160/100= 8 mol/L
[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )
A.78g
B.15.6g
C.7.8g
D.3.9g
2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
例2、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。
请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入
NaOH溶液的体积V变化如右图所示。
当V1=160mL时,
则金属粉末中n(Mg)=mol,V2=mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,
则滴入NaOH溶液的体积V(NaOH)mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条件的a的取值范围是:。
解:(1) n(H+)=2*0.1*2==0.4 mol
当V1=160mL时,中和过量H+消耗了OH―0.16 mol
则与金属反应用去H+0.4—0.16==0.24 mol
设Mg 的物质的量为x mol,Al的物质的量为y mol
Mg--2H+--Mg2+---2OH―--M g(O H)2Al---3H+---Al3+--3OH―-A l(O H)3
x 2x y 3y
2x+3y==0.24 x+y==0.1 解得,x==0.06 mol y= 0.04 mol
则镁的物质的量为0.06mol ,铝的物质的量为0.04mol
V2===(0.16+2*0.06+3*0.04)/1==0.44L==440 mL
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH) 则NaOH的体积为400 mL
(3) 若沉淀中无A l(O H)3则说明Al3+全部转化为NaAlO2,则
n(NaOH)≧n(NaCl)+n(NaAlO2)==n(HCl)+n(Al3+)
0.45≧0.4+0.1-a 解得,a≧0.05
1>a≧0.05
[点击试题]1.将溶液(或气体)X逐渐加入到(或通入到)一定量的Y
溶液中,产生沉淀的量m与加入X物质的量n的关系如下图,符合图中情况的一组物质是
2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/l的盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
(a)混合物中NaOH的质量为,
(b)混合物中AlCl3质量为
(c)混合物中MgCl2质量为,
(d)P点表示盐酸的体积是。
将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶
液,用1mol/LNaOH溶液滴定得下图关系
(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
【延伸·拓展】
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。
现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液中逐滴加入4mol/L NaOH溶液,所加的NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
⑴图中OC 段没有沉淀生成,此阶段发生反应的离子方程式为: ⑵在DE 段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_________________________。
上述现象说明溶液中______离子结合OH -的能力最弱。
⑶B 与A 的差值为____________ mol 。
⑷B 对应的沉淀量为__________mol ,C 对应的溶液体积为____________mL 。
【巩固练习】
1.在10mL 含有AlO 2-离子的溶液中逐滴加入 1mol /L 的盐酸,所得Al(OH)3沉淀质量和所加盐 酸的体积关系如图所示。
问:
(1)此溶液中同时含有____mol____离子;
(2)线段AM 表示的意义是 , MN 表示的意义是 ; (3)点M 表示的意义是 , 点N 表示的意义是 ; (4)C(或M)点的纵坐标为0.78,则c(AlO 2-)= ;
(5)点B 的横坐标为30,则到点N 处滴入的HCl 溶液体积为 mL 2.现有AlCl 3和FeCl 3的混合溶液,其中Al 3+和Fe 3+的物质的量之和为0.10mol ,在此溶液中加入90 m L 4.0mol/L 的NaOH 溶液,使其充分反应,设Al 3+物质的量与总物质的量的比值为x 。
(1)根据反应的化学方程式计算x =0.4时,溶液中产生的沉淀是什么?物质的量是多少?
(2)计算沉淀中只有Fe(OH)3的x 淀总量(mol)
随x(0 →1.0)变化的曲线。
(3)若Al3+和Fe3+的物质的量之和为Amol(A为合理值),其它条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。