铝三角及其铝图像问题
- 格式:doc
- 大小:185.50 KB
- 文档页数:3
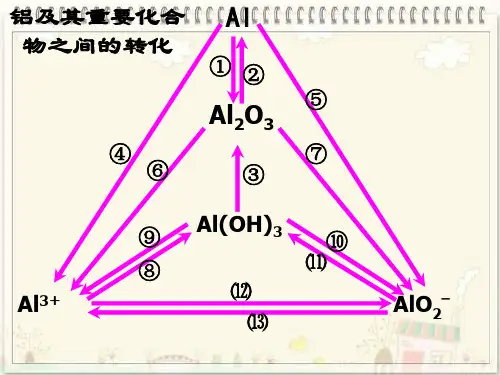
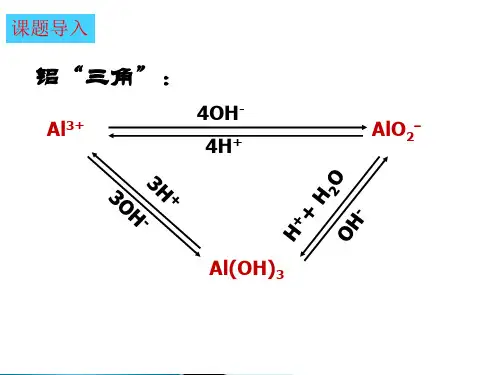
①过量OH— ②过量H + ③H + ④OH — ⑤H + ⑥OH — “铝三角”的图像分析及计算知识点一、铝三角1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系2、铝三角的应用①制取Al(OH)3常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32-知识点二、铝的化合物的有关图象1、基本图象①向铝盐溶液中逐滴滴加强碱性溶液直至过量 如若将强碱性溶液换成氨水又是怎样的图像?现象:先产生沉淀,后沉淀消失。
现象:Al 3+ + 3OH -= Al(OH)3↓ 离子方程式:Al(OH)3 + OH - = AlO 2-+2H 2O如若将强碱性溶液换成氨水又是怎样的图像?③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 将强酸溶液换成弱酸(如通入CO 2)又是怎样的图像?现象: 现象:离子方程式: 离子方程式:Al 3+ Al(OH)3AlO 2—2、基本图象的拓展①若AlCl3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?现象:开始产生沉淀,之后沉淀部分溶解写出涉及的离子方程式:Mg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O②若AlCl3溶液中除混有外MgCl2,还混有盐酸,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应有何不同,图象有什么样的变化?现象:开始无沉淀,之后产生沉淀,之后沉淀部分溶解H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O③若AlCl3溶液中除混有MgCl2和盐酸外,还混有NH4Cl,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应又有何不同,图象又有什么样的变化?现象:离子方程式:H+ + OH-= H2OMg2+ + 2OH-= Mg (OH)2↓Al3+ + 3OH-= Al(OH)3↓NH4++ OH-NH3·H2OAl(OH)3 + OH - = AlO 2-+2H 2O【变式训练1】Al 2(SO 4)3和MgSO 4混和,加适量水溶解,再加入KOH 溶液,析出的沉淀量(W)与KOH 溶液体积(V)的关系如图,则Al 2(SO 4)3和MgSO 4的物质的量之比是A . 2:1B . 1:2C . 1:1D . 1:3 【典型例题】例1 向30 mL 1 mol·L -1的AlCl 3溶液中逐渐加入浓度为4 mol ·L -1的NaOH 溶液,若产生0.78 g 白色沉淀,则加入的NaOH 溶液的体积可能为 ( )A .3 mLB . mLC .15 mLD . mL例2某无色溶液中,已知含有H +、Mg 2+、Al 3+等阳离子,逐滴加入NaOH(溶液),则消耗NaOH(溶液)体积(x 轴)和生成沉淀量(y 轴)之间的函数关系,可用下图表示,则下列图中正确的是 ( )例3 将0.1 mol 的镁、铝混合物溶于100 mL 2 mol ·L -1的H 2SO 4溶液中,然后再滴加1 mol ·L -1的NaOH 溶液。


高二化学秋季班(教师版)教师日期学生课程编号03 课型复习课题铝的图像及铝三角教学目标1、数量掌握与铝的化合物有关的基础图像问题,能够知道解题图像题的一般思路。
2、掌握铝三角中涉及到的相关方程式以及应用。
教学重点1.与铝的化合物有关的基础图像问题;2.解图像题的一般解题思路。
3.铝三角的转化。
教学安排版块时长1 知识梳理60mins2 课堂小憩5mins3 典例解析50mins4 师生总结5mins5 课后作业40mins铝的图像及铝三角知识梳理一、铝的相关图像汇总实验操作实验现象反应原理坐标图像1.往AlCl3 溶液中先产生白色沉逐滴加入NaOH 淀,后溶解溶液至过量2.往NaOH 溶液先无明显现中加入 AlCl3 溶液象,后产生沉至过量淀3.往NaAlO2 溶液先产生沉淀,中加入稀盐酸至后溶解过量4.往稀盐酸溶液先无现象,后中加入NaAlO2 至产生沉淀过量5.往NaAlO2 和无现象,产生NaOH 混合溶液中沉淀,后溶解加入HCl 溶液至过量6.往AlCl3 溶液中产生沉淀,后滴加入氨水至过沉淀的量不变量高二化学秋季课程铝的图像及铝三角2/ 228.往NaAlO2 溶液产生沉淀,后中加入 AlCl3 溶液沉淀的量不变9.往NaAlO2 溶液产生沉淀,后中通入CO2(或过沉淀的量不变量)10.往AlCl3 和HCl先无明显现混合溶液中加象,后产生沉NaOH 至过量淀,最后沉淀溶解11.往Al3+、Mg2+、先无明显现H+各 1mol 的混合象,再产生沉溶液中加NaOH 淀,后部分溶溶液至过量解。
12.往OH-、AlO2-、开始沉淀量不Mg(OH)2 各1mol变,再增加,的混合溶液中加后完全溶解入盐酸至过量【答案】实验操作实验现象反应原理坐标图像1.往AlCl3 溶液中逐滴加入NaOH 溶液至过量先产生白色沉淀,后溶解Al3+ + 3OH-→Al(OH)3↓Al(OH)3+OH-→AlO-2 + 2H2O2.往NaOH 溶液中加入AlCl3 溶液至过量先无明显现象,后产生沉淀Al3+ + 4OH-→AlO-2 + 2H2OAl3++3AlO2- +6H2O→4Al(OH)3↓3.往NaAlO2 溶液高二化学秋季课程铝的图像及铝三角3/ 224.往稀盐酸溶液先无现象,后中加入NaAlO2 至产生沉淀AlO-2 +4H+→Al3+ +2H2O过量Al3++3AlO-2+6H2O→4Al(OH)3↓5.往NaAlO2 和NaOH 混合溶液中加入HCl 溶液至过量无现象,产生沉淀,后溶解OH-+H+→H2OAlO-2+ H+ + H2O→Al(OH)3↓Al(OH)3 + 3H+→Al3+ + 3H2O6.往AlCl3 溶液中产生沉淀,后滴加入氨水至过沉淀的量不变Al3++3NH3·H2O→Al(OH)3↓+量3NH4+7.往AlCl3 溶液中产生沉淀,后加入 NaAlO2 溶液沉淀的量不变Al3++3AlO-2 +6H2O→4Al(OH)3↓8.往NaAlO2 溶液产生沉淀,后中加入 AlCl3 溶液沉淀的量不变Al3++3AlO-2+6H2O→4Al(OH)3↓9.往NaAlO2 溶液产生沉淀,后2AlO-2+CO2+3H2O→2Al(OH)3↓中通入CO2(或过沉淀的量不变+CO32-量) 或 AlO-2+CO2 +2H2O→Al(OH)3↓+HCO32-10.往AlCl3 和HCl OH-+H+→H2O先无明显现混合溶液中加象,后产生沉Al3+ + 3OH-→Al(OH)3 ↓NaOH 至过量淀,最后沉淀Al(OH)3 + OH-→AlO-2溶解+ 2H2O11.往Al3+、Mg2+、OH-+H+→H2O先无明显现H+各 1mol 的混合Al3+ + 3OH-→Al(OH)3 ↓高二化学秋季课程铝的图像及铝三角4/ 2212.往OH-、AlO2-、OH-+H+→H2O开始沉淀量不Mg(OH)2 各1mol变,再增加,AlO-2+ + H2O→Al(OH)3↓的混合溶液中加后完全溶解Al(OH)3 + 3H+ →Al3+ + 3H2O入盐酸至过量Mg(OH)2+2H+→Mg2+ +2H2O【练一练】1.将物质 X 逐渐加入(或通入)Y 溶液中,生成沉淀的量与加入 X 的物质的量关系如图所示,符合图示情况的是()A B C DX CO2 HCl NaOH AlCl3Y Ca(OH)2 NaAlO2 AlCl3 NaOH【答案】C2.向物质的量浓度均为 1 mol·L-1 的 AlCl3 和盐酸的混合溶液中逐滴滴入 NaOH 溶液,下图[n 表示 Al(OH)3 的物质的量、V 表示 NaOH 溶液的体积]能正确表示这个反应过程的是()【答案】D二、铝三角的转换完成上述的离子方程式:(1)①____________________________________________________②____________________________________________________③____________________________________________________(2)____________________________________________________(3)____________________________________________________(4)____________________________________________________(5)①____________________________________________________②____________________________________________________(6)____________________________________________________【答案】(1)①Al3++3NH3·H2O→Al(OH)3↓+3NH++3AlO-+③Al3++3OH-→Al(OH)3↓(2)Al(OH)3+3H+→Al3 ++3H2O(3)Al3++4OH-→AlO-+→Al3++2H2O-(5)①AlO--++H2O→Al(OH)3↓-(6)Al(OH)3+OH-→AlO-三、铝三角的应用1.判断离子共存Al3+只能存在于强酸性溶液中,不能与显碱性的物质大量共存,如____________________ __________________________等;AlO-2.判断离子先后顺序当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH++、Al3+的混合溶液中逐滴加入 NaOH 溶液,NaOH 先与_______反应,再与______________反应生成沉淀,再与________反应,最后才溶解______________沉淀。


第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
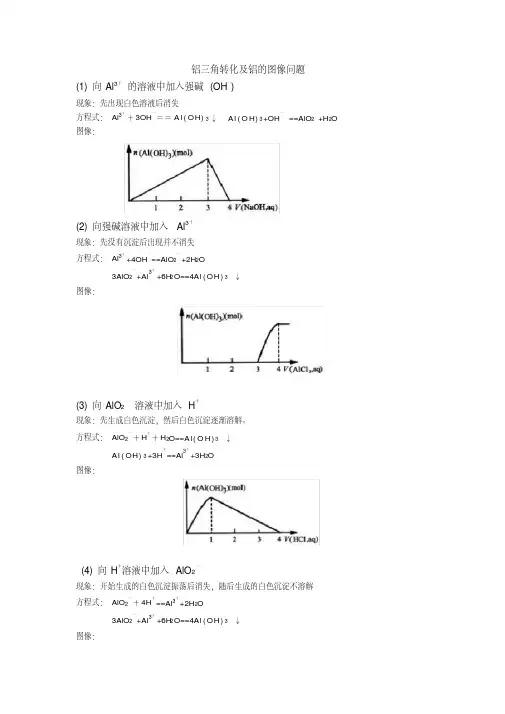
铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(OH)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4Al(OH)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(OH)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4Al(OH)3↓图像:具体应用:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加 5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。


“铝三角”转换关系与其图象问题1. “铝三角”中相互转化关系为两性氢氧化物,它在水溶液中存在酸式或碱式两种电离平衡:,同时又可相互转化,其转化关系可用“铝三角”表示为:应用:判断离子共存及Al(OH)3的制备Al3+只存在于强酸性溶液中,-2AlO只存在于强碱性溶液中,Al3+与-2AlO不能共存。
制备Al(OH)3一般用Al3++NH3·H2O或-2AlO+CO2+H2O。
铝盐和强碱溶液反应的计算:铝盐和强碱溶液作用生成Al(OH)3的计算反应关系:①Al3++3OH-====Al(OH)3↓(生成沉淀)②Al(OH)3+OH-====-2AlO+2H2O(沉淀溶解)③Al3++4OH-====-2AlO+2H2O(沉淀生成,又恰好全溶解)分析上述三个反应关系,可以建立如下计算Al(OH)3沉淀量生成的关系式:当n(Al3+)/n(OH-)≥1/3时,m〔Al(OH)3〕=78 g·mol-1·n(OH-)/3;当n(Al3+)/n(OH-)≤1/4时,m〔Al(OH)3〕=0;当1/4<n(Al3+)/n(OH-)<1/3时,m〔Al(OH)3〕=78 g·mol-1·[4n(Al3+)-n(OH)-]。
例1:有镁、铝混合粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸中,若要使沉淀质量达到最大值,则需加入2 mol·L-1的氢氧化钠溶液的体积为()A.1 000 mLB.500 mLC.100 mLD.1 500 mL解析:依题意,先写出有关反应的化学方程式:Mg+2HCl====MgCl2+H2↑2Al+6HCl====2AlCl3+3H2↑MgCl2+2NaOH====Mg(OH)2↓+2NaClAlCl3+3NaOH====Al(OH)3↓+3NaCl依化学方程式,仅当镁、铝全部以Mg(OH)2、Al(OH)3沉淀,即沉淀质量达到最大值时,溶液中只存在NaCl,故当沉淀的量最多时n(NaOH)=n(HCl)。
实用文档铝及其化合物、铝三角图像问题1、铝(1)物理性质:密度小熔点较低,硬度较小银白色金属。
(3)化学性质:①跟O 2及其它非金属反应:常温下,在空气中因生成氧化膜,具有抗腐蚀能力。
4Al+3O 2−−−→点燃2Al 2O 3 2Al+3S −−−→点燃Al 2S 3 ②跟某些氧化物:2Al+Fe 2O 3−→−∆2Fe+Al 2O 3 (铝热反应) ③跟水反应:2Al+6H 2O → 2Al(OH)3+3H 2↑ (一般不反应,只有氧化膜被破坏后反应)④跟酸的反应:2Al+6H +→ 3Al 3+ + 3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)⑤跟强碱溶液反应:2Al+2NaOH+2H 2O → 2NaAlO 2+3H 2↑2、Al 2O 3(两性氧化物):白色固体、熔点高(1)跟酸反应:Al 2O 3+6H + →2Al 3++3H 2O (2)跟碱反应:Al 2O 3+2OH -→AlO 2—+2H 2O3、Al(OH)3 (两性氢氧化物)Al(OH)3的两性:Al(OH)3 + 3H + → Al 3+ + 3H 2O Al(OH)3 + OH - → AlO 2- + 2H 2OAl(OH)3显两性的在本质是:H 2O + H + + AlO 2-垐?噲?Al(OH)3垐?噲?Al 3+ + 3OH -(1)物理性质:白色胶状物质,难溶于水(2)受热分解:2Al(OH)3−→−∆ Al 2O 3+3H 2O (3)Al(OH)3实验室制法:①可溶性铝盐加氨水:Al 3++3NH 3·H 2O →Al(OH)3↓+3NH 4+②可溶性偏铝酸盐与弱酸:AlO 2—+ H 2CO 3 +H 2O → Al(OH)3↓+ HCO 3—③ 3AlO 2- +Al 3++6H 2O →4Al(OH)3↓4、铝盐(1)Al 3+与碱溶液反应:Al 3++3OH -→Al(OH)3↓(碱不足)Al 3++4OH -→AlO 2-↓+2H 2O (碱过量)(2)Al 3+水解:Al 3++3H 2O 垐?噲?Al(OH)3+3H +(3)明矾:Kal(SO 4)2•12H 2O 是一种复盐。
铝的转化及图像【知识要点】一、铝三角1——弱碱或适量强碱;2——强碱;3——强碱过量;4——弱酸(弱酸性氧化物)或适量强酸;5——强酸;6——强酸过量(1)往铝片中滴加稀盐酸(2)往铝片中滴加NaOH溶液(3)往Al2O3中滴加稀盐酸(4)往Al2O3中滴加NaOH溶液(5)往AlCl3中滴加氨水至过量(6)往AlCl3中滴加NaOH溶液至过量(7)往NaOH溶液中滴加AlCl3至过量(8)往含少量HCl的AlCl3溶液滴加NaOH溶液至过量(9)往NaAlO2溶液中滴加盐酸至过量(10)往盐酸中滴加NaAlO2溶液至过量(11)往含少量NaOH的NaAlO2溶液中滴加盐酸至过量(12)往NaAlO2溶液中通入过量的CO2气体二、相互转化图像(1)向一定量氯化铝溶液中逐滴滴加氢氧化钠溶液。
离子方程式:以氢氧化钠的物质的量为横坐标,以沉淀的物质的量为纵坐标画出关系图像。
(2)向一定量氢氧化钠溶液逐滴滴加氯化铝溶液。
离子方程式:以氯化铝的物质的量为横坐标,以沉淀的物质的量为纵坐标画出关系图像。
(3)向一定量偏铝酸钠溶液逐滴滴加盐酸溶液离子方程式:以盐酸的物质的量为横坐标,以沉淀的物质的量为纵坐标画出关系图像。
(4)向一定量盐酸溶液逐滴滴加偏铝酸钠溶液离子方程式:以偏铝酸钠的物质的量为横坐标,以沉淀的物质的量为纵坐标画出关系图像。
三、基本图象的拓展1.若AlCl3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?2.若AlCl3溶液中除混有外MgCl2,还混有盐酸,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应有何不同,图象有什么样的变化?【典型例题】1.0.2mol/L Al2(SO4)3溶液100mL,加入0.4mol/L NaOH溶液,为得到澄清溶液,最少需加入NaOH溶液的体积(mL)为()A.200 B.300 C.400 D.7002.向20mL 2mol/L AlCl3溶液中加入30mL NaOH溶液,充分反应后得到0.78g沉淀,则NaOH溶液的物质的量浓度是()A.1mol/L B.2mol/L C.5mol/L D.8mol/L3.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为()A.6:1B.3:1C.2:1D.1:24.有镁铝合金10.2g,恰好完全溶于4mol/L的盐酸275mL里,若加入2mol/L氢氧化钠溶液,使得沉淀得到最大量,则需加入此种NaOH溶液体积为_____________________5.向50mL1mol/LAlCl3溶液中加入1mol/LNaOH溶液160mL,求能产生氢氧化铝沉淀多少克?6.有100mL2mol/LAlCl3溶液与4mol/L的KOH溶液反应,若要产生7.8gAl(OH)3沉淀,则需加入KOH 溶液多少毫升?7.在10ml2mol/LNaAlO2溶液中加入4mol/LHCl25mL,求有无Al(OH)3沉淀生成?若有沉淀生成求其质量为多少克。
高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)
现象:先出现白色溶液后消失
方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:
(2) 向强碱溶液中加入Al3+
现象:先没有沉淀后出现并不消失
方程式:Al3++4OH―==AlO2―+2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
(3) 向AlO2―溶液中加入H+
现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓
A l(O H)3+3H+==Al3++3H2O
图像:
(4) 向H+溶液中加入AlO2―
现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
具体应用:
例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?
解:(1) 设原合金中Mg的质量为X,Al的质量为y
Mg -----M g(O H)2Al-----A l(O H)3
24 58 27 78
x 11.6 y 19.4-11.6==7.8
x=4.8 g y == 2.7 g
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)
则c(HCl)== 5*160/100= 8 mol/L
[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )
A.78g
B.15.6g
C.7.8g
D.3.9g
2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
例2、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH 溶液。
请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入
NaOH溶液的体积V变化如右图所示。
当V1=160mL时,
则金属粉末中n(Mg)=mol,V2=mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,
则滴入NaOH溶液的体积V(NaOH)mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条
件的a的取值范围是:。
解:(1) n(H+)=2*0.1*2==0.4 mol
当V1=160mL时,中和过量H+消耗了OH―0.16 mol
则与金属反应用去H+0.4—0.16==0.24 mol
设Mg 的物质的量为x mol,Al的物质的量为y mol
Mg--2H+--Mg2+---2OH―--M g(O H)2Al---3H+---Al3+--3OH―-A l(O H)3
x 2x y 3y
2x+3y==0.24 x+y==0.1 解得,x==0.06 mol y= 0.04 mol
则镁的物质的量为0.06mol ,铝的物质的量为0.04mol
V2===(0.16+2*0.06+3*0.04)/1==0.44L==440 mL
(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH) 则NaOH的体积为400 mL
(3) 若沉淀中无A l(O H)3则说明Al3+全部转化为NaAlO2,则
n(NaOH)≧n(NaCl)+n(NaAlO2)==n(HCl)+n(Al3+)
0.45≧0.4+0.1-a 解得,a≧0.05
1>a≧0.05
[点击试题]1.将溶液(或气体)X逐渐加入到(或通入到)一定量的Y溶液中,产生沉淀的量m与加入X物质的量n的关系如下图,符合图中情况的一组物质是
2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/l的盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
(a)混合物中NaOH的质量为,
(b)混合物中AlCl3质量为
(c)混合物中MgCl2质量为,
(d)P点表示盐酸的体积是。