周围神经病的临床诊断
- 格式:pdf
- 大小:217.19 KB
- 文档页数:8



痛性周围神经病的诊断和治疗共识(中华神经科杂志)痛性周围神经病(painful peripheral neuropathy) 是以神经病理性疼痛(neuropathic pain) 为突出表现的周围神经病,通常是指痛性感觉周围神经病(painful sensory peripheral neuropathies) 或痛性感觉运动周围神经病(painful sensory and motor peripheral neuropathies)。
在本文中是指痛性感觉周围神经病以及泛化于伴有疼痛症状的周围神经病,包括可有运动- 感觉共存的混合体。
痛性周围神经病可以是单一的疾病主体,也可以是系统性疾病的表现。
病变主要累及小或无髓神经纤维(C 类纤维),可伴有或不伴有大纤维的病变。
一、病因和分类痛性周围神经病的病因多种多样,分为先天遗传性和后天获得性两大类。
先天遗传性痛性周围神经病主要包括:遗传性感觉和自主神经病、家族性淀粉样变性多发性神经病、Fabry 病、卟啉性神经病、Tangier 病等。
后天获得性痛性周围神经病根据发病原因主要包括:(1) 代谢性和营养障碍性:最常见的为糖代谢异常如糖尿病、糖耐量异常引起的相关周围神经病,尿毒症性多发性周围神经病,甲状腺疾病相关性周围神经病,维生素缺乏或过量等引起的周围神经病;(2) 外伤和压迫性:嵌压性周围神经病、急慢性外伤周围神经病;(3) 免疫介导性:吉兰- 巴雷综合征、淀粉样变性多发性神经病、血管炎性周围神病、副蛋白血症性周围神经病、结节病性周围神经病等;(4) 感染性:人类免疫缺陷病毒相关性周围神经病、Lyme 病周围神经病、麻风病周围神经病等;(5) 药物或其他理化因素中毒性:呋喃唑酮、拉米夫定等药物或酒精、砷、铊等;(6) 肿瘤相关周围神经病:直接浸润或远隔效应;(7) 隐源性,也称特发性痛性感觉性神经病。
痛性周围神经病的病因根据发病的频度依次为:糖尿病,糖耐量异常,特发性,家族性,维生素缺乏或过量(B12、B1、B6),甲状腺疾病,炎症性或免疫性(Sjögren 综合征,系统性红斑狼疮,风湿性关节炎),副肿瘤性,药物性( 胺碘酮、氯喹、秋水仙碱、氨苯砜、戒酒硫、异烟肼、甲硝唑、苯妥英、萘磺苯酰脲、长春新碱),毒物或重金属( 氨酰、砷、铊、氧化乙烯)。



糖尿病周围神经病:诊断主要依靠感觉和自主神经症状为主的多发性周围神经病的症状和体征,常见类型是远端对称性多发性周围神经病伴自主神经功能障碍,可出现四肢持续性疼痛,感觉症状通常子下肢远端开始,主要表现为远端疼痛,还可出现对称性麻木等感觉障碍,可由手套-袜套感觉减退或过敏。
诊断依靠:确切的糖尿病诊断依据;四肢持续性疼痛或感觉障碍;双侧或至少一侧拇指震动觉异常;双侧踝反射消失;感觉神经传导速度减低。
患者糖尿病家族史,并有双侧下肢腱反射减弱,双足疼痛,该病待排外。
坐骨神经痛:是指炎坐骨神经通路及其分支区内的疼痛综合征。
临床上继发性坐骨神经痛较为常见,是坐骨神经通路受周围组织或病变压迫或刺激所致,少数继发于全身疾病,根据受损部位分为根性和干性坐骨神经痛,其中以腰椎间盘突出引起者最为多见。
疼痛为沿坐骨神经径路由腰部、臀部向股后。
小腿后外侧和足外侧放射。
疼痛常为持续性钝痛,阵发性加剧,根性痛在咳嗽、用力时加剧,查体可见直腿抬高试验阳性。
患者腰椎MRI示腰3-4椎间盘突出,椎管变窄。
腰4-5、腰5-骶1间盘膨出。
肌电图为双侧坐骨神经源性改变,该病不能除外。
慢性炎症性脱髓鞘性多发性神经病(CIDP):慢性Guillain-Barre综合征,是一组免疫介导的炎性脱髓鞘疾病,呈慢性进展或复发性病程。
临床表现主要为对称性肢体远端或近端无力,大多自远端向近端发展。
其诊断必须具备:1、临床检查①一个以上肢体的周围性进行性或多发性运动、感觉功能障碍,进展期超过2个月;②四肢腱反射减弱或消失;2、电生理检查NCV显示近端神经节段性脱髓鞘;3、病理学检查:神经活检示脱髓鞘与髓鞘再生并存;4、脑脊液检查:蛋白细胞分离。
该患者脑脊液有蛋白增高,复查肌电图及腰椎穿刺进一步明确诊断。
1、急性炎症性脱髓鞘性多发性神经病:又称格林-巴利综合征,是迅速进展而大多数可恢复的运动性神对称性四肢经病,一般起病迅速,病情呈进行性加重,常在数天至周达到高峰,到4周停止发展。

糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病患者中最常见的神经病变之一,其临床表现多样,给患者的生活和健康带来了严重影响。
正确诊断糖尿病周围神经病变对于指导患者治疗和预防病情进展至关重要。
下文将介绍目前临床上常用的DPN 诊断金标准,希望能够对临床医生和研究者有所帮助。
1. 临床表现对于怀疑患有糖尿病周围神经病变的患者,医生需要了解其临床表现。
DPN的典型临床表现主要包括感觉障碍(如烧灼感、麻木感、刺痛感)、行走困难、疼痛、无痛性溃疡等。
还可能伴有肌力减退、膝反射减弱等体征。
在诊断糖尿病周围神经病变时,医生需要通过详细的病史询问和体格检查,全面了解患者的临床表现,有助于后续的神经电生理和实验室检查。
2. 神经电生理检查神经电生理检查是诊断糖尿病周围神经病变的重要手段之一。
通过神经传导速度和肌肉神经电图检查,可以客观评价患者神经功能的损害程度。
根据国际神经电生理学联合会(ICN)建议,DPN的诊断需要满足以下条件:a. 神经传导速度:在至少两条不同神经的、可以量化的神经传导速度降低;b. 肌肉神经电图:存在肌肉神经电图异常,例如神经源性肌电图改变、肌电图幅度减低等;c. 神经传导速度和肌肉神经电图的异常应该与临床表现相符。
3. 实验室检查除了神经电生理检查外,一些实验室检查也对DPN的诊断有一定的帮助。
检测患者的血糖、糖化血红蛋白、肌酐清除率、尿微量白蛋白等指标,可以帮助医生评估患者的糖尿病控制情况和肾脏功能。
4. 综合评估诊断糖尿病周围神经病变还需要进行综合评估。
医生需要结合患者的临床表现、神经电生理检查结果和实验室检查指标,进行综合分析,排除其他可能的神经病变(如自身免疫性神经病变、酒精性神经病变等),最终做出诊断。
诊断糖尿病周围神经病变需要综合临床表现、神经电生理检查和实验室检查。
希望本文介绍的DPN诊断金标准能够为临床医生提供参考,有助于早期发现和治疗糖尿病周围神经病变,改善患者的生活质量。

周围神经病临床症状、病变部位类型判断、神经纤维病理变化过程、起病方式与病程、病因判断等临床诊断思路判断临床症状是否符合周围神经病周围神经病的临床特征如下。
1、感觉障碍:刺激症状可有感觉异常、感觉过度、疼痛等,毁损症状有感觉减退或丧失,符合周围神经分布。
2、运动障碍:刺激性症状可有肌肉颤搐、肌束颤动、痉挛、肌肉痛性痉挛等,毁损性症状有肌力减退或丧失,轴突变性或神经断伤后,肌肉失去神经的营养作用而萎缩。
3、自主神经障碍:刺激症状可有多汗、高血压;毁损性症状有皮肤少汗或无汗、体位性低血压、心动过缓、腹泻或便秘,甚至肠梗阻、阳痿、膀胱功能障碍等。
4、反射减低或丧失:腱反射的减低或丧失。
判断病变临床解剖部位/类型1、神经干疾病明确病变部位是单神经病/多发性单神经病/多发性神经病;病变神经属性是运动神经、感觉神经或自主神经损害为主;病变神经纤维大小。
2、多数性单神经病的病因诊断血管炎:血管炎性神经病、糖尿病性单神经病和腰骶神经根神经丛神经病、类肉瘤;感染性:麻风病、HIV、莱姆病;免疫介导性:多灶性运动神经病、多灶性获得性脱髓鞘性运动感觉神经病;遗传性:遗传性压力易感性神经病、Tangier病3、以感觉神经受累为主的周围神经病糖尿病、维生素B12或维生素B1缺乏、恶性肿瘤、遗传性感觉和自主神经病、原发家族性淀粉样变性、尿毒症、莱姆病、干燥综合征、麻风病。
4、小纤维神经病病因代谢/营养障碍:糖尿病、空腹血糖异常、胰岛素神经炎、代谢综合征、慢性肾病、维生素B12缺乏、维生素B1缺乏、甲状腺机能减退、高脂血症等;感染:HIV、丙型肝炎、Chagas病等;淀粉样变性:系统性、家族性等;自身免疫性疾病:干燥综合征、纤维性肌痛、系统性红斑狼疮、血管炎、结节病等;药物和毒素:甲硝唑、汞、疫苗等;副肿瘤:多发性骨髓瘤和单克隆丙种球蛋白病、肺癌等;遗传性疾病:Fabry病、钠离子通道病等;炎性疾病:感觉性/小纤维GBS等;其他疾病:帕金森病、Pomp病等;特发性疾病。

周围神经损伤(痿病)中医诊疗方案周围神经损伤(痿病)中医诊疗方案一、诊断一)疾病诊断周围神经干及其分支受到外界直接或间接力量而发生的损伤,损伤后的典型表现为运动障碍、感觉障碍和自主神经功能障碍。
临床上表现为损伤导致肌肉瘫痪、皮肤萎缩、感觉减退或消失。
1943年Seddon提出将神经损伤分为三种类型:神经断裂、神经轴突断裂、神经失用。
具体临床表现1.指神经损伤:(1)多为切割伤;(2)手指一侧或双侧感觉缺失。
2.桡神经损伤:(1)腕下垂,腕关节不能背伸;(2)拇指不能外展,拇指间关节不能伸直或过伸;(3)掌指关节不能伸直;(4)手背桡侧皮肤感觉减退或缺失;(5)高位损伤时肘关节不能伸直;(6)前臂外侧及上臂后侧的伸肌群及肱桡肌萎缩。
3.正中神经损伤:(1)手握力减弱,拇指不能对指对掌;(2)拇、食指处于伸直位,不能屈曲,中指屈曲受限;(3)大鱼际肌及前臂屈肌萎缩,呈猿手畸形;(4)手掌桡侧半皮肤感觉缺失。
4.尺神经损伤:(1)拇指处于外展位,不能内收;(2)呈爪状畸形,环、小指最明显;(3)手尺侧半皮肤感觉缺失;(4)骨间肌,小鱼际肌萎缩;(5)手指内收、外展受限,夹纸试验阳性;(6)Forment试验阳性,拇内收肌麻痹。
5.腋神经损伤:(1)肩关节不能外展;(2)肩三角肌麻痹和萎缩;(3)肩外侧感觉缺失。
6.肌皮神经损伤:(1)不能用二头肌屈肘,前臂不能旋后;(2)二头肌腱反射丧失,屈肌萎缩;(3)前臂桡侧感觉缺失。
7.臂丛神经损伤:(1)多为上肢牵拉伤;(2)上干损伤为肩胛上神经、肌皮神经及腋神经支配之肌肉麻木;(3)中干损伤,除上述肌肉麻木外,尚有桡神经支配之肌肉麻木;(4)下干损伤前臂屈肌(除旋前圆肌及桡侧腕屈肌)及手内在肌麻木萎缩;累及颈交感神经可出现Hornor综合征;(5)全臂丛损伤,肩胛带以下肌肉全部麻木,上肢觉得全部丧失,上肢各类反射丧失呈弛张性下垂。
8.腓总神经损伤:(1)足下垂,走路呈跨越步态;(2)踝关节不克不及背伸及外翻,足趾不克不及背伸;(3)小腿外侧及足背皮肤觉得减退或缺失;(4)胫前及小腿外侧肌肉萎缩。

糖尿病周围神经病(diabetic peripheral neuropathy, DPN)是糖尿病患者最常见的神经系统并发症之一。
据统计,全球范围内大约有一半以上的糖尿病患者患有DPN。
DPN不仅影响了患者的生活质量,还可能导致严重的并发症,如足部溃疡、截肢等。
早期诊断和干预对于糖尿病患者的健康至关重要。
电生理诊断是DPN的重要手段之一,通过电生理检查可以客观、准确地评估患者的神经功能。
目前,国际上已经建立了一系列关于糖尿病周围神经病电生理诊断的标准和指南,帮助临床医生进行准确诊断和治疗。
本文将详细介绍糖尿病周围神经病电生理诊断的标准和方法,旨在帮助临床医生更好地应用电生理技术进行DPN的诊断和管理。
一、临床症状和体征1. 主观症状- 患者主诉腿部麻木、刺痛、烧灼感,尤以夜间或休息时为甚。
- 患者感觉丧失或明显减弱。
- 部分患者表现为有如蚊虫爬行或蚂蚁爬行感。
2. 体征- 有可能出现感觉减退、复合感觉丧失、震颤、平衡障碍、足部变形和关节畸形等。
- 对深感觉进行神经学检查,应在嗜睡或有足下垂现象时进行。
二、神经电生理检查1. 过去病史及脚趾部分感觉减退对始终地诊断DPN极为重要。
2. 神经传导速度测定(nerve conduction velocity, NCV)- NCV是评估神经传导速度和幅度的一种常用电生理学方法。
通过记录刺激神经的动作电位和感觉神经的感觉电位,可以评估神经的传导速度和幅度是否受损。
对于DPN患者,常见的表现是神经传导速度减慢和幅度减小。
3. 肌电图检查(electromyography, EMG)- EMG是评估神经-肌肉功能的一种重要方法。
通过记录肌肉的静息电位和运动电位,可以评估神经和肌肉的功能状态。
对于DPN患者,常见的表现是静息电位异常和幅度减小。
EMG还可以评估肌肉的肌纤维密度和肌萎缩情况,对于评估DPN患者的神经-肌肉功能状态具有重要意义。
4. 神经肌肉激发检查(nerve and muscle excitation test)- 这是通过刺激神经和肌肉来评估神经和肌肉的兴奋性和传导性的一种电生理检查方法。
《糖尿病周围神经病基层诊治管理专家指导意见》要点糖尿病周围神经病(diabetic peripheral neuropathy)是糖尿病患者最常见的并发症之一,是由于高血糖对周围神经产生毒性作用导致的神经损伤。
该病病程长、治疗难,给患者带来严重的痛苦和生活质量的下降。
为此,国家卫生健康委员会糖尿病学组专家于2024年制定了《糖尿病周围神经病基层诊治管理专家指导意见》,以下是该指导意见的要点:一、糖尿病周围神经病的诊断与分级:1.临床症状和体征:主要表现为感觉异常、痛、肌力下降等。
2.神经生理学检查:包括神经传导速度检查、电生理检查等,用于明确神经损伤的程度和范围。
3.分级:根据症状和神经传导速度进行分级,分为Ⅰ~Ⅳ级,有助于制定治疗策略和评估疗效。
二、糖尿病周围神经病的治疗目标:1.缓解疼痛:可以采用口服镇痛药和外用药物进行治疗,如非甾体抗炎药、舒筋活血药等。
2.控制血糖:严密控制血糖水平,降低糖尿病周围神经病的发生和进展风险。
3.神经保护:采用药物治疗以降低糖尿病周围神经病的进展速度,如α-硫辛酸、维生素B族等。
4.康复训练:进行物理治疗、康复训练等,改善神经功能和生活质量。
三、糖尿病周围神经病的并发症管理:1.溃疡和感染:加强足部护理,定期检查足部情况,及时处理溃疡和感染,防止病情进展。
2.肌肉萎缩和骨骼畸形:及时进行康复训练,提高神经肌肉功能。
3.骨关节疼痛和运动障碍:针对疼痛和运动障碍进行药物治疗和物理治疗。
四、糖尿病周围神经病的随访管理:1.定期随访:根据病情,随访周期一般为3个月一次,及时评估治疗效果和调整治疗方案。
2.评估病情:包括疼痛程度、感觉异常、肌力下降等指标的评估,以及神经传导速度等的检查。
3.个体化治疗:根据患者的病情和治疗效果,调整治疗方案,实施个体化治疗。
五、糖尿病周围神经病的危险因素干预:1.控制血糖:通过控制饮食、锻炼和药物治疗,降低血糖水平,减少神经损害。
2.控制血脂和血压:积极干预高血脂和高血压,减少心血管并发症的发生。
2024周围神经病的诊断策略(全文)周围神经病患者可能会就诊于医院的不同临床科室,其诊断需要依据患者的临床表现建立一套合理的检查流程。
首先应依据患者的发病年龄、疾病发展速度、周围神经损害症状在全身的分布,区分为不同的临床亚型。
在此基础上,应用神经传导检测和肌电图来确定周围神经病的定位诊断。
定性诊断是在定位诊断的基础上选择合理的辅助检查,包括血液学检查、周围神经影像学以及活组织病理检查。
对于临床怀疑遗传病的患者,应选择基因检测。
最后,在定性诊断的基础上进行治疗评估,指导治疗方案的制订。
周围神经病是一组常见的神经系统疾病,在人群中总患病率约为1%~3%,在65岁以上的人群中更为多见。
周围神经病的种类繁多,临床上主要根据感觉、运动或自主神经纤维的损害的症状组合进行分类[1]。
周围神经的大直径感觉纤维负责调节振动觉和本体觉,损伤后导致本体感觉丧失,因感觉性共济失调出现步态障碍。
小直径感觉神经纤维主要负责疼痛和温度觉传导,损伤后常导致疼痛或感觉减退,也可以表现为深部疼痛、活动后易疲劳和神经性瘙痒。
运动纤维都是大直径有髓纤维,损害后出现和肌肉萎缩,表现为肢体活动不灵活和步态障碍。
自主神经以小神经纤维为主,其损害症状包括直立不耐受、胃瘫、便秘、腹泻、神经性膀胱、性功能障碍、瞳孔运动(视力模糊)症状和皮肤血管运动症状(眼睛、嘴或皮肤干燥,或皮肤灼热和潮红)[2]。
出现上述表现提示患者有周围神经病的可能性,需要采取合理的临床方案解决下列3个问题:(1)患有周围神经易损疾病(如糖尿病、危重症、结缔组织病)的患者是否患有周围神经病;(2)出现周围神经病症状的患者是否可以通过会诊确定临床诊断,比如糖尿病或结缔组织病患者出现了周围神经病症状,需要内分泌科或风湿免疫科医师请神经内科医师会诊或反向安排;(3)是否需要进行相关辅助检查(神经传导、神经影像学、基因、病理和免疫检查等)才可以明确诊断并进行对症治疗,整个过程是先定位诊断,而后基于定位诊断进行定性诊断。
周围神经病的临床诊断Clinical A pproach t o The P atient w ith P eripheral N europathy张在强(首都医科大学附属北京天坛医院神经科100050)ZHANG Zai-qiang1 病理学类型周围神经病有三种主要病理过程:轴索变性、节段性脱髓鞘和神经元病,病理性质不同临床结局不同。
轴索变性常见于代谢、中毒、营养不良疾病和系统性疾病,特征是易累及大直径和长束神经纤维,引起远端轴索病或逆死性神经病。
节段性脱髓鞘指髓鞘破坏,而轴索相对完整。
尽管轴索变性也见于脱髓鞘性神经病,而继发性节段性脱髓鞘可见于轴索变性,电生理检查有助于鉴别原发性脱髓鞘和轴索变性。
神经元病为前角细胞或背根神经节受累。
2 临床评价最重要的部分是精确的病史和详尽的检查,感觉症状包括麻木、麻刺感、手足发麻、烧灼感、肢体疼痛、踏棉感、腕和踝束带感、不稳定感。
运动症状通常为肌无力,病人感觉转动钥匙费力、系扣困难、不能开启瓶盖。
在周围神经病早期,常表现为肢体远端无力,然而炎性神经病和卟啉病神经病早期就表现为肢体近端无力。
自主神经症状,特别是体位性低血压、阳萎、膀胱扩约肌障碍、腹泻、便秘、肢端干燥或出汗过多,提示为有髓小纤维和无髓纤维损害。
病史中要特别注意近期上呼吸道或其他感染、酒精和药物使用、饮食、可能的工业和环境毒素接触、家族史、系统性疾病的症状。
询问病程演变非常重要:注意是急性、亚急性或隐袭发病;快速或缓慢进展;进展型、逐渐升级或复发缓解型病程,对病因诊断有重要指示作用。
体征常常为肢体远端肌无力和萎缩,和感觉损害体征(特别是以远端为主,呈手、袜套样分布)。
远端轴索病(特别是糖尿病)由于肋间神经远端变性,可出现躯干腹侧部分感觉丧失。
糖尿病、莱姆氏病和干燥综合征可出现躯干神经病、感觉异常和感觉丧失可呈皮节分布。
一些主要累及小纤维的疾病,如淀粉样神经病、Tangier病,一些糖尿病性神经病,可出现分离性感觉障碍:痛、温觉丧失,触觉保留。
腱反射常常减低或消失,但在轻症病例、小纤维神经病、周围神经病与锥体束病变同时存在病例,反射可保留正常。
其他重要体征还包括:弓形足或其他骨骼畸形、神经肥大、皮肤损坏、关节炎、粘膜干燥、肝、脾和淋巴结肿大。
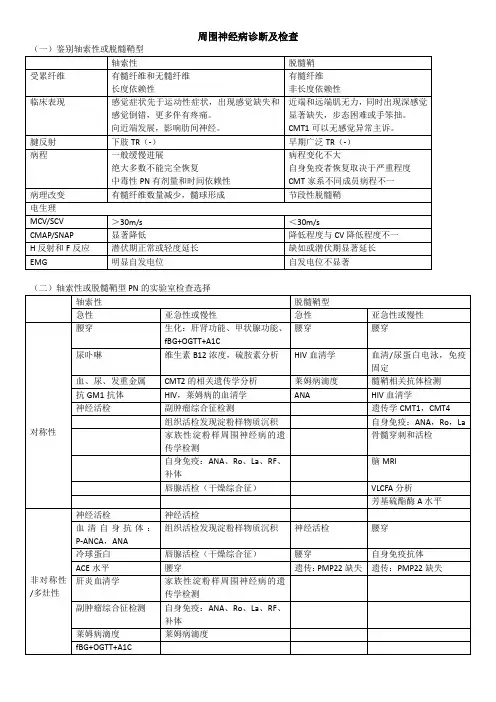
周围神经病的临床特征可提示其潜在的病因,有助于进一步开展合适的检查,见表1。
单神经病通常由于直接压迫或嵌压,但也可为糖尿病或血管炎神经病的首发症状,多数单神经病一般由血管炎、麻风病、结节病和另一些疾病引起,详细情况见表2。
3 实验室检查一般实验室检查和神经传导检查常常被作为第一阶段诊疗手段,根据其结果再次决定其他检查措施。
3.1 一般实验室检查(见表3)对所有疑有周围神经病而病因又不明确者,均应做基本的实验室检查,包括:尿液分析、血红蛋白、WBC、血小板计数、ESR、快速血糖、血清电解质、血清蛋白、血清蛋白电泳和免疫电泳、血肌酐、肝功能、胸部X线和电生理检查,如果仍未能提供诊断信息,进一步检查应包括:甲状腺功能、血清Vit E浓度、血胆固醇和甘油三脂、冷球蛋白、尿重金属和卟啉、抗核抗体、类风湿因子、干燥综合征抗体(SSA和SSB),莱姆病血清学、HIV、抗GM1抗体、Schirmer试验、内窥镜和X线放射学检查寻找隐性肿瘤(包括骨骼扫描)。
3.2 神经传导检查神经传导功能检查可用来确定是否存在周围神张在强(1965-),男,湖北人,副主任医师,医学博士。
专业特点:周围神经与肌肉疾病,神经病理学,系统疾病的神经系统损害。
经病,以及协助判断病因。
首先可帮助确定是单神经病、多发性单神经病或多发性神经病,还可判断对称性或是不对称性,感觉和运动纤维是否均受累,其病理改变是轴索变性还是节段性脱髓鞘。
轴索性神经病和脱髓鞘性神经病的诊断标准见表4。
临床上受累的和未受累的神经都应行神经传导功能的检测。
通常,上下肢有数条神经必须检测,如正中神经和尺神经的运动和感觉神经传导速度,腓总神经和胫神经的运动传导速度,以及腓肠神经的感觉传导速度。
有些病例还应行桡神经、胫神经和隐神经的感觉神经传导速度的检测,以及记录相应神经的动作电位,如尺神经和腓总神经。
每一神经电生理实验室应建立自己的正常参考值,应考虑患者年龄因素的影响(婴儿的神经传导速度大约为成年人的一半,3~5岁后增至成年人的范围,40岁后神经传导速度开始减慢),同时也必须控制肢体的温度或纠正温度引起的偏差(温度从29℃变化至38℃,神经传导速度改变为每升高1℃,传导速度可升2.4 m/s)。
通过刺激肢体远端和近端的不同部位,测量复合肌肉动作电位的波幅,记录运动神经传导速度。
远端刺激点的复合肌肉动作电位波幅降低提示轴索变性,偶也见于远端运动神经纤维脱髓鞘。
从肢体远端向近端部位移动刺激电极,如果复合肌肉动作电位的波幅显著降低说明存在传导阻滞;如果波幅降低超过20%,应该疑诊传导阻滞。
在较短的神经节段,波幅和时限急剧改变(而不是在较长的距离逐渐下降)高度提示神经传导阻滞。
其他脱髓鞘的证据还有:短暂性离散(复合肌肉动作电位时限增宽),远端潜伏期延长,2条或更多运动神经的神经传导速度减慢,低于正常下限的50%。
轴索变性时神经传导速度可正常或轻度减慢,复合肌肉动作电位波幅下降,针极肌电图显示失神经电位。
应该注意神经传导轻度减慢并不能排除存在节段性脱髓鞘的可能性。
轴索变性和节段性脱髓鞘时,感觉传导通常受损,同时伴有动作电位波幅的下降。
另外,传统的神经传导速度的测定仅能检测粗大的有髓神经纤维,而小纤维或无髓纤维病变时可能表现为正常。
3.3 F波F波是超强刺激沿运动纤维逆向传入脊髓,并兴奋前角细胞,使之产生冲动再沿运动纤维传出,引起肌肉收缩。
F波反映运动神经全长的传导情况,为记录近端神经传导的非常有用的方法。
可用于周围神经病或颈椎病的诊断。
3.4 H反射H反射是单突触反射,弱电流沿后根感觉纤维传入脊髓,经单突触联络后兴奋前角细胞产生冲动,再沿运动纤维传出引起肌肉收缩。
在腓肠肌最容易记录到。
用于检查周围神经病、神经根和脊髓病变。
3.5 肌电图肌肉失神经支配后,可产生自发电位:纤颤电位,正锐波和募集型为单纯相。
3.6 体感诱发电位当常规神经传导检测正常时,应用SEP可发现近端神经传导异常的情况。
4 脑脊液检查大多数轴索性神经病腰穿CSF检查可能正常,但脱髓鞘神经病一般异常。
GBS的CSF蛋白在第一周即升高,白细胞计数依腰穿时间而有不同,约10%病例可升高,如白细胞计数升高,应考虑有HIV感染或莱姆氏病的可能性。
慢性吉兰巴雷综合征(CIDP)的CSF蛋白升高,有助于与遗传性疾病和脱髓鞘神经病相鉴别。
脑脊液蛋白升高一般提示炎性病因和脊神经根脱髓鞘。
5 定量感觉测试(QST )QST是应用心理-生理学方法来测量不同方式的感觉异常。
使用QST可获得每位患者振动觉、触压觉和温冷觉的阈值(定量值),并与正常对照值相比较。
QST并不作为常规检测,但对于接触职业和环境毒物的人群、流行病学调查以及药物临床试验的观察等,可应用此项检查来检测感觉的早期异常。
6 自主神经功能检查自主神经功能障碍是周围神经病的常见合并症,有些病例可出现明显的自主神经功能异常,包括体位性低血压、血压心率下降、膀胱功能障碍、阳萎等主要影响小神经纤维的疾病;小的有髓神经纤维急性脱髓鞘疾病也可引起自主神经功能紊乱,这些疾病包括有:急性全自主神经功能障碍、家族性和原发性淀粉样变性、GBS、糖尿病、卟啉病、Chagas病和一些遗传性感觉自主神经病。
有许多试验可供选择,但每次试验应包括交感和副交感神经功能检查;在这些试验中应有二个或更多的试验异常才能确定自主神经功能障碍的存在。
临床神经生理实验室常用的试验有:深呼吸时心率变异率、Valsalva比率、卧立位心率反应、持续握拳的血压反应、交感皮肤反应。
自主神经功能检查、QST和腓肠神经活检等。
联合应用是确定小纤维神经病最有效的手段。
7 分子遗传学临床上分子遗传学分析可分为二种情况:(1)连锁分析,应用于基因的染色体定位明确,但缺陷的基因尚未克隆;(2)突变分析或定位克隆,应用于基因已被克隆,序列明确者。
用分子遗传学试验诊断遗传性周围神经病的具体情况见表6。
8 腓肠神经活检神经活检仅适合于具备光学和电子显微镜,能够撕单神经纤维,能够进行常规组织化学和免疫组化染色的实验室。
在经过全面的临床和电生理学评价,其他各种实验室检查完善后方可作神经活检。
临床上常选用腓肠神经、腓浅神经,有时亦可选桡神经。
可取全神经或部分神经束。
神经活检可确定诊断的疾病有:CIDF、HM SN、遗传性感觉和自主神经病、原发性和家族性淀粉样周围神经病、血管炎、结节病、巨轴索神经病、遗传性压力易感性麻痹、六碳(Hexacarbon)神经病。
在IgMκ副蛋白血症神经病、异染性白质营养不良、Krabbe病、Fabry病和Friedreich共济失调等,神经活检可见到特异的病理改变。
神经活检是血管炎、结节病、淀粉样变性、感觉性神经束周炎和慢性炎性神经病诊断的必须措施。
但是神经活检对代谢疾病、酒精中毒和营养障碍所致的神经病无任何诊断价值,其病理改变不具备特异性。
对各种检查完成后仍不能确定病因的慢性周围神经病病例,应行神经活检。
周围神经的形态特征与年龄有关联,因此每个实验室应建立自己的不同年龄组的对照值。
9 皮肤活检皮肤活检评价皮肤间神经纤维是最近发展形成的新技术,标准的电生理检查通常不能显示小纤维为主的神经病损害,皮肤活检为以小纤维损害为突出表现的周围神经病提供了有用的诊断手段。
皮肤活检的优点包括:操作简便,微小侵入性,易被病人接受,可多点采集标本,并且可多次采集。
因此可作为评估小纤维神经病时空变化过程的一种手段。
支配汗腺和血管的表皮神经纤维和自主神经纤维均可得以检查。
10 抗糖脂抗体、抗脑抗体检查抗糖脂抗体(抗GM1,GD1a,GD1b,GQ1b抗体和抗硫脂抗体等)与周围神经病发病有明确的关系(例如抗髓鞘相关性糖蛋白综合征);抗脑抗体(抗Hu、Yo、Ri抗体等)见于一些副肿瘤综合症病例。
然而,检查这些抗体的费用十分昂贵,过程也较复杂。
目前许多实验室将这些抗体检查“捆绑” 成为“感觉性神经病试验组合”或者“慢性炎性脱髓鞘多发神经根神经病(CIDP)试验组合” 。
但在开列这些试验之前,临床医生应该明确预期达到的目的,有选择性地做这些检查。
例如有几种试验特别有价值:(1)抗Hu、Yo、Ri抗体测定对疑诊的癌性感觉性神经元病;(2)是在有IgM κ或λ副蛋白的病人,证实抗MAG抗体的存在非常有价值,抗MAG抗体综合征对治疗的反应特别差,需要特别的治疗策略;(3)为抗GM1抗体水平,对多灶性运动神经病有辅助诊断价值,当临床资料和电生理检查尚不能明确是否为多灶性运动神经病时,如果出现极高水平的IgM抗GM1抗体,足以证明需要重复作电生理检查和使用静脉免疫球蛋白作诊断性治疗。