热学(秦允豪编)习题解答第四章-热力学第一定律
- 格式:doc
- 大小:451.00 KB
- 文档页数:15

普通物理学教程《热学》(秦允豪编)习题解答第四章 热力学第一定律4.2.1 解:⎰-=21V V PdVW C T =(1)()RT b v P =-b v RTP -=⎪⎪⎭⎫ ⎝⎛---=--=⎰b v b v dv bv RTW i f v v fi ln(2)⎪⎭⎫ ⎝⎛-=v B RT Pv 1 ⎪⎭⎫ ⎝⎛-=v B RT P 1 ⎪⎪⎭⎫ ⎝⎛-+-=⎪⎭⎫ ⎝⎛--=⎰i f i f v v v v BRT v v RT dv v B RT W f i11ln 14.2.2 应用(4.3)式⎰-=21V V PdVW 且k PiV PV i ==γγ γγ-=V V P P i i故有:fifv v i i V Vii i V V P dV V V P W γγγγγ----=-=⎰111()()i i f f i f i i V P V P V V V P --=--=--111111γγγγγ (应用了γγf f i i V P V P =)4.4.2 (1)2v ab v RT P --=⎰⎰⎰+--=-=dvv adv b v RT Pdv W 2aV V b V b V RT ⎪⎪⎭⎫⎝⎛--⎪⎪⎭⎫ ⎝⎛---=121211ln (2)d v a cT u +-=2当C V =时,V V V dt du dT dQ C ⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛= ∴C C V =TC CdT Q T T ∆==⎰214.4.3 水蒸气的凝结热即为定压状况下单位质量物质相变时吸收(或释放)的热量,在等压下此值即为比焓变化,即:()kJh mHl V 4.244459.1000.2545-=--=∆-=∆= (系统放热)4.4.4 铜升温过程,是等压过程()212121221T T T T T T P P bT aT dT bT a dT C Q H ⎪⎭⎫⎝⎛+=+===∆⎰⎰()()2122122T T b T T a -+-=()()122447107.2300120092.5213001200103.2-⋅=-⨯⨯+-⨯⨯=mol J4.4.515.46190846823866921291542321223-⋅-=⎪⎭⎫⎝⎛⨯+⨯--=+-=mol J h h h Q H N NH P4.4.6 在定压情况下,21molH 和221molO 化合生成mol 1水时吸收的热量为 1510858.2-⋅⨯-=∆=mol J H Q (系统放热Q Q -=')每产生一个水分子有两个电子自阴极到阳极,生成mol 1水有A N 2电子到阳极。
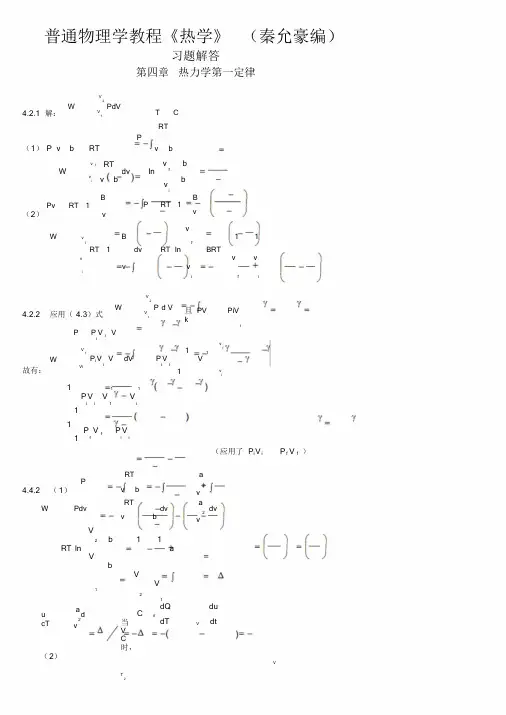
普通物理学教程《热学》 (秦允豪编)习题解答第四章 热力学第一定律V24.2.1 解:WV1PdVT CRT P(1) P v bRT vbWvvi fRT v bdv lnv fvibbB Pv RT 1 (2)vPRT 1B vWvvB11 ffRT 1dv RT lnBRTvvvvviifiV24.2.2 应用( 4.3)式WV1P d V且PVPiVkiPP V i i V故有:VfWVi1 P i V VdV P VViii11vfvi11 1P V VViifi11 1 P fVfP Vii(应用了 P i V iP f V f )4.4.2 (1)PRT vba 2vWPdvRT vbdv a 2 vdv V2b 1 1RT lnaVbVV121u cTa 2 vd当VC时,C VdQdT Vdu dt(2)VT2∴C CV QT1C d T C T4.4.3 水蒸气的凝结热即为定压状况下单位质量物质相变时吸收(或释放)的热量,在等压下此值即为比焓变化,即:l HV h 2545 .0 100 .59 2444 .4 m kJ(系统放热)4.4.4 铜升温过程,是等压过程T2H QT T12 2P C dT a bT dT aT bTPT T21 12T1a T2 T1b2T 222T114 2 22.310 1200 300 5. 92 1200 300212. 47107 J mol4.4.5Q hP NH1 3 1 33 h h 29154 8669 8468 46190 .5 J mol2 2N H2 2 2 214.4.6 在定压情况下,1molH 2 和12molO2化合生成1mol 水时吸收的热量为5 1Q (系统放热Q ' Q )H 2 .858 10 J mol每产生一个水分子有两个电子自阴极到阳极,生成 1 m ol 水有2 N A 电子到阳极。
总电量为q 19 232 (q 2N e )1 .60 10 6 .02 10 CA两极间电压为, A q19 23A 1 .229 2 1 .60 10 6 .02 1082.84%5Q' 2. 858 104.4.7 设 1 m ol 固体状态方程为:v v aT bP0 ,内能表示为:u CT aPT ,a 均为常数。

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。


第四章热力学第一定律(题号有所不同)5-1.0.020Kg的氦气温度由升为,若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改变,吸收的热量,外界对气体所作的功,设氦气可看作理想气体,且,解:理想气体内能是温度的单值函数,一过程中气体温度的改变相同,所以内能的改变也相同,为:热量和功因过程而异,分别求之如下:(1)等容过程:V=常量A=0由热力学第一定律,(2)等压过程:由热力学第一定律,负号表示气体对外作功,(3)绝热过程Q=0由热力学第一定律5-2.分别通过下列过程把标准状态下的0.014Kg氮气压缩为原体积的一半;(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的改变,传递的热量和外界对气体所作的功,设氮气可看作理想气体,且,解:把上述三过程分别表示在P-V图上,(1)等温过程理想气体内能是温度的单值函数,过程中温度不变,故由热一、负号表示系统向外界放热(2)绝热过程由或得由热力学第一定律另外,也可以由及先求得A(3)等压过程,有或而所以===由热力学第一定律,也可以由求之另外,由计算结果可见,等压压缩过程,外界作功,系统放热,内能减少,数量关系为,系统放的热等于其内能的减少和外界作的功。
5-3 在标准状态下的0.016Kg的氧气,分别经过下列过程从外界吸收了80cal的热量。
(1)若为等温过程,求终态体积。
(2)若为等容过程,求终态压强。
(3)若为等压过程,求气体内能的变化。
设氧气可看作理想气体,且解:(1)等温过程则故(2)等容过程(3)等压过程5-4 为确定多方过程方程中的指数n,通常取为纵坐标,为横坐标作图。
试讨论在这种图中多方过程曲线的形状,并说明如何确定n。
解:将两边取对数或比较知在本题图中多方过程曲线的形状为一直线,如图所示。
直线的斜率为可由直线的斜率求n。
或即n可由两截距之比求出。
5-5 室温下一定量理想气体氧的体积为,压强为。
![热学第四章习题参考答案[1]](https://uimg.taocdn.com/caccaff4b0717fd5360cdc8d.webp)


热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。

第四章 热力学第一定律 基本要求一、 可逆和不可逆过程 (1)准静态过程(2)理解什么是可逆过程,什么是不可逆过程.知道只有无耗散的准静态过程才是可逆过程。
二、 功和热量 (1)明确功是在力学相互作用过程中能量转移,热量是在热学相互作用过程中的能量的转移,它们都是过程量,它们都是过程量。
知道“作功”是通过物体宏观位移来完成;而“热传递”是通过分子之间的相互作用来完成。
(2)知道功有正负,熟练掌握从体积膨胀功微分表达式pdV W d -=出发计算体积膨胀功。
从几何上理解功的大小等于p-V 图上热力学过程曲线下面的面积。
三、热力学第一定律(1)知道能量守恒与转化定律应用到热学中就是热力学第一定律。
明确热力学第一定律是把内能、功和热量这三个具有能量量纲的物理量结合在一个方程中:即 W Q U +=∆; (2)一微小过程中热力学第一定律表示为:W d Q d dU +=;对于准静态过程热力学第一定律表示为:pdV Q d dU -=(3)内能是态函数,内能一般应是温度和体积的函数。
内能应当包含分子的热运动动能和分子之间的相互作用势能,也应包括分子内部的能量;在热学中的内能一般不包括系统做整体运动的机械能。
四、热容和焓(1)知道热容的定义、热容是过程量、热容与物体的量有关。
(2)知道焓的定义pV U H +=;知道焓的物理意义。
五、热力学第一定律对理想气体的应用(1)知道焦耳定律;即理想气体的内能仅是温度的函数;知道理想气体的焓也只是温度的函数。
内能和焓的微分可分别表示为:dT C dU m V ,ν=;dT C dH m p ,ν=;这两个公式适用于理想气体任何过程。
(2)理想气体的准静态过程的热力学第一定律可表示为pdV dT C dQ m V +=,ν;利用上式可得迈耶公式:R C C m V m p =-,,ν;(3)会熟练利用热力学第一定律处理一些常见热力学过程。
(4)会推导准静态绝热过程方程,熟记并会熟练利用绝热过程方程,同时应知道绝热过程方程的适用条件。


热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。
热力学第一定律习题一、单选题1) 如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有:( )A. W =0,Q <0,U <0B. W <0,Q <0,U >0C. W <0,Q <0,U >0D. W <0,Q =0,U >02) 如图,用隔板将刚性绝热壁容器分成两半,两边充入压力不等的空气(视为理想气体),已知p右> p左,将隔板抽去后: ( )A. Q=0, W =0, U =0B. Q=0, W <0, U >0C. Q >0, W <0, U >0D. U =0, Q=W03)对于理想气体,下列关系中哪个是不正确的:( )A. (∂U/∂T)V=0B. (∂U/∂V)T=0C. (∂H/∂p)T=0D. (∂U/∂p)T=04)凡是在孤立孤体系中进行的变化,其U 和H 的值一定是:( )A. U >0, H >0B. U =0, H=0C. U <0, H <0D. U =0,H 大于、小于或等于零不能确定。
5)在实际气体的节流膨胀过程中,哪一组描述是正确的: ( )A. Q >0, H=0, p < 0B. Q=0, H <0, p >0C. Q=0, H =0, p <0D. Q <0, H =0, p <06)如图,叙述不正确的是:( )A.曲线上任一点均表示对应浓度时积分溶解热大小B.H1表示无限稀释积分溶解热C.H2表示两浓度n1和n2之间的积分稀释热D.曲线上任一点的斜率均表示对应浓度时HCl的微分溶解热7)H=Q p此式适用于哪一个过程: ( )A.理想气体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5sPaB.在0℃、101325Pa下,冰融化成水C.电解CuSO4的水溶液D.气体从(298K,101325Pa)可逆变化到(373K,10132.5Pa )8) 一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1、V2。
热力学第一定律答案一、选择题1. [ A ]解:真空绝热膨胀过程中0,0==Q A ,由热力学第一定律知0=∆E ,所以0=∆T ,温度不变,对始末二状态,,2211V p V p = V 增大,p 减小。
2. [ C ]解:体积不变时吸热)(221122V p V p i T R iM E Q -=∆⋅=∆=μ,Q 相等,但三种气体的自由度i 不同,故温升T ∆不相同;又p V i Q V V V ∆===2,21, 所以压强的增量也不相同。
3. [ A ]解:由热力学第一定律A E Q +∆=,绝热过程A →D 不吸热,Q = 0等温过程A →C 内能不变,12,0V ACV A Q E AC AC ===∆的面积等压过程A →B ,12,0V ABV E A E Q E AB AB +∆=+∆=>∆面积 所以,AD AC AB Q Q Q >> 吸热最多的过程是A →B 。
4. [ B ] 解:开始时,由RT MpV μ=知,两边V 、T 相等,μ小的p 大,所以22O H p p >。
释放绝热板后H 2膨胀而O 2被压缩,达到新的平衡后,两边压强相等,绝热膨胀后温度降低,绝热压缩温度升高,所以平衡后O 2比H 2温度高。
5. [ B ]解:绝热自由膨胀,0,0==Q A 所以0,0=∆=∆T E 。
以气体为研究对象,,1100V p V p = 因212V V =,所以0121p p =。
6.[ B ]解:功和热量与过程有关,不知是什么过程,无法求;由RT MpV μ=,μ不知道无法求质量M ;内能的变化(),221122V p V p i T R iM E -=∆=∆μ因i = 3,2121V V p p 、、、已知,故可求。
二、填空题1. 体积、温度和压强; 分子的运动速度、动量和动能 。
122. (1) 外界传给系统的热量 等于 零; (2) 外界对系统作的功 大于 零; (3) 系统的内能的增量 大于 零。
热学思考题和参考解答第一章 热学基础知识和温度1.1 若热力学系统处于非平衡态,温度概念能否适用?【答】 对于处于非平衡态的系统,只要局域平衡条件能满足,则对于处于局域平衡的每个子系统来说,温度概念仍能适用。
1.2 系统A 和B 原来各自处在平衡态,现使它们互相接触,试问在下列情况下,两系统接触部分是绝热的还是透热的,或两者都可能?(1)当A V 保持不变,A p 增大时,B V 和B p 都不发生变化;(2)当A V 保持不变,A p 增大时,B p 不变而B V 增大;(3)当A V 减少,A p 增大时,B V 和B p 均不变.【答】设容器都是密闭的.(1)是绝热的.因为A p A V 增大,所以A 的温度 增加.但它并不使B 状态发生变化,说明既没有热量传递也没有做功.(2)是透热的.因为A p A V 增大,所以A 的温度增加.从B 来说,B V 增加了,说明B 膨胀对外做了功,其能量只能来源于从A 吸热.(3)因为B V 和B p 均不变,说明B 的温度不变.但是A V 减少,同时A p 增大,这两者的乘积可变可不变,所以A 的温度也可变可不变.若A 的温度改变则是绝热的;若A 的温度不变,则A ,B 相互 接触的部分仍然绝热,因为B 的状态始终不变.1.3 在建立温标时是否必须规定热的物体具有较高的温度,冷的物体具有较低的温度?是否可作相反的规定?在建立温标时,是否须规定测温属性一定随温度作线性变化?【答】 在建立温标时必须规定热的物体具有较高的温度,冷的物体具有较低的温度,因为热量是从高温物体传递到低温物体的.很有意思的是,对于处于负温度的子系则是例外.因为负温度比正温度还要高,热量是从负温度物体流向正温度物体的.建立温标时并不一定规定测温属性随温度作线性变化,这完全由分度公式来规定.1.4 冰的正常溶点是多少?纯水的三相点温度是多少?【答】 冰的正常溶点是273.15K,纯水的三相点温度是273.16K 。
习题分析和解答[说明:本栏内容对学生是有条件地开放]第一章△1. 3. 6一抽气机转速1m in 400-⋅=r ω,抽气机每分钟能抽出气体20 l (升)。
设容器的容积 V 0 = 2.0 1,问经过多长时间后才能使容器内的压强由0.101 Mpa 降为 133 Pa 。
设抽气过程中温度始终不变。
〖分析〗: 抽气机每打开一次活门, 容器内气体的容积在等温条件下扩大了 V , 因而压强有所降低。
活门关上以后容器内气体的容积仍然为 V 0 。
下一次又如此变化,从而建立递推关系。
〖解〗: 抽气机抽气体时,由玻意耳定律得:活塞运动第一次:)(0100V V p V p +=0001p V V V p +=活塞运动第二次: )(0201V V p V p +=02001002p V V V p V V V p ⎪⎪⎭⎫ ⎝⎛+=+= 活塞运动第n 次: )(001V V p V p n n +=- n n V V V p p ⎪⎪⎭⎫ ⎝⎛+= 000 V V V n p p n n +=00ln(1) 抽气机每次抽出气体体积 l 05.0l )400/20(==V l 0.20=V Pa 1001.150⨯=p Pa 133=n p将上述数据代入(1)式,可解得 276=n 。
则 s 40s 60)400/276(=⨯=t1. 3. 8 两个贮着空气的容器 A 和 B ,以备有活塞之细管相连接。
容器A浸入温度为 C 10001=t 的水槽中,容器B 浸入温度为C 2002-=t 的冷却剂中。
开始时,两容器被细管中之活塞分隔开,这时容器 A 及 B 中空气的压强分别为 MPa 3053.01=p ,MPa 0020.02=p 。
它们的体积分别为 ,l 25.01=V l,40.02=V 试问把活塞打开后气体的压强是多少?〖分析〗: 把活塞打开后两容器中气体混合而达到新的力学平衡以后,A 和 B 中气体压强应该相等。
普通物理学教程《热学》(秦允豪编)
习题解答
第四章 热力学第一定律
4.2.1 解: ⎰-=21V V PdV W C T =
(1)()RT b v P =-
b v RT P -= ⎪⎪⎭⎫ ⎝⎛---=--=⎰b v b v dv b v RT W i f v v f i ln
(2)
⎪⎭⎫ ⎝⎛-=v B RT Pv 1 ⎪⎭⎫ ⎝⎛-=v B RT P 1 ⎪⎪⎭⎫ ⎝⎛-+-=⎪⎭⎫ ⎝⎛--=⎰
i f i f v v v v BRT v v RT dv v B RT W f i 11ln 1
4.2.2 应用(4.3)式 ⎰-=21V V PdV W 且
k PiV PV i ==γγ γγ-=V V P P i i 故有:f
i f v v i i V Vi i i V V P dV V V P W γ
γ
γγγ----=-=⎰
111
()
()i i f f i f i i V P V P V V V P --=--=--111
111γγγγγ (应用了γγf f i i V P V P =)
4.4.2 (1)
2v a b v RT P --= ⎰⎰⎰+--=-=dv v a dv b v RT Pdv W 2 a
V V b V b V RT ⎪⎪⎭⎫ ⎝⎛--⎪⎪⎭⎫ ⎝⎛---=121211ln (2)d v a cT u +-=2当C V =时,
V V V dt du dT dQ C ⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛= ∴C C V = T C CdT Q T T ∆==⎰21
4.4.3 水蒸气的凝结热即为定压状况下单位质量物质相变时吸收(或释放)的热量,在等压下此值即为比焓变化,即:
()kJ h m H l V 4.244459.1000.2545-=--=∆-=∆= (系统放热)
4.4.4 铜升温过程,是等压过程
()212121221T T T T T T P P bT aT dT bT a dT C Q H ⎪⎭⎫ ⎝⎛+=+===∆⎰⎰ ()()
2122122T T b T T a -+-= ()()1
22447107.2300120092.5213001200103.2-⋅=-⨯⨯+
-⨯⨯=mol J
4.4.5 1
5.46190846823866921291542321223-⋅-=⎪⎭⎫ ⎝⎛⨯+⨯--=+-
=mol J h h h Q H N NH P
4.4.6 在定压情况下,21molH 和221molO 化合生成mol 1水时吸收的热量为
1510858.2-⋅⨯-=∆=mol J H Q (系统放热Q Q -=') 每产生一个水分子有两个电子自阴极到阳极,生成mol 1水有A N 2电子到阳极。
总电量为C q 23191002.61060.12⨯⨯⨯⨯=- (e N q A 2=) 两极间电压为ε,q A ε=
%84.8210858.21002.61060.12229.1'52319≈⨯⨯⨯⨯⨯⨯==-Q A η
4.4.7 设mol 1固体状态方程为:bP aT v v ++=0,内能表示为:aPT CT u -=,0,,,v C b a 均为常数。
求:(1)()h mol (2)V P C molC ,
解:(1)由摩尔焓定义()()bP aT v P aPT CT Pv u h +++-=+=0
20bP Pv CT h ++=
(2) a )
P P T H C ⎪⎭⎫ ⎝⎛∂∂=' P P T h C ⎪⎭⎫ ⎝⎛∂∂=γ' P P T h C ⎪⎭⎫ ⎝⎛∂∂= ∴ ()C P bP Pv CT T C P =++∂∂=20
b )
V V T u C ⎪⎭⎫ ⎝⎛∂∂= ()aT v v b P --=01 ()T aT v v b a CT u ---=0
()()[]T b a v b a v b a C aT v v T a b a C T u C V V 2002++-=--+--=⎪⎭⎫ ⎝⎛∂∂= (或) ()[]aP T b a C bP T a b a C -+=+--=2。