第一章热力学第一定律
- 格式:doc
- 大小:83.00 KB
- 文档页数:7



热力学第一定律一、基本概念1.系统与环境敞开系统:与环境既有能量交换又有物质交换的系统。
封闭系统:与环境只有能量交换而无物质交换的系统。
(经典热力学主要研究的系统)孤立系统:不能以任何方式与环境发生相互作用的系统。
2.状态函数:用于宏观描述热力学系统的宏观参量,例如物质的量n、温度T、压强p、体积V等。
根据状态函数的特点,我们把状态函数分成:广度性质和强度性质两大类。
广度性质:广度性质的值与系统中所含物质的量成正比,如体积、质量、熵、热容等,这种性质的函数具有加和性,是数学函数中的一次函数,即物质的量扩大a倍,则相应的广度函数便扩大a倍。
强度性质:强度性质的值只与系统自身的特点有关,与物质的量无关,如温度,压力,密度,摩尔体积等。
注:状态函数仅取决于系统所处的平衡状态,而与此状态的历史过程无关,一旦系统的状态确定,其所有的状态函数便都有唯一确定的值。
二、热力学第一定律热力学第一定律的数学表达式:对于一个微小的变化状态为:dU=公式说明:dU表示微小过程的内能变化,而δQ和δW则分别为微小过程的热和功。
它们之所以采用不同的符号,是为了区别dU是全微分,而δQ和δW不是微分。
或者说dU与过程无关而δQ和δW却与过程有关。
这里的W既包括体积功也包括非体积功。
以上两个式子便是热力学第一定律的数学表达式。
它们只能适用在非敞开系统,因为敞开系统与环境可以交换物质,物质的进出和外出必然会伴随着能量的增减,我们说热和功是能量的两种传递形式,显然这种说法对于敞开系统没有意义。
三、体积功的计算1.如果系统与环境之间有界面,系统的体积变化时,便克服外力做功。
将一定量的气体装入一个带有理想活塞的容器中,活塞上部施加外压。
当气体膨胀微小体积为dV时,活塞便向上移动微小距离dl,此微小过程中气体克服外力所做的功等于作用在活塞上推力F与活塞上移距离dl的乘积因为我们假设活塞没有质量和摩擦,所以此活塞实际上只代表系统与环境之间可以自由移动的界面。
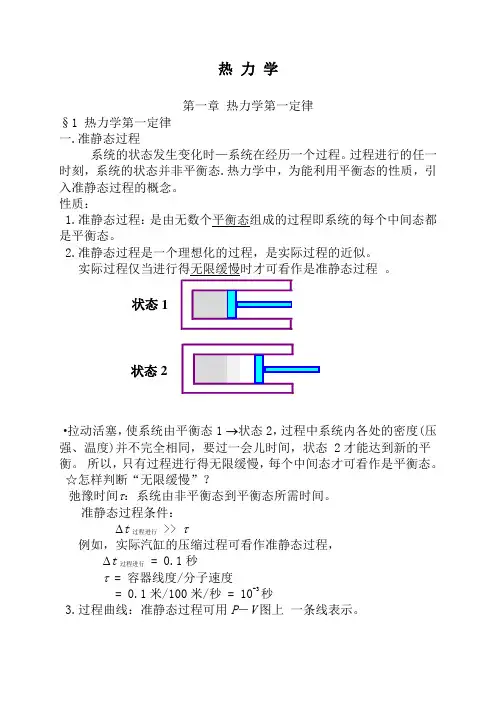
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。



第一章 热力学第一定律核心内容:能量守恒 ΔU=Q+W主要内容:三种过程(单纯pVT 变化、相变、化学反应)W 、Q 、ΔU 、ΔH 的计算一、内容提要1.热力学第一定律与状态函数(1)热力学第一定律: ΔU=Q+W (封闭系统) 用途:可由ΔU ,Q 和W 中的任意两个量求第三个量。
(2)关于状态函数(M )状态函数:p 、V 、T 、U 、H 、S 、A 、G ……的共性: ①系统的状态一定,所有状态函数都有定值;②系统的状态函数变化值只与始终态有关,而与变化的途径无关。
用途:在计算一定始终态间的某状态函数增量时,为了简化问题,可以撇开实际的复杂过程,设计简单的或利用已知数据较多的过程进行计算。
ΔM (实)=ΔM (设)。
这种方法称为热力学的状态函数法。
③对于循环过程,系统的状态函数变化值等于零,即ΔM =0。
此外,对于状态函数还有如下关系:对于组成不变的单相封闭系统,任一状态函数M 都是其他任意两个独立自变量(状态函数)x 、y 的单值函数,表示为M=M(x 、y),则注意:因为W 和Q 为途径函数,所以Q 和W 的计算必须依照实际过程进行。
⎰-=21V V a m bdV p W ,其中p amb 为环境压力。
Q 由热容计算或由热力学第一定律求得。
dy y M dx x M dM xy ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=)(1循环关系式-=⎪⎭⎫⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂xM y M y y x x M )(22尤拉关系式xy My x M ∂∂∂=∂∂∂1(p 1,V 1,T 1) (p'1,V 1,T 2) 2(p 2,V 2,T 2) (p 1,V'1,T 2) VT 将热力学第一定律应用于恒容或恒压过程,在非体积功为零(即w'=0)的情况下有:Q V =ΔU ,Q p =ΔH (H 的定义:H=U+pV )。
此时,计算Q v 、Q p 转化为计算ΔU 、ΔH ,由于U 、H 的状态函数性质,可以利用上面提到的状态函数法进行计算。


引言:1.热力学是研究热与其他能量之间的转化规律;2.化学热力学——热力学在化学中的应用;②化学变化的方向和限度——热力学第二定律特点:①宏观性质——研究系统宏观性质,而不考虑微观结构和微观因素②只考虑系统的始末态,而不追究过程的细节和速率局限性:只能对现象之间的联系做宏观的了解,而不能作微观的说明或给出宏观性质的数值。
§1.1 基本概念一、系统和环境㈠定义系统:研究对象,包括物质,空间环境:与系统紧密相关的外界㈡系统分类①敞开系统:系统与环境有物质和能量的交换②封闭系统;系统与环境无物质交换,有能量交换③隔离系统: 系统与环境无物质和能量的交换二、状态与状态函数※1.状态:系统趋于某一确定的热力学平衡态(力平衡、热平衡、化学平衡、相平衡)状态函数:描述状态的宏观物理学量(宏观量:温度T、体积V、压强P、熵S、焓H……)☆☆☆注意:⑴状态一定,状态函数一定;状态函数一定,状态一定(单一值)。
⑵只要有一个状态函数改变,状态就改变。
⑶状态的确定:ⅰ.单组分密闭均相系统,只要指定两个状态函数,状态就一定,而其他的状态函数Z将随之而定,因为Z=F(T,P).ⅱ.K种物质的多组分系统,指定T、P、X1、X2、X3...Xk-1,状态一定,Z=F(T、P、X1、X2、X3...Xk-1)(K个组分的浓度要一一指定).2.状态函数的特点:⑴状态一定,状态函数值一定。
⑵状态函数的改变量只取决于始末态,与途径无关△Z=∫dZ=Z末-Z初⑶系统循环一周,状态改变量为零,△Z=∮dZ=0.3.状态函数的全微分性Z=F(T、P)微小变化dZ=(dZ/dT)p dT+(dZ/dP)T dP4.状态函数的分类是否具有加和性:⑴广度性质——v、n、H、S...与物质的量有关,具有加和性⑵强度性质——T、P、M...自身特性,不具加和性两个广度性质之比=强度性质如,V m=V/n,C=n/V.三、过程和途径过程:任何状态的改变①等温过程:T初=T末=T环=常数②等压过程:P初=P末=P外=常数●恒外压过程:P初≠P末=P外=常数③等容过程:体积不变,△V=0.④绝热过程:系统与环境无热交换(爆炸瞬间)⑤循环过程:初态经过某个过程又回到初态,△Z=0.途径:初态到达末态具体的步骤.四、功和热※1.定义:热(Q)——系统与环境间由于温差所传递的能量功(W)——除热以外的其他所能传递的能量2.系统吸热Q为正,Q>0;放热Q为负,Q<0.系统对环境做功W为负,W<0;环境对系统做功,W为正,W >0.3.功和热不是状态函数,其值与途径有关.4.功的分类:其他功Wf(电功、表面功…)体积功dW=-P外dV W=∫- P外dV=-P外(V2-V1)5.功的计算方法①等容过程:△V=0或dV=0,W=∫- P外dV=0.②自由膨胀:P外=0,W=∫- P外dV=0.③恒外压过程:P外=常数,W=∫- P外dV=-P外(V2-V1).④等压过程:P1=P2=P外=常数,W=∫- P外dV=-P外(V2-V1). 例1:1mol理想气体由27℃、101.325Kpa在外压恒定为831400Pa下压缩到27℃,0.003m3,求压缩功。

第一章 热力学第一定律一、选择题1.下述说法中,哪一种正确( )(A)热容C 不是状态函数; (B)热容C 与途径无关;(C)恒压热容C p 不是状态函数;(D)恒容热容C V 不是状态函数。
2.对于内能是体系状态的单值函数概念,错误理解是( )(A) 体系处于一定的状态,具有一定的内能;(B) 对应于某一状态,内能只能有一数值不能有两个以上的数值; (C) 状态发生变化,内能也一定跟着变化; (D) 对应于一个内能值,可以有多个状态。
3.某高压容器中盛有可能的气体是O 2 ,Ar, CO 2, NH 3中的一种,在298K 时由5dm3绝热可逆膨胀到6dm3,温度降低21K ,则容器中的气体( )(A) O 2 (B) Ar (C) CO 2 (D) NH 34.戊烷的标准摩尔燃烧焓为-3520kJ·mol -1,CO 2(g)和H 2O(l)标准摩尔生成焓分别为-395 kJ·mol -1和-286 kJ·mol -1,则戊烷的标准摩尔生成焓为( )(A) 2839 kJ·mol -1 (B) -2839 kJ·mol -1 (C) 171 kJ·mol -1 (D) -171 kJ·mol -1 5.已知反应)()(21)(222g O H g O g H =+的标准摩尔反应焓为)(T H mr θ∆,下列说法中不正确的是( )。
(A). )(T H m r θ∆是H 2O(g)的标准摩尔生成焓 (B). )(T H m r θ∆是H 2O(g)的标准摩尔燃烧焓 (C). )(T H m r θ∆是负值 (D). )(T H m r θ∆与反应的θm r U ∆数值相等6.在指定的条件下与物质数量无关的一组物理量是( )(A) T , P, n (B) U m , C p, C V(C) ΔH, ΔU, Δξ (D) V m , ΔH f,m (B), ΔH c,m (B) 7.实际气体的节流膨胀过程中,下列那一组的描述是正确的( ) (A) Q=0 ΔH=0 ΔP< 0 ΔT≠0 (B) Q=0 ΔH<0 ΔP> 0 ΔT>0 (C) Q>0 ΔH=0 ΔP< 0 ΔT<0 (D) Q<0 ΔH=0 ΔP< 0 ΔT≠08.已知反应 H 2(g) + 1/2O 2(g) →H 2O(l)的热效应为ΔH ,下面说法中不正确的是( ) (A) ΔH 是H 2O(l)的生成热 (B) ΔH 是H 2(g)的燃烧热 (C) ΔH 与反应 的ΔU 的数量不等 (D) ΔH 与ΔH θ数值相等 9.为判断某气体能否液化,需考察在该条件下的( )(A) μJ-T > 0 (B) μJ-T < 0 (C) μJ-T = 0 (D) 不必考虑μJ-T 的数值10.某气体的状态方程为PV=RT+bP(b>0),1mol该气体经等温等压压缩后其内能变化为()(A) ΔU>0 (B) ΔU <0 (C) ΔU =0 (D) 该过程本身不能实现11.均相纯物质在相同温度下C V > C P的情况是()(A) (∂P/∂T)V<0 (B) (∂V/∂T)P<0(C) (∂P/∂V)T<0 (D) 不可能出现C V>C P12.理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和体系的焓变必定是()(A) T可逆> T不可逆, V可逆> V不可逆, ΔH可逆>ΔH不可逆(B) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆<ΔH不可逆(C) T可逆< T不可逆, V可逆> V不可逆, ΔH可逆<ΔH不可逆(D) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆>ΔH不可逆13.1mol、373K、1atm下的水经下列两个不同过程达到373K、1atm下的水汽:(1)等温可逆蒸发,(2)真空蒸发。
这两个过程中功和热的关系为()(A) W1 > W2, Q1 > Q2(B) W1 < W2 , Q1 < Q2(C) W1 = W2, Q1 = Q2(D) W1 > W2 , Q1 < Q214.对于内能是体系状态的单值函数概念,错误理解是( )(A)体系处于一定的状态,具有一定的内能;(B)对应于某一状态,内能只能有一数值不能有两个以上的数值;(C)状态发生变化,内能也一定跟着变化;(D)对应于一个内能值,可以有多个状态。
15.在一个绝热刚瓶中,发生一个放热的分子数增加的化学反应,那么()(A) Q > 0,W > 0,∆U > 0 ;(B) Q = 0,W = 0,∆U < 0 ;(C) Q = 0,W = 0,∆U = 0 ;(D) Q < 0,W > 0,∆U < 0 。
16.一定量的单原子理想气体,从A 态变化到B 态,变化过程不知道,但若A 态与B 态两点的压强、体积和温度都已确定,那就可以求出()(A) 气体膨胀所做的功;(B) 气体内能的变化;(C) 气体分子的质量;(D) 热容的大小。
17.如图,可表示理想气体卡诺循环的示意图是( )(A) 图⑴;(B) 图⑵;(C) 图⑶;(D) 图⑷二、填空题1.焦耳-汤姆孙系数def T J -μ ,μJ-T >0表示节流膨胀后温度将 。
2.在373K ,p θ下,1 mol 液态水向真空蒸发为373K ,p θ下的水蒸气,已知此过程的△H =40.6kJ ,则此过程的△U= kJ ,Q= kJ 。
3.已知反应C(s)+O 2(g)=CO 2(g)的△r H m θ(298K )=-393.51kJ·mol -1。
若此反应在一绝热钢瓶中进行,则此过程的△U 0,△H 0。
4.对于组成不变的均相密闭体系,当有 个独立的强度因素确定后,体系中所有的强度性质也就确定,若再知道 ,则所有的广度性质也就确定。
5.1mol298K 的液体苯在弹式量热计中完全燃烧,放热3264kJ ,则反应:2C 6H 6(l)+15O 2(g) =12CO 2(g)+6H 2O(l)的△r U m (298K) = kJ·mol -1, △r H m (298K) = kJ·mol -1。
6.某理想气体经绝热恒外压压缩,△U 0△H 0。
7.卡诺热机的效率只与 有关,而与 无关。
三、证明题1.证明:若一气体状态方程满足pV m = RT+bp 时,则该气体的内能仅是温度的函数。
2.某气体的状态方程为pV m = RT+ap ,a 为大于零的常数,证明该气体经节流膨胀后,气体的温度上升。
3.若物质的膨胀系数TT V V p 11=⎪⎭⎫ ⎝⎛∂∂=α,则C p 与压力无关。
4.已知纯物质的平衡稳定条件是()0/<∂∂T V p ,请证明任一物质绝热可逆膨胀过程后压力必降低。
5.某气体的状态方程为pV m = RT+ap,a为大于零的常数,证明:该气体的焦耳—汤姆孙系数μJ-T<0。
四、计算题1.某气体的状态方程为pV m = RT+ap,a为大于零的常数,证明:该气体的焦耳—汤姆孙系数μJ-T<0。
6.1mol单原子理想气体从始态273K、202.65kPa沿着p/V=常数的可逆途径变化到压力加倍的终态,试求:该过程的W、ΔU、ΔH、Q。
2.一摩尔单原子理想气体从0℃、2p始态,经由方程pV2 = const 规定的途径到达终态压力为15p,计算沿此途经的平均热容。
3.在空气中有一真空绝热箱,体积为V0,今在箱上刺一个小孔,空气流入箱内,设空气为理想气体(C p,m = 3.5R)。
⑴巳知空气温度是298K,箱内气体温度是多少?⑵若V0 = 10dm3,求该过程的Q、W、∆U、∆H各为多少?4.298.15K,1mol的CO2(实际气体)由始态p1 = 3p V1 = 7.9dm3等温变化到终态p2 = p V2 = 24dm3,求此过程的∆U与∆H。
巳知C p,m(CO2) = 36.6 J·K-1·mol-1,焦耳-汤姆逊系数μJ-T = 1.14 + 8.65 × 10-3(p/p) 。
5.1mol单原子分子理想气体由始态A(2p,298K),沿着p/p= 0.1(V m/ dm3·mol-1) + b的可逆途经膨胀到原体积2倍,计算终态的压力以及此过程的Q、W、第一章 热力学第一定律参考答案一、选择题答案:1-A; 2-C; 3-A; 4-D; 5-B; 6-D; 7-A; 8-D; 9-A; 10-D; 11-B; 12-B; 13- A; 14-C; 15-C; 16-B; 17-C; 二、填空题答案 1. 答案:Hp T ⎪⎪⎭⎫⎝⎛∂∂, 降低 2. 答案:37.5kJ ,37.5kJ 3. 答案:=,> 4. 答案:2,物质的量 5. 答案:-6528,-6535 6. 答案:>,> 7. 答案:两个热源的温度,工作物质 三、证明题答案1.证明:若一气体状态方程满足pV m = RT+bp 时,则该气体的内能仅是温度的函数2.某气体的状态方程为pV m = RT+ap ,a 为大于零的常数,证明该气体经节流膨胀后,气体的温度上升。
关及内能的变化与体积无也得分)证明:(其它合理证明0=--=-⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-∂∂=-⎪⎭⎫ ⎝⎛∂∂=-⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂⇒-=p b V RT p b V RT T T pT p T pV S T V U pdVTdS du m V m V T T )后,温度升高。
故节流膨胀(给分。
证明:其它合理证明也011][11,,,,,,p <pC a T C a C R V V C p RC T V C T V T V C p H C p T mp mp mp m m mp m p m mp pp T p H T J ∆∆⨯-=∆⇒-=-+-=⨯+-=⎪⎭⎫ ⎝⎛∂∂--=⎪⎪⎭⎫⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂=-μ3.若物质的膨胀系数TT V V p 11=⎪⎭⎫ ⎝⎛∂∂=α,则C p 与压力无关。
4. 5.与压力无关即又由给分证明:其它合理证明也p pp T pp T T pTT p T pp p C T V T V T pC T V T V V p S T pH VdP TdS dH p HTT H p p C TV T V T T V V 0)(11=⎪⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛∂∂-∂∂=⎪⎪⎭⎫ ⎝⎛∂∂⇒⎪⎭⎫ ⎝⎛∂∂-=+⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂⇒+=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛∂∂∂∂=⎪⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛∂∂∂∂=⎪⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂⇒=⎪⎭⎫ ⎝⎛∂∂=α()()011//<-=⎥⎦⎤⎢⎣⎡--=∴=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛+∂∂=⎪⎭⎫ ⎝⎛∂∂⎥⎥⎦⎤⎢⎢⎣⎡-⎪⎭⎫⎝⎛∂∂-=∂∂∂∂-=⎪⎪⎭⎫⎝⎛∂∂=--ppT J pp p p pT HT J C aV p R T C p Rp ap RT T T V V T V T C T H p H p T μμ 证明:故绝热膨胀后压力降低得分证明:其它合理证明也01<⎪⎭⎫ ⎝⎛∂∂=⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛∂∂⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂⇒-=⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂TV p p pV V S p V S p p p p p VV V V V V p C C V T T C T p C T V p S V pSV p T V C T S T T V S V p T T C p T T S p S四、计算题答案1.W=3404.6J ; Q=13619J ; ΔU=10214J ; ΔH=17023J2. C= 4.16 JK-13. T= 417.2K ; Q=0 ; W=ΔU=723.7J ; ΔH=1013.2J4.ΔU=54.3J ; ΔH=84.73J5.W=-3.236J ; Q=11.53kJ ; ΔU=8.29kJ ; ΔH=13.82kJ。