人们对原子结构的认识过程
- 格式:pdf
- 大小:757.26 KB
- 文档页数:4


原子结构理论的发展历程从古希腊哲学家对物质本质的思考,到现代物理学对原子结构的精确描述,人类对原子结构的认识经历了漫长而曲折的过程。
这一历程不仅是科学知识的积累,更是人类智慧的结晶,推动了科学技术的巨大进步。
在古代,哲学家们就开始思考物质的构成。
古希腊哲学家德谟克利特提出了“原子论”,他认为万物由不可分割的原子组成。
然而,这种观点更多地是基于哲学思考,缺乏科学实验的验证。
直到 19 世纪初,英国科学家约翰·道尔顿在前人的基础上,正式提出了近代原子论。
道尔顿认为,原子是构成物质的最小单位,不同元素的原子具有不同的质量和性质。
他的理论为化学研究奠定了基础,使得人们能够更系统地理解化学反应的本质。
随着科学技术的发展,19 世纪末,物理学家发现了阴极射线。
通过对阴极射线的研究,JJ汤姆孙在 1897 年提出了“葡萄干布丁”模型。
他认为原子就像一个带正电的“布丁”,电子像葡萄干一样镶嵌在其中。
但这个模型很快就受到了新的实验挑战。
1911 年,卢瑟福进行了著名的α粒子散射实验。
实验结果表明,原子的大部分质量集中在一个很小的核心区域,即原子核,而电子则在核外绕核运动。
这一发现彻底改变了人们对原子结构的认识,卢瑟福提出了原子的核式结构模型。
然而,核式结构模型也存在一些问题。
按照经典电磁学理论,电子绕核运动时会不断辐射能量,最终会坠入原子核,但实际情况并非如此。
为了解决这个问题,丹麦科学家玻尔在 1913 年提出了玻尔模型。
玻尔引入了量子化的概念,认为电子只能在特定的轨道上运动,并且在这些轨道上运动时不会辐射能量。
当电子从一个轨道跃迁到另一个轨道时,会吸收或发射特定频率的光子。
玻尔模型虽然成功地解释了氢原子光谱等一些现象,但对于多电子原子的复杂情况,它的解释能力有限。
20 世纪20 年代,量子力学的发展为原子结构理论带来了新的突破。
薛定谔、海森堡等科学家建立了量子力学的理论体系,从更本质的层面描述了原子中电子的运动状态。



人类对原子结构的认识——原子结构模型的演变人类对原子结构的认识是一个逐步演变的过程。
从古希腊时期开始,人们对原子的概念就存在一定的认识,但是直到近代才逐渐了解原子的真正本质和结构。
本文将从古希腊时期的原子概念开始,主要介绍原子结构模型的演变过程,包括汤姆逊模型、卢瑟福模型和波尔模型,直到现代的量子力学模型。
古希腊时期,由于实验条件的限制,人们对原子的概念还比较朦胧。
古代哲学家德谟克利特首次提出“原子”的概念,原子是构成世界万物的最基本单位,它们具有不可分割的性质。
然而,这仅仅是一种哲学上的假设,没有经过科学实验的验证。
到了19世纪末,随着科学实验技术的进步,科学家对原子的理解逐渐深入。
在这个时期,英国科学家约翰·道尔顿提出了道尔顿原子论。
他认为,所有物质都是由不可分割的小颗粒(道尔顿原子)构成的,每种物质由不同类型的原子组成。
这个理论为解释化学反应和元素周期性表提供了重要的基础。
然而,到了20世纪初,科学家们发现了一些无法用道尔顿原子论解释的实验现象。
1904年,英国物理学家汤姆逊提出了汤姆逊模型,也被称为“葡萄干糕布模型”。
他认为,原子是一个正电荷球体,而电子则均匀地分布在球体内部,就像葡萄干糕布一样。
这个模型解释了电子的存在和负电荷,但没有考虑到原子中的正电荷分布。
1909年,英国物理学家卢瑟福进行了著名的金箔散射实验,这个实验改变了人们对原子结构的认识。
实验结果表明,大部分α粒子通过金箔而无明显偏转,但一小部分α粒子发生了大角度的散射。
基于这个实验结果,卢瑟福提出了卢瑟福模型,也被称为“太阳系模型”。
他认为,原子是由一个小而密集的带正电荷的核心,以及围绕核心运动的电子组成。
这个模型解释了实验结果,卢瑟福还通过核和电子的质量和电荷比计算出了核的大小。
然而,卢瑟福模型仍然存在一些问题。
根据经典电磁理论,一个加速的电子应该会辐射能量并从核中坠落,但事实上我们并没有看到这种现象。
为了解决这个问题,1913年,丹麦物理学家尼尔斯·波尔提出了波尔模型。

人类对原子结构的认识经历了一个漫长而曲折的历程。
从古希腊哲学家德谟克里特提出的“原子论”到现代量子力学的发展,人类对原子结构的认识不断深化和完善。
公元前5世纪,古希腊哲学家德谟克里特提出了“原子论”,认为宇宙万物都是由不可再分的、永恒的、微小的原子组成的。
这一理论为后来的原子结构研究奠定了基础。
然而,由于当时的科学技术水平有限,人们对原子结构的认识仅停留在宏观层面,无法揭示原子内部的奥秘。
19世纪初,英国科学家约翰·道尔顿提出了“道尔顿原子模型”,将原子划分为带正电荷的质子和带负电荷的电子,这是人类对原子结构认识的第一次重大突破。
随后,奥地利物理学家欧文·朗缪尔提出了“朗缪尔原子模型”,引入了原子核的概念,进一步揭示了原子内部结构的复杂性。
20世纪初,丹麦物理学家尼尔斯·玻尔提出了“玻尔原子模型”,将电子围绕原子核的运动分为不同的能级,解释了氢光谱现象。
这一模型被认为是量子力学的雏形,为后来的原子结构研究奠定了基础。
1927年,美国物理学家埃尔温·薛定谔提出了“薛定谔方程”,奠定了量子力学的基础。
薛定谔方程描述了微观粒子(如电子)在特定势场中的运动规律,为揭示原子内部结构提供了理论依据。
在此基础上,德国物理学家沃纳·海森堡、马克斯·玻恩等人提出了著名的“不确定性原理”,揭示了微观世界的非确定性特征。
随着科学技术的不断发展,人类对原子结构的认识也在不断深入。
20世纪中叶,美国物理学家罗伯特·塞格瑞等人提出了“塞格瑞模型”,将原子核分为质子和中子,解释了原子核的稳定性问题。
此外,科学家们还发现了反物质、超重元素等新的物质形态,丰富了人类对原子结构的认识。
总之,人类对原子结构的认识经历了一个漫长而曲折的历程。
从古希腊哲学家德谟克里特的“原子论”到现代量子力学的发展,人类对原子结构的认识不断深化和完善。
在未来,随着科学技术的进一步发展,人类对原子结构的认识必将更加深入,为人类探索宇宙奥秘提供更多的理论支持。

原子结构的发展史及过程如下:
人类对原子的认识史可以大致划分为5个阶段:古代原子论。
道尔顿原子论。
汤姆森原子模型和卢瑟福原子模型。
波尔原子模型。
原子结构(核外电子运动)的量子力学模型。
1803年道尔顿提出了原子模型,他认为:原子是组成物质的基本的粒子,它们是坚实的、不可再分的实心球。
101年后汤姆生在1904年提出:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
然后二十世纪最伟大的物理学家卢瑟福在1911年提出了他的原子模型:在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
两年之后他的学生玻尔将量子学说引入了原子结构模型:电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
现在,科学家已能利用电子显微镜和扫描隧道显微镜拍摄表示原子图像的照片。
随着现代科学技术的发展,人类对原子的认识过程还会不断深化。
卢瑟福行星
汤姆森的学生卢瑟福完成的α粒子轰击金箔实验(散射实验),否认了葡萄干面包式模型的正确性。
1911年卢瑟福提出行星模型:原子的大部分体积是空
的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转。
行星模型由卢瑟福在提出,以经典电磁学为理论基础,主要内容有:原子的大部分体积是空的。
在原子的中心有一个很小的原子核。
原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。
带负电的电子在核空间进行绕核运动。

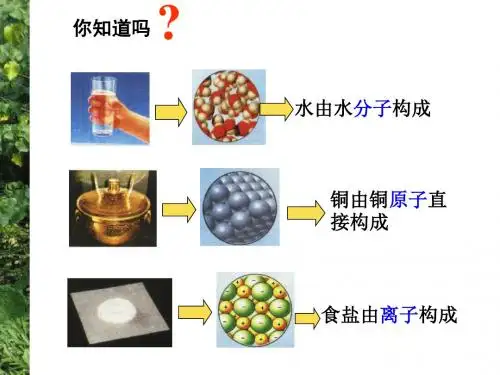
第1讲人类对原子结构的认识1.构成物质的微粒构成物质的微粒有原子、分子和离子。
原子是化学变化中的最小微粒,能直接构成物质,如金刚石、石墨等。
分子是构成物质的一种微粒,更多的研究结果表明,分子是由原子结合而成的,如:He、O2、O3、H2O、CO2、H2SO4等。
原子可以通过得到或失去电子形成离子,离子也是构成物质的微粒,如氯化钠就是由Na+和Cl-构成的。
2.原子原子的英文名(Atom)是从äτομοζ(atomos,“不可切分的”)转化而来。
很早以前,希腊和印度的哲学家就提出了原子的不可切分的概念。
17和18世纪时,化学家发现了物理学的依据:对于某些物质,不能通过化学手段将其继续的分解。
19世纪晚期和20世纪早期,物理学家发现了亚原子粒子以及原子的内部结构,由此证明原子并不是不能进一步切分。
原子是一种元素能保持其化学性质的最小单位,一个原子包含有一个致密的原子核及若干围绕在原子核周围带负电的电子,原子核由带正电的质子和电中性的中子组成。
在原子中,质子数与电子数相同,原子表现为电中性。
如果质子数和电子数不相同,就成为带有正电荷或者负电荷的离子。
根据质子和中子数量的不同,原子的类型也不同,质子数决定了该原子属于哪一种元素。
原子是一个极小的物体,其质量也很微小,原子的99.9%的重量集中在原子核,其中的质子和中子有着相近的质量,目前可用扫描隧道显微镜观察并拨动单个原子,下图为超高真空多功能扫描隧道显微镜,中图为显微镜下的硅原子结构,右图为在扫描隧道显微镜下科学家拨动49个铁原子排列在钢表面上形成的一个圆形栅栏。
1.原子的组成原子是化学反应中的最小微粒,在化学反应中不可分割。
科学研究表明,绝大多数原子的原子核由质子和中子构成,质子、中子和电子的质量、所带电荷各不相同。
1个质子带1个单位的正电荷,1个电子带1个单位的负电荷,中子不显电性。
原子核内的质子数与原子核外的电子数相等,所以原子呈电中性。

城东蜊市阳光实验学校思维过程一原子构造模型的演变〔一〕演变过程1.古希腊科学家对于原子构造的认识是人们对于原子构造认识的初始阶段,提醒了物质由原子构成的这一根本的观点。
2.道尔顿提出了质量守恒这一观点。
3.由汤姆生发现电子后提出“枣式〞原子模型。
4.卢瑟福提出“核式〞构造原子模型。
5.玻尔把量子说引入核式构造的原子模型,提出原子的量子态理论。
〔二〕原子的核外电子排布电子依能量的不同是分层排布的,其主要规律是:1.核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层〔能量最低原理〕。
2.原子核外各电子层最多包容2n2个电子。
3.原子最外层电子数目不超过8个〔K层为最外层时不能超过2个电子〕。
4.次外层电子数目不能超过18个〔K层为次外层时不能超过2个〕,倒数第三层电子数目不能超过32个。
〔三〕元素的性质与元素的原子核外电子排布的关系1.稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子〔氦是2个电子〕,处于稳定构造,因此化学性质稳定,一般不跟其他物质发生化学反响。
2.非金属性与金属性〔一般规律〕:思维过程二原子的构成1.学会从空间、质量、电性三个方面来认识原子构造〔1〕原子由原子核和核外电子组成,从空间体积看,原子核只占原子体积的几千亿分之一,假设原子像地球大小,那么原子核体积只像乒乓球大小一样。
〔2〕原子核的体积虽小,但原子的质量几乎全集中在原子核上,质子和中子的相对质量都近似为1,电子的质量很小,仅约为质子质量的1/1836。
〔3〕组成原子“三粒子〞的带电情况及粒子数目的关系:中子不带电,一个质子带一个单位正电荷,一个电子带一个单位负电荷。
2.原子的组成和三种粒子间的关系AX的含义:代表一个质量数为A、质子数为Z的原子。
N质量数〔A〕=质子数〔Z〕+中子数〔N〕。
核电荷数=元素的原子序数=质子数=核外电子数3.核素:质子数和中子数都一样的原子称为一种原子,又称为一种核素。

化学13《人类对原子结构的认识》思维过程人类对原子结构的认识是一个长期的探索过程,从古代的哲学思考到现代的实验研究,人们逐渐揭开了原子结构的神秘面纱。
以下是人类对原子结构认识的思维过程。
古代哲学思考阶段:在古代,人们对自然界的原理和现象有了初步的思考。
古希腊哲学家德谟克利特是最早提出原子学说的人之一、他认为物质是由不可分割的微小粒子组成的,这些粒子称为“原子”。
这一理论为后来的原子学说奠定了基础。
科学实验阶段:17世纪,化学家罗伯特·波义耳进行了大量的气体实验,他发现气体的性质可以用物质微粒的概念解释。
他提出了气体是由不可见的微粒组成的,这些微粒之间通过碰撞产生相互作用。
波义耳的实验结果为原子学说提供了实验证据。
麦克斯韦的动力学理论:19世纪,麦克斯韦提出了动力学理论,通过数学公式描述了气体分子的运动规律。
他的理论推翻了牛顿的连续介质理论,认为物质是由离散的微粒组成的。
这一理论为原子学说提供了新的理论支持。
汤姆逊的电子研究:19世纪末,英国物理学家约瑟夫·汤姆逊通过实验研究发现了电子。
他通过放电实验发现,电流通过时,会有负电荷的粒子从阴极发射,称之为电子。
汤姆逊提出了“葡萄干面包模型”,即认为原子是一个带正电的球体,球中带有负电的电子。
卢瑟福的散射实验:20世纪初,英国物理学家欧内斯特·卢瑟福进行了著名的金箔散射实验。
他使用放射性物质砰击金箔,观察射线的散射情况。
实验结果表明,大多数粒子都穿过了金箔,只有极少数粒子发生了散射。
根据实验结果,卢瑟福提出了原子结构的新模型,即“卢瑟福模型”。
他认为原子中有一个微小且带正电的核,电子绕核旋转。
卢瑟福-玻尔模型:根据卢瑟福的散射实验,丹麦物理学家尼尔斯·玻尔推导出了电子在不同能级上的运动规律。
他提出了玻尔模型,即原子中的电子绕核旋转在不同的轨道上,每个轨道对应一个能级。
这一模型解释了原子光谱等现象。
量子力学的建立:20世纪初,由于实验现象的复杂性,玻尔模型无法解释一些现象,需要更精确的理论来描述原子结构。
人们对原子的认识人们对原子结构的认识,经历了一个由卢瑟福原子模型、玻尔氢原子结构理论到现代原子结构量子理论的发展过程。
现代原子结构理论,是在量子力学的基础上建立的。
它以电子云的概念代替了卢瑟福和玻尔的固定轨道的概念,报示了电子运动的波粒二象性及其能量变化量子化的特殊规律.在科学史上,人们对原子结构的认识是有一个历史过程的。
早在两千四百年前。
古希腊著名的哲学家德谟克里特提出了“原子”的概念,认为自然界的一切物质都是由一些坚硬不可分的小颗粒构成,并命“小微粒”为原子。
但是,由于没有科学实验依据和宗教势力的极力反对.所以在这之后的两千多年里,人们对物质的结构认识一直没有很大进展。
直到十九世纪,道尔顿和阿佛加德罗先后提出了原子论和分子论,并于1860年,正式建立了原子——分子论.认为物质由分子构成,分子由原子构成,原子则是不可再分的最小微粒。
这就是二十世纪以前人们对物质结构的认识.1897年,著名的英国物理学家汤姻逊,对克鲁克斯发现的阴极射线进行了精细的研究,测定了这种微粒的质量和电行,并命这种微粒为“电子”,这就有力地证明原子是不可再分的最小微粒的错误结论。
1919年,卢瑟福用科学实验证明原子中还有一种微粒,共命它为“质子”。
到本世纪三十年代,人们从实验中发现原子还能分裂另一种电中性的微粒.命它为“中子”.在1911年,卢瑟福正式提出了一个核式原子模型理论。
他指出:原子是由带上电行的原子核和带负电行的核外电子构成,原子核位于原子中心,占有很小的体积,但几乎集中原子的全部质量,核外电子就象行星绕太阳那样绕核旋转.因此,这个理论也称为行星式或天体式原子模型.继他之后,又作了重大发展的是他的助手丹麦物理学家玻尔。
玻尔大胆地运用了量子的概念(1900年由普朗克提出)来解释氢原子结构。
获得了很大的成功。
但是,他并没有彻底摆脱经典物理学的束缚。
仍然坚持电子沿一定轨道绕核运转的观点。
现在原子结构理论,主任是在卢瑟福利玻尔的基础上用量子力学(1926年建立)代替经典力学.对核外电子的运动状态给予了科学的解释.随着原子理论的建立和发展,人们对物质及其变化的规律有了新的认识。
原子结构的发展历史一、古代对原子的认识古代的人们对于原子的认识主要是基于哲学和思辨。
古希腊哲学家德谟克利特最先提出了原子的概念,认为物质是由不可再分的微小颗粒组成的。
他将这些微小颗粒称为"原子",意为不可分割的。
二、化学元素周期表的发现19世纪初,化学家开始研究不同元素之间的关系。
德国化学家道尔顿提出了第一个完整的原子理论,他认为所有物质都是由不可再分的原子组成的,并且每种元素的原子具有独特的质量和性质。
这一理论为后来的原子研究奠定了基础。
随后,化学家门捷列夫发现了化学元素周期表。
他发现元素的性质和原子的质量之间存在着一定的规律,将元素按照原子质量排列,发现了一些周期性的规律。
这一发现进一步支持了原子理论的正确性,并为后来的原子结构研究提供了重要线索。
三、电子的发现19世纪末,物理学家开始研究原子的结构。
英国物理学家汤姆逊通过实验证明了电子的存在。
他使用了电磁场将电子从原子中抽离出来,并通过测量电子的质量和电荷比,发现了电子是原子的基本组成部分之一。
四、卢瑟福金箔实验1909年,英国物理学家卢瑟福进行了著名的金箔散射实验。
他将α粒子轰击金箔,观察粒子的散射情况。
实验结果出乎意料地显示,大部分α粒子直接穿过金箔,只有极少数α粒子发生明显的偏转。
这意味着原子内部存在着一个非常小而带正电的核心。
五、玻尔模型基于卢瑟福的实验结果,丹麦物理学家玻尔提出了玻尔模型,描述了原子的结构。
他认为原子由一个紧密排列的正电荷核心和围绕核心旋转的电子组成。
电子只能存在于特定的能级上,并跳跃到不同能级时会吸收或发射能量。
这一模型解释了原子光谱的现象,并为后来的量子力学奠定了基础。
六、量子力学的发展20世纪初,量子力学的发展使得人们对原子结构有了更深入的了解。
量子力学描述了微观粒子的行为,包括电子在原子中的行为。
通过量子力学,科学家们发现了电子云模型,即电子在原子中呈现一种概率分布的状态。
这一模型更为准确地描述了原子的结构。
回顾历史:人们对原子结构的认识过程
科学研究工作的一种重要方法—-假说与模型
1、公元前5世纪,我国墨翟认为构成物质的微粒为“端”,意指不能再分的质点;战国时《庄子·天下篇》一书中提出:物质无限可分的思想。
公元前4世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子;而且原子有不同的形态。
2、19世纪初,英国科学家道尔顿提出近代原子学说。
道尔顿原子模型:原子是构成物质的基本粒子,它非常小,不可再分,内
部没有任何结构,就像一个小球一样。
实心球模型
道尔顿提出原子模型虽然多半处于想象,但也有符合科学研究基本原则的
地方,所以是合理的想象。
3、1897年,英国科学家汤生逊发现了电子。
汤姆生的原子模型:原子由带正电荷的主体和带负电荷的电子组成,电子像镶嵌在蛋糕中的葡萄干那样处于正电荷的“海洋”中。
这个模型中电子与正电荷的分布是处于想象的,因为没有实验证明。
浸入模型(枣糕模型)
4、1911年,卢瑟福提出原子模型:
原子由带正电的原子核和带负电的电子构成,在原子的中心有一个很小的核,原子核集中了原子的绝大多数质量和全部的正电荷,电子在核外
空间绕着核旋转。
卢瑟福原子行星模型
5.玻尔的原子壳型结构:
电子依据能量不同,在原子核外不同区域(电子层)运动。
玻尔原子壳型结构
6.奥地利物理学家薛定谔提出电子云模型(几率说):
电子云是近代对电子用统计的方法,在核外空间分布方式的形象描绘,
我们不能预言电子在某一时刻究竟出现在核外空间的哪个地方,只能知道它在某处出现的机会有多少,即几率密度大小,用小白点的疏密来表示。
小白点密处表示电子出现的几率密度大,小白点疏处几率密度小,看上去好像一片带负电的云状物笼罩在原子核周围,因此叫电子云。
薛定谔电子云模型。