人类对物质结构的认识(20201010160157)
- 格式:pdf
- 大小:783.16 KB
- 文档页数:6


自然科学中的物质结构概念与哲学中的物质范畴1.引言自然科学和哲学一直以来都在探讨物质的性质和结构。
在自然科学中,物质结构概念是指物质的组成和排列方式,而在哲学中,物质范畴则是对物质存在的认识和理解。
本文将从自然科学和哲学的角度对物质结构和物质范畴进行深入探讨,并比较两者之间的联系和区别。
2.物质结构概念的探讨在自然科学中,物质结构概念包括了物质的元素、分子和原子的组成和排列方式。
元素是构成物质的基本单位,而分子和原子则是元素的组合形式。
通过实验和观察,科学家们发现了元素周期表以及分子和原子的结构模型,进一步揭示了物质的内部构成和排列规律。
以元素为例,化学元素是指具有一定的原子序数和原子量,以及具有独特的化学性质和结构特征的最小单位。
元素周期表将所有已知的元素按照其原子序数和原子量进行了排列,揭示了元素之间的周期性规律和化学性质的变化。
而分子和原子的结构模型则更加深入地探讨了物质内部的构成,例如分子的键合方式和原子的核子结构等。
这些研究不仅让我们了解了物质的基本组成单位,还揭示了物质的宏观性质和微观结构之间的内在联系。
3.哲学中的物质范畴的探讨在哲学中,物质范畴是对物质存在的认识和理解。
古希腊哲学家柏拉图提出了“理念”和“现象”之间的对立,认为物质世界只是“理念”的影子和映射,而“理念”才是真实的存在。
而亚里士多德则提出了“形式”和“物质”的概念,认为物质是由形式赋予实体的具体化,形式赋予了物质其特定的属性和本质。
而现代哲学中,物质范畴的探讨更多地涉及了对物质真实性和可知性的思考。
康德提出了现象界和本体界的区分,认为我们只能通过感觉和经验来认识现象界的物质,而对本体界的物质则无法进行直接认识。
这种认识方式将物质的真实性和可知性置于了哲学讨论的中心,并对我们对物质的认知方式提出了挑战。
4.物质结构概念与物质范畴的联系与区别虽然物质结构概念和物质范畴是从不同领域探讨的物质的性质和存在方式,但它们之间存在着联系和区别。

人类对物质结构认识的发展简史集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-人类对物质结构认识的发展简史从古代到现代,人们对物质结构的认识,特别是对原子的认识,经历着不断深化、完善的漫长历史过程。
这个过程至今还未结束,人们对这个问题的研究,还在不断地发展中。
远在公元前,古代的人们就对“宇宙是由什么东西构成的?”“宇宙是连续的,还是不连续的?”两个问题提出了不同的看法。
公元前四百五十年以前,希腊哲学家德谟克里特继承了刘基伯最先提出“原子论”,他认为宇宙万物都由最微小、坚硬、不可入,不可分割的物质粒子所构成。
这种粒子叫做原子。
宇宙万物间的千差万别都来自组成它的原子在数目,形状和排列上的不同所致。
同时期,我国春秋战国时代,一些着名的思想家如惠施、墨子等也都从不同角度提出了物质有不能再分的最小单位的观点。
但当时这种观点主要是哲学家的一种朴素的、唯物的直觉想象,是一种哲学臆想。
中国古代还有一种有关物质构成的五行学说,就是把构成物质的材料分成金、木、水、火、土五类。
大约到了战国时代五行学说得到了发展,意义范围扩大了。
一种是五行相胜说,如“水胜火、火胜金、金胜木、木胜土、土胜水”。
如此构成一个循环,相互制约。
另一种是五行相生说,“木生火、火生土、土生金、金生水、水生木”,也构成一个循环。
中国从战国到秦汉转入炼丹术时期,公元7至9世纪,炼丹术由中国传播到阿拉伯,促进了炼金术的发展。
公元11、12世纪,炼金术又由阿拉伯传到欧洲,这样经过了一段很长的历史时期,人们对物质结构的研究没有新的发展。
随着生产和科技的发展,人们的注意力又转到冶金、酿酒、染色和玻璃等跟手工业生产有关的实用化学方面的研究。
一直到公元17世纪末,18世纪初,1703年,德国化学家斯塔尔提出了燃素学说,认为火是由无数细小而活泼的微粒构成的物质实体。
这种由火微粒构成的火元素就是“燃素”。
人们的注意力又回到物质结构的研究。

物质的结构与分类物质是构成宇宙万物的基本要素,也是人类认识和探索世界的核心对象。
在日常生活中,我们常常见到各种各样的物质,如水、空气、石头等。
这些物质的结构和分类对于我们理解它们的性质和应用非常重要。
因此,本文将就物质的结构与分类进行探讨。
一、物质的结构在微观层面上,物质由原子和分子构成。
原子是物质的基本单元,它们由质子、中子和电子组成。
原子中的质子和中子位于核心,而电子则在核心周围的轨道上运动。
不同元素的原子具有不同的原子序数(即质子数),通过元素周期表可以对元素进行分类。
分子是由两个或更多原子通过共价键连接而成的结构。
共价键是指电子在原子之间共享形成的化学键。
例如,氧分子(O2)是由两个氧原子通过共价键连接而成。
分子的组成和结构决定了物质的性质和性质的差异性。
二、物质的分类根据其组成和性质的差异,物质可以分为纯物质和混合物两大类。
1. 纯物质纯物质是由同一种元素或化合物组成的物质。
它们具有确定的化学组成和固定的物理性质。
纯物质又可细分为元素和化合物。
(1)元素:元素是由具有相同原子序数的原子组成的物质。
例如,氢气(H2)和金属铁(Fe)都是由一种元素的原子组成的纯物质。
元素根据其在元素周期表中的位置可以进一步分类。
(2)化合物:化合物是由两个或更多不同元素的原子通过化学键结合而成的物质。
例如水(H2O)是由氢和氧元素组成的化合物。
化合物的化学性质和物理性质不同于其组成元素,且可以通过化学反应进行分解。
2. 混合物混合物是由两种或多种纯物质混合而成的物质,其组成可变且物理性质可随混合比例的改变而改变。
混合物又可分为均质混合物和非均质混合物。
(1)均质混合物:均质混合物又称溶液,是由两种或多种物质在微观层面上完全均匀分布的混合物。
例如,盐水和空气都是均质混合物。
均质混合物中的各个组成部分无法通过肉眼分辨,只能通过物理手段分离。
(2)非均质混合物:非均质混合物是指组分在空间上不均匀分布的混合物。
例如,砂糖和沙子的混合物以及油水混合物都属于非均质混合物。

物质的结构与性质从微观到宏观的认知物质是构成世界的基本组成部分,我们所熟知的各种物质都具有不同的结构和性质。
从微观到宏观,通过认知这些结构和性质,我们可以更好地理解物质的行为和特性。
本文将从微观和宏观两个层面讨论物质的结构与性质,以帮助读者更好地理解这个话题。
首先,我们从微观层面来了解物质的结构和性质。
微观层面是指分子、原子和离子等微观粒子的层面。
物质的结构是由这些微观粒子的组合、排列和运动方式决定的。
他们以不同的方式连在一起,形成了不同的化学物质。
例如,金属的微观结构是由金属离子和自由电子组成的,这使得金属具有导电性和延展性。
另一方面,晶体的微观结构是由原子或分子按规则排列形成的,这使得晶体具有明确的几何形状和破碎困难。
微观层面的物质结构对物质的性质有着重要影响。
微观结构的改变通常会导致物质性质的变化。
例如,固体、液体和气体之间的状态变化就是由于微观结构的改变引起的。
在固体中,微观粒子紧密排列,有规律的结构,因此固体具有定形、定容和无法流动的性质。
而在液体和气体中,微观粒子之间的排列没有规律,因此液体和气体具有可流动性和可压缩性。
在理解微观结构与性质的同时,我们也需要了解宏观层面的物质行为。
宏观层面是指我们能够肉眼观察和感知的物质性质和现象。
宏观性质是由大量微观粒子的行为综合决定的。
例如,物质的颜色、形态、重量和熔点等都是在宏观层面可见的性质。
通过观察和研究宏观性质,我们可以更好地理解物质在日常生活中的应用和行为。
物质从微观到宏观的认知是一个逐渐深入的过程。
从微观到宏观的认知涉及到多个层面的知识和理论。
例如,化学是研究物质的微观结构和变化的科学;而物理学则是研究物质在宏观层面上的性质和行为的科学。
通过学习和了解这些学科,我们可以逐渐深入了解物质的微观和宏观特性。
在了解物质的结构与性质的同时,我们还需要了解不同物质之间的相互作用。
不同物质之间的相互作用是导致物质结构和性质多样性的原因之一。
分子间力,如静电力、范德华力和氢键等,是影响物质相互作用的主要因素之一。

物质结构知识点精讲在我们生活的这个世界中,物质无处不在。
从我们呼吸的空气,到脚下坚实的大地,从璀璨的宝石到日常使用的各种材料,无一不是由物质构成。
而要深入理解这些物质的性质和行为,就需要探究它们的结构。
物质结构是化学学科中的一个重要领域,它为我们揭示了物质世界的奥秘。
首先,让我们来谈谈原子结构。
原子是构成物质的基本单位,就像乐高积木中的最小块,可以组合成各种各样的东西。
原子由原子核和核外电子组成。
原子核位于原子的中心,包含质子和中子。
质子带正电荷,中子不带电。
而核外电子则围绕着原子核高速运动,它们带负电荷。
质子的数量决定了原子的种类,我们称之为原子序数。
比如,氢原子有 1 个质子,氧原子有 8 个质子。
电子的数量和质子相等时,原子呈电中性。
但在某些情况下,原子会失去或得到电子,从而形成带电荷的离子。
电子在原子核外不是随意分布的,而是按照一定的规律分层排布。
这就好像是一栋多层的大楼,每一层能容纳的人数是有限的。
第一层最多容纳 2 个电子,第二层最多容纳 8 个,第三层最多 18 个,依次类推。
这种分层排布决定了原子的化学性质。
接下来,我们说一说化学键。
当原子们相互结合形成分子或化合物时,它们之间会通过化学键相连。
化学键主要有三种类型:离子键、共价键和金属键。
离子键通常在金属元素和非金属元素之间形成。
比如氯化钠(NaCl),钠原子容易失去一个电子变成带正电的钠离子,氯原子容易得到一个电子变成带负电的氯离子。
钠离子和氯离子通过静电作用相互吸引,形成离子键。
共价键则是由原子之间共用电子对形成的。
比如氢气(H₂),两个氢原子都需要 1 个电子才能达到稳定结构,它们就共用一对电子,形成共价键。
共价键又分为极性共价键和非极性共价键。
在极性共价键中,电子对会偏向电负性较大的原子;而在非极性共价键中,电子对在两个原子间均匀分布。
金属键存在于金属单质中。
金属原子的外层电子可以在整个金属晶体中自由移动,形成所谓的“电子气”,将金属原子紧密地结合在一起。

初中物理物质结构知识点整理物质是构成世界的基本单位,掌握物质结构的知识对于初中物理学习至关重要。
本文将对初中物理中与物质结构相关的知识点进行整理,帮助同学们更好地理解和记忆这些重要概念。
首先,物质的组成。
物质是由微观粒子组成的,我们可以从两个角度来看待物质的组成:宏观角度和微观角度。
从宏观角度来看,物质可以分为纯物质和混合物。
纯物质是由同一种类的微观粒子组成的,如氧气、金属等。
而混合物则是由不同种类的微观粒子混合而成,如空气、矿泉水等。
从微观角度来看,物质的基本单元是原子。
原子是构成物质的最小单位,它由质子、中子和电子组成。
质子带有正电荷,中子电荷为零,电子带有负电荷。
质子和中子集中在原子的中心核中,电子则绕核运动。
不同的元素由于其原子中质子的数目不同而具有不同的性质,这也是化学元素周期表的基础。
进一步来说,原子还可以进一步划分为更小的粒子,包括质子、中子和电子。
质子和中子集中在原子核中,它们的质量相对比较大,而电子则以高速运动在原子核外围的能级上,质量相对较小。
质子和中子质量相近,均约为1单位(质子和中子质量相等的粒子为1单位),而电子质量约为0.0005单位。
除了原子,物质还可以由更小的粒子组成,即元素微粒。
元素微粒是指质子、中子和电子这些构成元素的基本粒子。
同一种元素的微粒通常具有相同的质量和电荷。
物质通过微观粒子之间的相互作用而表现出不同的性质。
接下来,让我们来了解一下分子和化合物。
分子是物质中微观粒子的最小单元。
它是由两个或多个原子通过共享或转移电子而形成的。
当两个或多个不同种类的原子结合在一起时,我们称之为化合物。
分子和化合物的形成是由微观粒子之间的化学键相互作用所决定的。
除了分子和化合物,还有一些特殊的物质结构需要我们了解。
例如,晶体是由原子、分子或离子按照一定的规律排列而形成的有序固态结构。
而非晶体则是没有规则排列的无定形固态结构,如玻璃等。
最后,让我们来了解一下物质的状态变化和相变过程。

物质的微观结构科普嘿,咱今儿就来聊聊这神奇的物质微观结构!你说这世界上的东西,大到高山大海,小到尘埃微粒,那可真是千奇百怪啊。
但你想过没,它们其实都是由一些超级小的玩意儿组成的呢!就好像搭积木一样,不同的积木可以搭出各种各样的造型。
物质的微观结构也是如此,那些小小的粒子,组合起来就成了我们看到的丰富多彩的世界。
比如说原子,这可是个重要角色啊!它就像一个小家庭,里面有原子核这个大家长,还有电子这些小家伙们围着它转。
原子核呢,又包含着质子和中子,它们紧密地团结在一起。
咱来打个比方吧,原子核就像是一个球队的核心球员,质子和中子就是他的得力助手,而电子呢,就像是围着球队欢呼的粉丝。
它们相互配合,共同构成了原子这个整体。
再说说分子吧,那可是原子们手牵手组成的小团体呀!不同的原子组合在一起,就变成了各种各样不同的分子。
水就是由氢原子和氧原子组成的分子,你看,普普通通的水,在微观世界里也有着这么奇妙的构成呢!这物质的微观结构啊,就像是一个神秘的宝藏,等着我们去挖掘。
你想想,如果我们能真正搞清楚这些小小的粒子是怎么工作的,那我们能做出多少神奇的事情啊!说不定能发明出超级厉害的材料,或者找到解决能源危机的办法呢。
而且啊,这微观世界里还有很多我们还不太明白的地方呢。
就好像一片广阔的未知领域,等着我们去探索。
说不定哪天我们就能发现一些前所未有的东西,那该多让人兴奋啊!你看,我们生活中的一切,都离不开这些微观结构。
从我们吃的食物,到穿的衣服,再到我们用的各种东西,都是由这些小小的粒子组成的。
这是不是很神奇呢?我们平时可能不会去注意这些微观的东西,但它们却实实在在地影响着我们的生活。
就好像空气,我们看不见摸不着,但我们却一刻也离不开它。
所以啊,我们要好好感谢这些微观结构,是它们让我们的世界变得如此丰富多彩。
我们也要努力去了解它们,去探索它们背后的奥秘。
怎么样,现在是不是对物质的微观结构有了更深刻的认识呢?是不是觉得这个世界更加神奇和有趣了呢?反正我是这么觉得的!。

物质与结构知识总结1. 引言物质与结构是化学领域中的重要知识,它们是研究化学反应和性质的基础。
本文将对物质与结构的相关知识进行总结,并介绍其在化学领域中的应用。
2. 物质的分类物质是指组成物质世界的实体,可以根据其组成和性质的不同进行分类。
2.1. 纯物质和混合物纯物质是指由相同种类的粒子组成的物质,可以进一步分为元素和化合物。
元素由具有相同原子数目的原子组成,化合物由两种或更多种元素以确定的比例结合而成。
混合物是由不同种类的物质以任意比例混合而成,可以进一步分为均匀混合物和非均匀混合物。
2.2. 物质的状态物质在不同条件下可以存在不同的状态,包括固体、液体和气体。
固体具有固定的形状和体积,分子之间间距小,分子振动能量较小;液体具有固定的体积但可流动,分子之间相互接触但没有固定的位置;气体具有没有固定形状和体积的性质,分子之间间距较大。
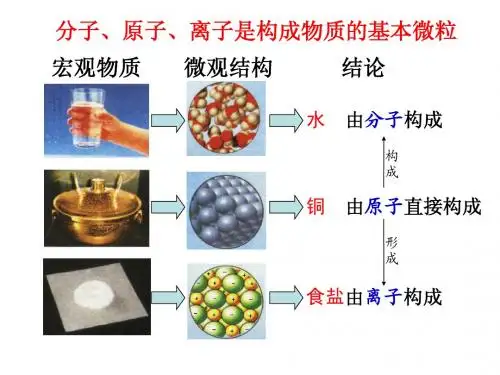
3. 基本粒子物质是由基本粒子构成的,基本粒子包括原子、分子和离子。
3.1. 原子原子是一种构成物质的基本颗粒,由质子、中子和电子组成。
质子带有正电荷,中子是中性的,电子带有负电荷。
原子的质量主要集中在核内的质子和中子上。
3.2. 分子分子是由原子以一定方式结合形成的,可以是同种元素的原子组成的分子,也可以是不同元素的原子组成的分子。
分子之间通过共价键连接。
3.3. 离子离子是带电的原子或分子。
正离子是由失去一个或多个电子形成的,负离子是由获得一个或多个电子形成的。
离子之间通过离子键连接。
4. 化学键和分子结构化学键是将原子和分子结合在一起的力。
常见的化学键包括共价键、离子键和金属键。
4.1. 共价键共价键是由共享电子而形成的化学键。
分子中的原子通过共用电子对来实现稳定。
4.2. 离子键离子键是由正负离子之间的相互吸引力而形成的化学键。
4.3. 金属键金属键是金属原子之间的电子云轨道重叠形成的化学键。
分子结构指的是分子中原子之间的排列方式和空间结构。
分子可以呈线性、平面或立体结构。