元素周期表-核素讲解
- 格式:ppt
- 大小:1.56 MB
- 文档页数:45


第三节核素1.元素、核素、同位素之间的区别和联系(1)元素、核素、同位素的比较元素核素同位素概念具有相同核电荷数的同类原子的总称具有一定数目的质子和一定数目的中子的一种原子质子数相同而中子数不同的同一种元素的不同原子互称为同位素范围宏观概念,指同类原子,既可是游离态又可是化合态微观概念,指某种原子微观概念,指某种元素的几种原子之间的关系特点只与质子数有关,与中子数、核外电子数无关不同的核素间质子数、中子数、电子数可能有相同处,也可能均不同同位素间质子数相同,化学性质相同,质量数不同,物理性质不同实例168O、188O、168O2-都属氧元素11H、21H、31H、4019K、4020Ca不同核素11H、21H、31H为氢的同位素(2)元素、核素、同位素之间的关系图例12007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。
下列关于20278Pt和19878Pt的说法正确的是( )A.20278Pt和19878Pt的质子数相同,互称为同位素B.20278Pt和19878Pt的中子数相同,互称为同位素C.20278Pt和19878Pt的核外电子数相同,是同一种核素D.20278Pt和19878Pt的质量数不同,不能互称为同位素解析20278Pt与19878Pt是同一种元素的不同原子,因此它们互称为同位素。
质子数相同而中子数不同的同一元素的不同原子之间互称为同位素。
元素原子的质子数和核外电子数相等。
有一定数目的质子和一定数目的中子的一种原子,就是一种核素。
答案 A2.元素的相对原子质量(1)元素的相对原子质量就是按照该元素各种同位素原子所占的一定百分比算出的平均值。
(2)元素的相对原子质量的计算设某元素有多种不同的核素,A、B、C……表示各核素的相对原子质量,a%、b%、c%……为各核素的原子数目百分数,则元素的相对原子质量计算式为Mr=A·a%+B·b%+C·c%+……例如,氯元素有3517Cl 和3717Cl 两种天然、稳定的同位素,3517Cl 的原子数目百分数为75.77%,3717Cl 的原子数目百分数为24.23%;3517Cl 的相对原子质量为34.969,3717Cl 的相对原子质量为36.966。




什么是核素_核素的基本介绍核素是指具有一定数目质子和一定数目中子的一种原子。
那么你对核素了解多少呢?以下是由店铺整理关于什么是核素的内容,希望大家喜欢!什么是核素核素是指具有一定数目质子和一定数目中子的一种原子。
很多元素有质子数相同而中子数不同的几种原子。
例如,氢有1H、2H、3H 3种原子,就是3种核素,它们的原子核中分别有0、1、2个中子。
这3种核素互称为同位素。
[1] 例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素。
原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素。
氧元素有16O,17O,18O三种核素。
具有多种核素的元素称多核素元素。
自然界仅有一种核素存在的元素称为单核素元素,如铍、氟、铝、钠等20种元素。
质子数为偶数的元素,可有较多的稳定核素,一般不少于3种,而质子数为奇数的元素,通常只有一个稳定核素,一般不会多于两种,这是由核子的结合能所决定的。
多核素元素中各核素互称同位素,因为它们处于周期表中同一位置上,化学性质基本相同,但核性质不同;单核素元素没有同位素。
核素的质量即原子质量,总小于孤立质子、中子和电子的质量总和,在概念上也不等于质量数,在数值上除12C外均与质量数稍有不同。
核素的质量是用质谱仪测定的,这种测定很先进,可测得7位或更多位有效数字。
原子序数、质量数、中子数三者之间的关系综述核素与核素的符号;原子序数、质量数、中子数三者之间的关系:具有一定核电荷数和质量数,并且具有同一能态的一种原子核或原子,称为一种核素。
核素常用符号AZX 表示,其中X是元素符号,Z是原子序数,A 是质量数,A-Z=N,N是该核素中的中子数。
由于元素符号X已经确定了它的原子序数,因此,通常核素也可简记为AX。
科学研究表明,稳定性核素对核子总数有一定限度(一般为A≤209),而且中子数和质子数应保持一定的比例(一般为N/Z=1~1.5,也有个别例外)。



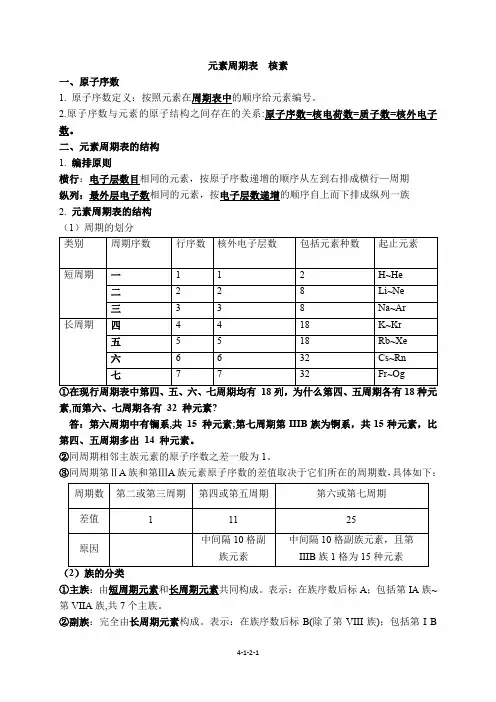
元素周期表核素一、原子序数1. 原子序数定义:按照元素在周期表中的顺序给元素编号。
2.原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=质子数=核外电子数。
二、元素周期表的结构1. 编排原则横行:电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行—周期纵列:最外层电子数相同的元素,按电子层数递增的顺序自上而下排成纵列一族2. 元素周期表的结构(1)周期的划分素,而第六、七周期各有32 种元素?答:第六周期中有镧系,共15 种元素;第七周期第IIIB族为锕系,共15种元素,比第四、五周期多出14 种元素。
②同周期相邻主族元素的原子序数之差一般为1。
③同周期第ⅡA族和第ⅢA族元素原子序数的差值取决于它们所在的周期数,具体如下:①主族:由短周期元素和长周期元素共同构成。
表示:在族序数后标A;包括第IA族~第VIIA族,共7个主族。
②副族:完全由长周期元素构成。
表示:在族序数后标B(除了第VIII族);包括第I B族~第VII B族和第VIII族共8个副族。
③0族:占据周期表的第18纵列,最外层电子数是8(He的最外层电子数是2)。
④在周期表中第VIII族元素包含8、910 三个纵列,而其他族只有一个纵列,故第VIII 族元素种类最多,这种判断对吗?答:这种判断是错误的,元素种类最多的族为第IIIB 族共32种元素(包括镧系元素和锕系元素)(2)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素的种数。
②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素的种数。
例如,氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。
(4)常见族的别称在元素周期表中,每一种元素均占据一个单元格。
每个单元格均包含元素的原子序数、元素符号、元素名称、相对原子质量(如图)。
说明:(1)左上角的数字是原子序数,原子序数=质子数=核电荷数=核外电子数;(2)右上角是元素符号;(3)中间是元素名称,名称的偏旁部首是“钅”的元素为金属(汞,金除外,汞和金是金属),其余为非金属;(4)正下方的数字为该元素的相对原子质量(相对原子质量≈中子数+质子数)。

核素的知识点总结一、核素的概念核素(Isotope)是指元素的同位素,也就是说,核素是指具有相同原子序数(即元素周期表中的序号)但具有不同质量数(即核中质子和中子的总数)的原子。
根据核素的定义,同一个元素可以存在多种不同的核素,比如碳元素就有碳-12、碳-13、碳-14等不同质量数的核素。
核素的命名方式通常是由元素名称加上其质量数构成。
比如氢元素有氢-1、氢-2和氢-3等不同质量数的核素。
由于同一个元素的核素具有相同的化学性质,因此核素的质量数也决定了其在化学反应中的行为。
二、核素的特性1. 质量数:核素的质量数是指核中质子和中子的总数。
不同的核素由于具有不同的质量数,因此在质量和密度上也存在着差异。
质量数越大的核素一般来说,在化学反应中要么不参与,要么参与的机会较小。
2. 核电荷数:核素的核电荷数是指核中的质子数,即元素周期表中元素的序数。
不同的核素具有不同的核电荷数,因此在化学反应和核反应中也存在着不同的行为。
3. 半衰期:核素的半衰期是指核素衰变到其原有数量的一半所需的时间。
半衰期决定了核素的放射性,具有较长半衰期的核素一般在自然界中存在,而具有较短半衰期的核素一般是放射性同位素。
4. 放射性:核素的放射性是指核素具有放射性衰变的性质,即放射出α粒子、β粒子或γ射线而转变成另一种核素的性质。
放射性决定了核素在医学、科学研究和核能领域的应用。
5. 核反应:核素在核反应中会发生核裂变或核聚变,从而放出大量的能量。
核能的利用和核武器的制造都离不开对核素的研究和控制。
三、核素的应用1. 医学应用:放射性同位素在医学诊断、治疗和放射疗法中有着重要的应用。
比如使用碘-131来治疗甲状腺疾病,使用钴-60和铯-137来进行放射疗法治疗癌症,使用锗-68和铍-72来进行核医学诊断。
2. 工业应用:放射性同位素在工业生产、材料检测、辐射灭菌、放射性定位和密封源等领域有着广泛的应用。
比如使用镭-226、钴-60和铯-137来进行辐射消毒,使用铀-235来进行核能发电,使用钚-239来进行核武器制造。
同主族:元素金属性、非金属性的递变第一章物质结构元素周期律第一节元素周期表(第三课时)学习目标1.了解元素、核素、同位素的含义2.会区别元素、核素、同位素等概念3.理解原子的各个符号表示的意义;Z X b A am问题探究:1、原子组成各个位置的符号表示何种含义?原子内两个关系: 电性关系是:质量关系是:Z X bA a m 3、如何理解元素的概念?2、所有的原子核中一定含有质子和中子吗?4.什么是核素?与H 所表示的意义是否相同?H 111H 、11H 、28O167、用Zn 与HCl 反应生成的H 2,只有一种分子吗?5.什么是同位素?是同位素吗?6、三种核素可以形成几种不同的氢气分子?1H31H 、11H 、2阅读课本9-10页内容1、原子组成各个位置的符号表示何种含义?原子内两个关系: 电性关系是质量关系是Z X bA am X-元素符号或原子,A-质量数,Z-质子数,a-电荷,b-化学式中原子的个数,m-化合价。
质量数(A) =质子数(Z) + 中子数(N)核电荷数=核内质子数=核外电子数3、如何理解元素的概念?质子数相同的粒子一定是同种元素吗?①“同一类”包括质子数相同的各种不同原子和相同原子在各种状态下的原子或离子。
②只论种类不论个数。
③元素是宏观概念,原子和分子是微观概念,元素组成物质,而不能说元素组成分子。
④一种元素可能含有多种核素.2、所有的原子核中一定含有质子和中子吗?不一定.原子核中一定含有质子但不一定有中子,如没有中子。
H11不是,如:NH 4+与Na. Na +5.什么是同位素?7、用Zn 与HCl 反应生成的H 2,只有一种分子吗?不是。
有6种氢气分子,因为氢气中的氢元素来自于HCl,而HCl中的氢元素全部来自于自然界中,且有三种核素。
是同位素吗?8O161H 、11H 、26、三种核素可以形成几种不同的氢气分子?1H31H 、11H 、2三种核素可以自身和它们之间两两组合形成6种不同的氢气分子。