《元素周期表》(核素)
- 格式:ppt
- 大小:1.31 MB
- 文档页数:25


2021人教版必修二第一章第一节《元素周期表》word教案【同步教育信息】一. 本周教学内容: 元素周期表 1、核素2、元素周期表 二. 重点、难点:元素周期表的结构。
三. 教学过程: (一)核素1、原子结构:原子由原子核和核外电子构成,原子核在原子的中心,由带正电的质子与不带电的中子构成,带负电的电子绕核作高速运动。
也确实是说,质子、中子和电子是构成原子的三种微粒。
在原子中,原子核带正电荷,其正电荷数由所含质子数决定。
(1)原子的电性关系:核电荷数 = 质子数 = 核外电子数(2)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。
质量数(A )= 质子数(Z )+ 中子数(N )(3)离子指的是带电的原子或原子团。
带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。
当质子数(核电荷数)>核外电子数时,该粒子是阳离子,带正电荷; 当质子数(核电核数<核外电子数时,该粒子是阴离子,带负电荷。
(4)原子组成的表示方法[练习1]填表:粒子符号 质子数(Z )中子数(N )质量数(N )用A Z X 表示为①O 8 18 ②Al 24 27 ③Ar 18 22④Cl3517Cl——元素符号 核电荷数—— (核内质子数) 质量数—— XAZ⑤H11H[练习2] (1)X 共有x 个电子,则N= (2)A X x-共的x 个电子,则N=(3)A 2-原子核内有x 个中子,其质量数为m ,则ng A 2-离子所含电子的物质的量为: 2、核素和同位素(1)核素:具有一定数目的质子和一定数目的中子的原子叫核素。
如如氢元素有11H 、21H 、31H 三种不同核素。
[练习]填表:[摸索] 是不是任何原子核差不多上由质子和中子构成的?(2)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
①同位素中“同位”的含义:指在元素周期表中占据同一个位置的意思。
如氕、氘、氚,即同一元素的不同核素之间互称为同位素。




第二课时元素周期表核素学习目标:1.知道元素周期表的发展历程,培养探索未知的意识。
2.能说出元素周期表的编排原则及其结构。
3.能根据原子序数确定元素在周期表中的位置。
4.知道核素、同位素的含义。
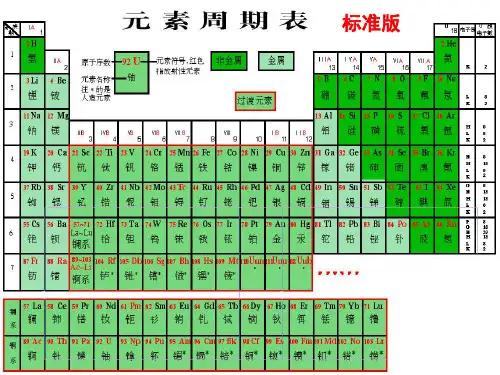
1.元素周期表的结构(1)原子核外电子排布的表现方法:原子结构示意图。
试写出下列原子的结构示意图。
(2)元素周期表的发展历程(3)元素周期表的编排原则①原子序数:按照元素在周期表中的顺序给元素编的序号。
②原子序数与元素的原子结构之间的关系:原子序数=核电荷数=质子数=核外电子数。
③横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
④纵行原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
(4)元素周期表的结构①周期a.含义:把电子层数相同的元素,按原子序数递增的顺序从左到右排列的一横行,叫做一个周期。
b.数目:元素周期表有7个横行,有7个周期。
c.特点:周期序数=该周期元素原子的电子层数。
d.分类:②族a.含义:元素周期表18个纵行中,除中间8、9、10三个纵行为一族外,其余每一纵行为一族。
b.数目:元素周期表中有18个纵行,但只有16个族。
c.特点:主族元素的族序数=该主族元素原子的最外层电子数。
d.分类e.常见族的别称(5)认识元素周期表的相关信息元素周期表中每个格中的信息(以Fe为例):2.元素周期表在元素推断中的应用(1)元素在周期表中的位置与原子结构的相互推断①元素的位置与原子结构的关系②填写符合条件的短周期元素符号a.族序数等于周期数的元素有H、Be、Al。
b.族序数是周期数的2倍的元素有C、S。
c.族序数是周期数的3倍的元素是O。
d.周期数是族序数的2倍的元素是Li。
e.周期数是族序数的3倍的元素是Na。
(2)由元素的原子序数推断元素在周期表中的位置。
3.核素同位素(1)核素①概念:具有一定数目质子和一定数目中子的一种原子。
②实例——氢的三种核素(2)同位素①概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素,即同一元素的不同核素互称为同位素。

第2课时元素周期表核素[核心素养发展目标] 1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、A Z X的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
一、元素周期表的编排原则与结构1.元素周期表的发展历程2.元素周期表的编排原则(1)原子序数:按照元素在周期表中的顺序给元素编的序号。
(2)原子序数=核电荷数=质子数=核外电子数。
(3)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(4)纵列原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
3.元素周期表的结构(1)周期(2)族个数元素周期表中有18个纵列,共有16个族特点主族元素的族序数=最外层电子数分类主族共有7个,包括第ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA族副族共有7个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族Ⅷ族包括第8、9、10三个纵列0族占据元素周期表的第18纵列,最外层电子数为8(He为2)(3)常见族的别称族别名第ⅠA族(除氢外)碱金属元素第ⅦA族卤族元素0族稀有气体元素4.元素周期表方格中的符号的意义(1)一个横行即是一个周期,一个纵列即是一个族()(2)每一周期都是碱金属元素开始,稀有气体元素结束()(3)同周期中元素电子层数一定相同()(4)同族元素的最外层电子数一定等于族序数()(5)0族元素的最外层电子数均为8()(6)元素周期表已发展成一个稳定的形式,它不可能再有新的变化了()答案(1)×(2)×(3)√(4)×(5)×(6)×1.最外层电子数是2的元素一定为第ⅡA族的元素吗?提示不一定,可能是第ⅡA族,也可能是0族或副族元素。



第一节元素周期表知识梳理一、原子结构1.构成原子的各粒子数之间的关系:质子数=核电荷数=核外电子数质量数(A)=质子数(Z)+中子数(N)2.核素:具有一定数目的质子和一定数目的中子的原子叫核素。
同位素:同一元素的不同核素间互称为同位素。
二、元素周期表1.元素周期表的结构(7个周期、16个族)三、元素的性质与原子结构1.碱金属的原子结构特点由此,我们可以得出碱金属元素在原子结构上:(1)相同点:最外层的电子数均为1。
(2)不同点:随着核电荷数的增多,电子层数增多。
2.钠、钾的性质比较钠钾与氧气的反应生成淡黄色的固体,产生黄色火焰产生紫色火焰,反应比钠剧烈与水的反应浮在水面上,熔化成闪亮的小球,到处游动并发出嘶嘶的响声浮、熔、游、动、响,且反应比钠快3.卤族单质的物理性质颜色:浅深;状态:气液固;密度:小大;熔沸点:低高;在水中的溶解性:大小。
4.卤族单质的化学性质(1)与氢气的反应名称反应条件现象化学方程式生成氢化物的稳定性F 2冷暗处爆炸H 2+F 2====2HF HF 很稳定Cl 2光照H 2+Cl 2光照2HCl HCl 稳定Br 2高温H 2+Br 2500℃2HBrHBr 较不稳定I 2高温持续加热H 2+I 2====2HIHI 很不稳定(2)卤族元素单质的置换反应实验内容现象方程式实验结论将少量新制的饱和氯水分别注入盛有NaBr 溶液和KI 溶液的试管中,用力振荡后,再注入少量四氯化碳,振荡。
观察四氯化碳层和水层的颜色变化静置后,液体分为两层。
上层液体呈无色,下层液体分别呈橙色、紫色2NaBr+Cl 2====2NaCl+Br 2 2KI+Cl 2====2KCl+I2随着核电荷数的增加,卤素单质的氧化性强弱顺序为:F 2>Cl 2>Br 2>I 2氧化性:逐渐减弱将少量的溴水注入盛有KI 溶液的试管中,用力振荡后,再注入少量的四氯化碳。
观察四氯化碳层和水层颜色的变化静置后,液体分为两层。
元素周期表核素一、原子序数1. 原子序数定义:按照元素在周期表中的顺序给元素编号。
2.原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=质子数=核外电子数。
二、元素周期表的结构1. 编排原则横行:电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行—周期纵列:最外层电子数相同的元素,按电子层数递增的顺序自上而下排成纵列一族2. 元素周期表的结构(1)周期的划分素,而第六、七周期各有32 种元素?答:第六周期中有镧系,共15 种元素;第七周期第IIIB族为锕系,共15种元素,比第四、五周期多出14 种元素。
②同周期相邻主族元素的原子序数之差一般为1。
③同周期第ⅡA族和第ⅢA族元素原子序数的差值取决于它们所在的周期数,具体如下:①主族:由短周期元素和长周期元素共同构成。
表示:在族序数后标A;包括第IA族~第VIIA族,共7个主族。
②副族:完全由长周期元素构成。
表示:在族序数后标B(除了第VIII族);包括第I B族~第VII B族和第VIII族共8个副族。
③0族:占据周期表的第18纵列,最外层电子数是8(He的最外层电子数是2)。
④在周期表中第VIII族元素包含8、910 三个纵列,而其他族只有一个纵列,故第VIII 族元素种类最多,这种判断对吗?答:这种判断是错误的,元素种类最多的族为第IIIB 族共32种元素(包括镧系元素和锕系元素)(2)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素的种数。
②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素的种数。
例如,氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。
(4)常见族的别称在元素周期表中,每一种元素均占据一个单元格。
每个单元格均包含元素的原子序数、元素符号、元素名称、相对原子质量(如图)。
说明:(1)左上角的数字是原子序数,原子序数=质子数=核电荷数=核外电子数;(2)右上角是元素符号;(3)中间是元素名称,名称的偏旁部首是“钅”的元素为金属(汞,金除外,汞和金是金属),其余为非金属;(4)正下方的数字为该元素的相对原子质量(相对原子质量≈中子数+质子数)。
第三讲 元素周期表(一)【知识要点】中子N(核素)原子核质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 : 决定原子呈电中性 电子数(Z 个):化学性质及最高正价和族序数体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化: ①、原子最外层电子数呈周期性变化元素周期律 ②、原子半径呈周期性变化③、元素主要化合价呈周期性变化 ④、元素的金属性与非金属性呈周期性变化①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期)周期(7个横行) ②、长周期(四、五、六周期)周期表结构 ③、不完全周期(第七周期)①、主族(ⅠA ~ⅦA 共7个)元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律决定编排依据具体表现形式X)(A Z 七主七副零和八三长三短一不全①、核电荷数,电子层结构,最外层电子数②、原子半径性质递变③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数:相同条件下,电子层越多,半径越大。
判断的依据核电荷数相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律: 3、同主族元素的离子半径随核电荷数的增大而增大。