三、核素(元素周期表)
- 格式:pptx
- 大小:140.57 KB
- 文档页数:18








学科教师辅导教案学员编号:年级:高二课时数:3学员姓名:辅导科目:化学学科教师:李红彦授课类型S- summarize A- ability S- special授课主题元素周期表授课日期及时段教学内容教学目标:1. 了解元素周期表的结构。
2.了解原子核外电子排布。
3. 依据原子构成了解原子序数、核电荷数、质子数、核外电子数的彼此关系和质子数、中子数、质量数之间的相互关系。
4.了解元素、核素和同位素的含义。
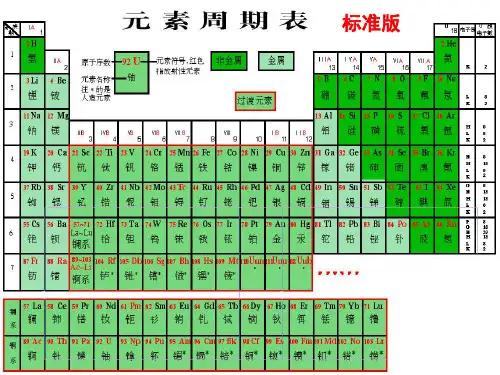
知识结构考点1:元素周期表1.元素周期表的发展历程(1)第一张元素周期表诞生:1869年,俄国化学家门捷列夫首制。
绘制依据:将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵行。
(2)元素周期表的演变演变:随着科学发展,元素周期表中为未知元素留下的空位先后被填满。
编排依据:由相对原子质量改为原子的核电荷数。
2.现行元素周期表的编排原则(1)原子序数(2)含义:按照元素在周期表中的顺序给元素编号。
(3)原子序数与原子结构之间的关系:(4)原子序数=质子数=核电荷数=核外电子数(5)现行元素周期表的排列原则横行:电子层数相同的元素,按原子序数递增的顺序从左到右排列;纵行:最外层电子数相同的元素,按电子层数递增的顺序从上到下排列。
3.元素周期表的结构(1)周期①数目:现行的元素周期表有7个横行,即7个周期。
②特点:同一周期中,元素的电子层数相同,且等于周期序数。
③分类:短周期:1、2、3周期长周期:4、5、6、7周期考点2:元素的性质与原子结构 1.碱金属的性质(1)物理性质:① 相似性:银白色金属(Cs 略带金色光泽)② 递变性:随着Li 、Na 、K 、Rb 、Cs 原子序数的增加,金属的硬度逐渐减小,单质的熔点逐渐降低。
(2)化学性质① 与非金属的反应 4Li+O 2===2Li 2O 2Na+O 2 ===Na 2O 2K+O 2===KO 2[超氧化钾,O 的化合价为(-1/2价)] ② 与水的反应2K +2H 2O_==2KOH_+H 2↑ 2Rb +2H 2O==2RbOH_+H 2↑小结:2M +2H 2O == 2MOH +H 2↑ 碱性:从上到下逐渐增强。

考纲要求:①了解元素、核素和同位素的含义。
②了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布规律。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属元素在周期表中的位置及其性质递变规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
知识点总结:中子N同位素(核素)原子核 → 质量数(A=N+Z )近似相对原子质量质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 : 素的 决定原子呈电中性电子数(Z 个):化学性质及最高正价和族序数核外电子 运动特征:体积小,运动速率高(近光速)排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图1.原子结构[核电荷数、核内质子数及核外电子数的关系]X)(A Z核电荷数=核内质子数=原子核外电子数注意:(1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数”与“电荷数”是不同的,Cl-的核电荷数为17,电荷数为1.[质量数] 用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.X的意义:表示元素符号为X,质量数为A,核电(2)符号AZNa中,Na原子的质量数为荷数(质子数)为Z的一个原子.例如,231123、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少.(2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称。
第一章物质结构元素周期表一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
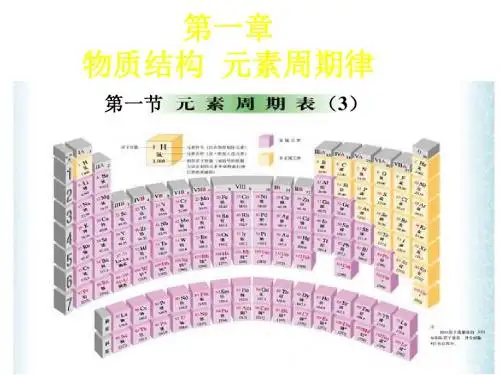
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、化学键化学键是相邻两个或多个原子间强烈的相互作用。
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键)极性共价键(简称极性键):由不同种原子形成,A-B型,如,H-Cl。